端粒酶基因的腺病毒包装条件优化及其活性功能验证
贺小英 荆乾鸽 姜欣颖 袁婷 吴宪 佟瑞莹 王晶妍 马利兵
摘要:【目的】构建携带人类端粒酶催化亚基基因(hTERT)的腺病毒载体并优化其包装条件,为进一步探究端粒酶与细胞重编程调控间的作用机理提供参考依据。【方法】利用腺病毒载体pAdEasy-1构建携带hTERT基因的重组腺病毒载体,分别采用脂质体法和电转法及不同浓度胎牛血清在HKE293A细胞中进行包装,筛选出最佳病毒包装条件,收集重组腺病毒rAd-hTERT并体外感染小鼠胎儿成纤维细胞,验证重组腺病毒rAd-hTERT的活性功能。【结果】以腺病毒载体pAdEasy-1为骨架质粒,成功构建获得携带hTERT基因的重组腺病毒载体(pAd-hTERT),其最佳病毒包装条件是采用脂质体法结合15%胎牛血清,此条件下收集获得的病毒滴度最高(1×1011 IFU/mL)。以携带hTERT基因的腺病毒rAd-hTERT感染小鼠胎兒成纤维细胞72 h后,可扩增出片段大小约3450 bp的目的基因条带,即hTERT基因在小鼠胎儿成纤维细胞中成功表达。【结论】采用脂质体法结合15%胎牛血清包装获得的携带hTERT基因重组腺病毒具有较高病毒滴度,感染小鼠胎儿成纤维细胞能成功表达hTERT基因,进一步证实端粒酶具有蛋白功能的生物学活性。
关键词: 端粒酶;腺病毒;细胞重编程;载体构建;病毒包装;功能验证
中图分类号: S814.8 文献标志码: A 文章编号:2095-1191(2019)06-1356-06
Abstract:【Objective】The aim of the study was to construct an adenoviral vector containing the telomerase catalytic subunit(hTERT) gene, optimize its packaging conditions and lay a foundation for further study of the interaction mechanism between telomerase and cell reprogramming. 【Method】The adenoviral vector containing the hTERT gene was constructed by using the AdEasy-1 system of recombinant adenovirus, and then it was packaged in HKE293A cells by liposome, electroporation and different serum concentrations of fetal bovine. The optimal packaging condition was selected. Recombinant adenovirus rAd-hTERT was collected and infected mouse fetal fibroblasts in vitro, and activity function of recombinant adenovirus rAd-hTERT was verified. 【Result】The recombinant adenoviral vector(pAd-hTERT) carrying hTERT gene was successfully constructed with recombinant adenovirus rAd-hTERT as skeleton plasmid. The optimal packaging condition was liposome method combining with 15% serum of fetal bovine. The titer of virus obtained under such condition was the highest(1×1011 IFU/mL). After 72 h of adenovirus(rAd-hTERT) carrying hTERT gene infected mouse fetal fibroblasts, target gene bands of 3450 bp was amplified, which meaned that hTERT gene was successfully expressed in mouse fetal fibroblasts. 【Conclusion】The recombinant adenovirus carrying hTERT gene has been successfully prepared by liposome method combining with 15% serum of fetal bovine. It has high virus titer. Infecting mouse fetal fibroblasts can successfully express hTERT gene, which further verifies that telomerase has biological activity of functional protein.
Key words: telomerase; adenovirus; cell reprogramming; vector construction; virus packaging; functional verification
收稿日期:2019-04-04
基金项目:国家自然科学基金项目(31560331,31660340);内蒙古自然科学基金项目[2017MS(LH)0213,2017MS0337]
作者简介:贺小英(1978-),博士,副教授,主要从事动物细胞重编程及转基因技术研究工作,E-mail:hxy1124@163.com
0 引言
【研究意义】端粒酶(Telomerase)是一种特殊的逆转录酶,能通过延长端粒进而参与细胞周期调控,而端粒酶基因是研究细胞衰老、癌症致病机理及制备永生化细胞系的关键基因(Leão et al.,2018;Spiegl-Kreinecker et al.,2018)。此外,端粒酶与细胞重编程密切相关,在细胞重编程过程中端粒酶主要调控端粒发生重编程(Shin et al.,2018),同时参与转录调控和代谢重编程(Zvereva et al.,2010)。因此,开展端粒酶基因研究是揭示细胞衰老、癌变及其重编程机制的关键。【前人研究进展】自2009年美国科学家伊丽莎白·布莱克本(Elizabeth H. Blackburn)、卡蘿尔·格雷德(Carol W. Greider)和杰克·绍斯塔克(Jack W. Szostak)因发现端粒和端粒酶是如何保护染色体而获得诺贝尔生理学及医学奖以来,端粒和端粒酶便成为生物学研究的热门领域之一(钟天映等,2009)。端粒酶不仅具有延长端粒长度的功能,还在调控细胞重编程的过程中发挥重要作用(Takasawa et al.,2018;贺小英等,2019)。Kinoshita等(2014)研究发现,当敲除供体细胞端粒酶催化亚基基因(TERT)使端粒酶失活后,细胞重编程中有75个基因表达上调,1571个基因表达下调,且多数与转录和表观修饰有关。Nishino和Umezawa(2016)研究发现,人类诱导多能干细胞(iPSC)与亲代细胞的TERT启动子存在差异甲基化区域(DMR),进一步证实端粒酶可通过改变甲基化修饰水平而调控细胞重编程进程。Takasawa等(2018)研究发现,在重编程人类iPSC的过程中,iPSC的TERT呈高度甲基化修饰,但供体细胞甲基化修饰水平较低,说明甲基化TERT-DMR能上调iPSC的启动子活性,从而调控细胞重编程进程。此外,Lanza等(2000)、Jeon等(2005)也曾研究发现克隆牛和克隆猪的端粒均发生重编程现象,这些研究结果进一步证实在体细胞核重编程过程中端粒酶调控端粒发生了重编程。至今,已在羊(Kishigami et al.,2008)、牛(Niemann et al.,2008)、猪(Cheng et al.,2012)和小鼠(Hidema et al.,2016)等不同物种上发现并证实端粒酶能有效提高细胞重编程效率。【本研究切入点】目前,有关端粒酶功能的研究主要集中在癌症和细胞衰老方面,而与细胞重编程结合相关的研究较少。腺病毒载体具有感染效率高、不整合宿主染色体等优点,是研究端粒酶基因体外表达的最佳系统,其包装效率则决定了目的基因表达的效果,因此非常有必要对腺病毒载体的包装条件进行优化。【拟解决的关键问题】构建携带人类TERT基因(hTERT)的腺病毒载体,优化其包装条件并鉴定端粒酶基因在小鼠胎儿成纤维细胞中的表达情况,为进一步探究端粒酶与细胞重编程调控间的作用机理提供参考依据。
1 材料与方法
1. 1 试验材料
大肠杆菌BJ5183菌株和DH5α感受态细胞、腺病毒载体pAdEasy-1、pCI-neo-hTERT及HKE293A细胞系均由内蒙古科技大学细胞工程实验室保存提供。DMEM培养、澳洲胎牛血清及0.25%胰酶等购自美国Gbico公司;脂质体2000购自Life公司;限制性内切酶Pac I和Pme I购自NEB公司;RT-PCR试剂盒及反转录试剂盒等购自北京全式金生物技术有限公司。
1. 2 重组腺病毒载体构建
参照He等(2011)的方法构建重组腺病毒载体。hTERT基因片段由pCI-neo-hTERT经Sal I和EcoR I双酶切获得,然后与pAdTrack-CMV穿梭载体连接,以获得重组质粒pAdTrack-hTERT。经Pme I线性化处理后,共转染pAdEasy-1骨架质粒,再通过转化DH5α感受态细胞筛选阳性克隆,重组腺病毒载体命名为pAd-hTERT。
1. 3 病毒包装及其滴度测定
以pAd-hTERT感染HKE293A细胞,荧光显微镜下监测病毒包装效率,感染7~10 d收集病毒,经3次反复冻融获得的病毒,命名为rAd-hTERT。用感染复数(MOI)测定法确定病毒量:将HKE293A细胞接种在6孔板中,每孔细胞量为106个,分别以2、5、10、25和50 μL病毒液感染HKE293A细胞,72 h后通过荧光及细胞形态观察是否产生病理学效应(CPE),病毒MOI为10~20 PFU/细胞时估算上清液中的病毒量。
1. 4 包装条件优化
为提高病毒滴度,采用不同方法和不同条件对病毒进行包装,通过病毒滴度及荧光鉴定对比脂质体法和电转法的包装效率。脂质体法是DNA与脂质体2000按1∶3比例进行转染;电转法(BTX电转仪)是参照周磊等(2015)研究得出的最优条件(300 V,75 μs,3次)。不同包装条件:在脂质体2000转染后的包装过程分别添加不同浓度(10%、12%、15%和20%)澳洲胎牛血清。通过流式细胞仪转染效率检测及病毒MOI估算确定最佳病毒包装条件。
1. 5 rAd-hTERT感染小鼠胎儿成纤维细胞
采用组织块贴壁法体外分离培养小鼠胎儿成纤维细胞,同时解冻rAd-hTERT病毒滴液,分别以MOI为10~20 PFU/细胞感染小鼠胎儿成纤维细胞,2 d后荧光显微镜下观察统计感染效率。
1. 6 RT-PCR鉴定rAd-hTERT活性功能
采用RT-PCR试剂盒提取阳性细胞mRNA:取3×105~5×105待测细胞加入500.0 μL TRIzol试剂,再加入100.0 μL氯仿,吸取水相层,加入0.25 mL异丙醇,取沉淀洗涤晾干后采用50.0 μL TE Buffer(RNase free)进行溶解并反转录合成cDNA。鉴定引物(5'-CCTGGAATCGGTCTGCTGCGC-3'和5'-CCCCCTA GCTGATCATCAGTCC-3')由上海捷瑞生物工程有限公司合成。PCR反应体系50.0 µL:10×LAGC Bu-ffer 25.0 μL,dNTP(2.5 mmol/L)8.0 μL,上、下游引物各1.0 μL,cDNA模板1.5 μL,LA Taq DNA聚合酶(5 U/μL)0.5 μL,以超纯水补足至50.0 µL。扩增程序:95 ℃预变性5 min;95 ℃ 30 s,55 ℃ 45 s,72 ℃ 30 s,进行40个循环;72 ℃延伸5 min。DNA序列测定由TaKaRa公司完成。
2 结果与分析
2. 1 重组腺病毒载体的构建
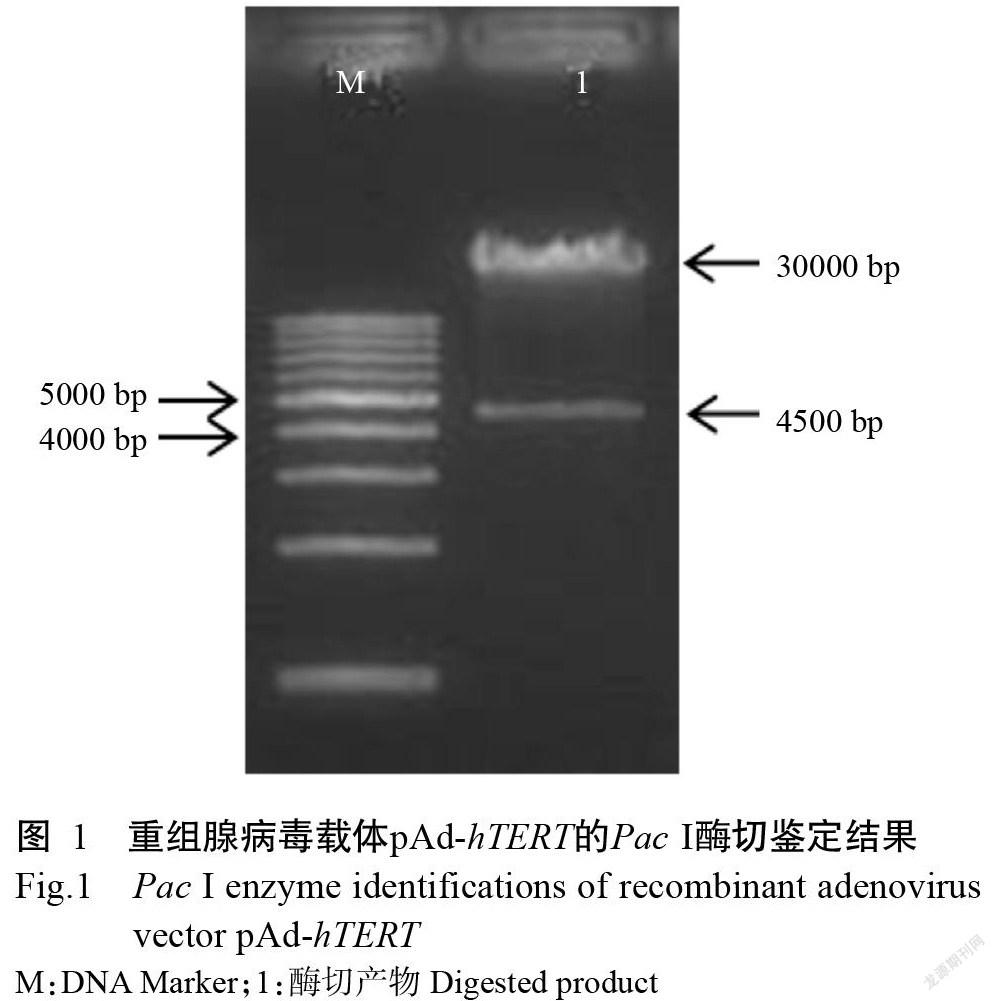
重组腺病毒载体pAd-hTERT经Pac I酶切后,琼脂糖凝胶电泳检测获得2条大小分别为4500和30000 bp的目的片段(图1),与预期结果一致,表明重组腺病毒载体pAd-hTERT构建成功。
2. 2 重组腺病毒包装结果
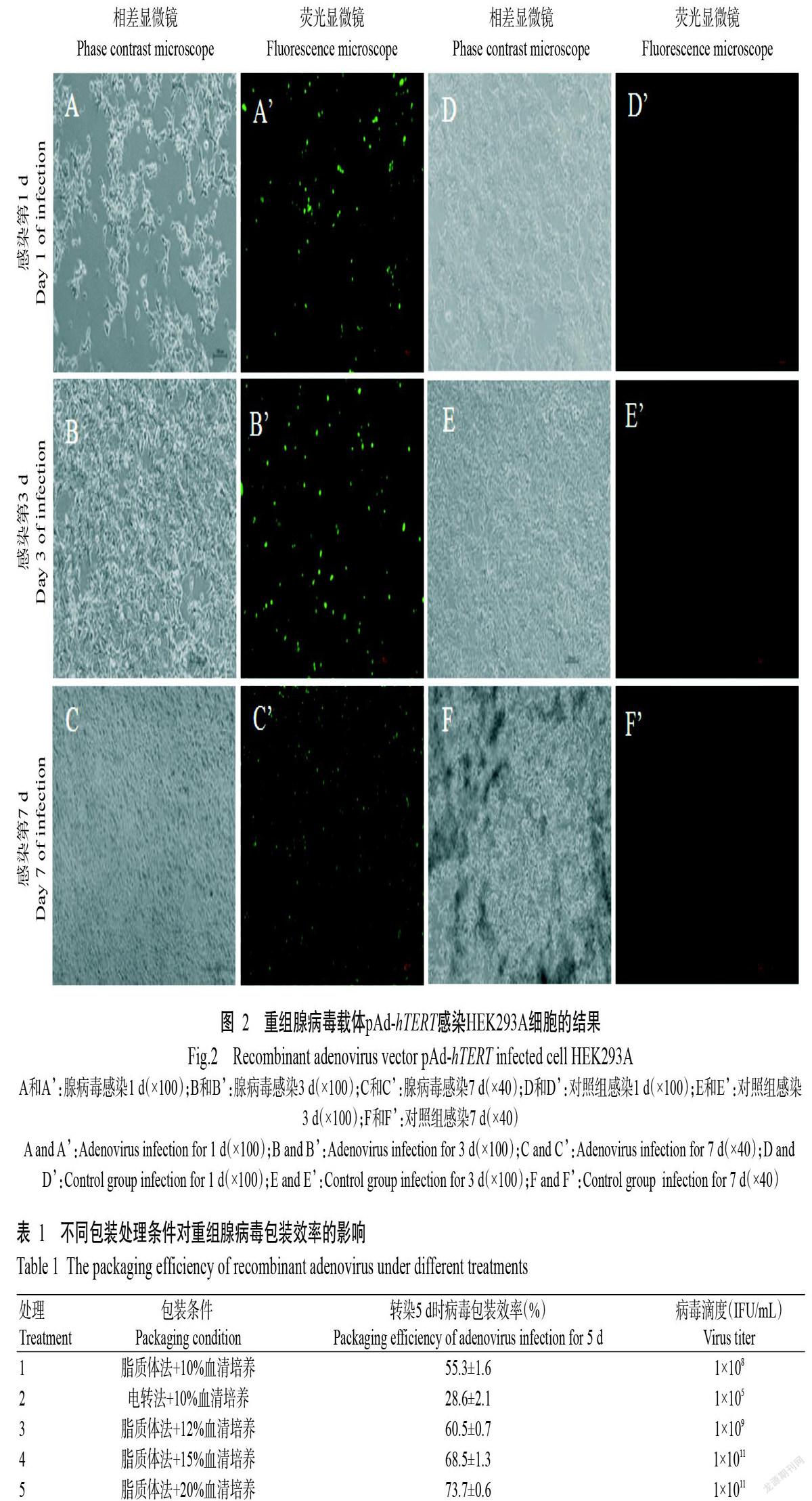
HKE293A细胞可为重组腺病毒载体pAd-hTERT提供所缺失的E1区,使其成为完整的腺病毒颗粒。重组腺病毒载体pAd-hTERT具有绿色荧光基因,在感染HKE293A细胞早期(第1 d和第3 d)观察到的荧光表达量较低(图2),说明此时病毒颗粒形成较少;至第7 d后可获得大量悬浮细胞,荧光表达量较高,且出现明显的CPE(图2),故选择此时收集重组腺病毒rAd-hTERT。
2. 3 重組腺病毒包装条件的优化
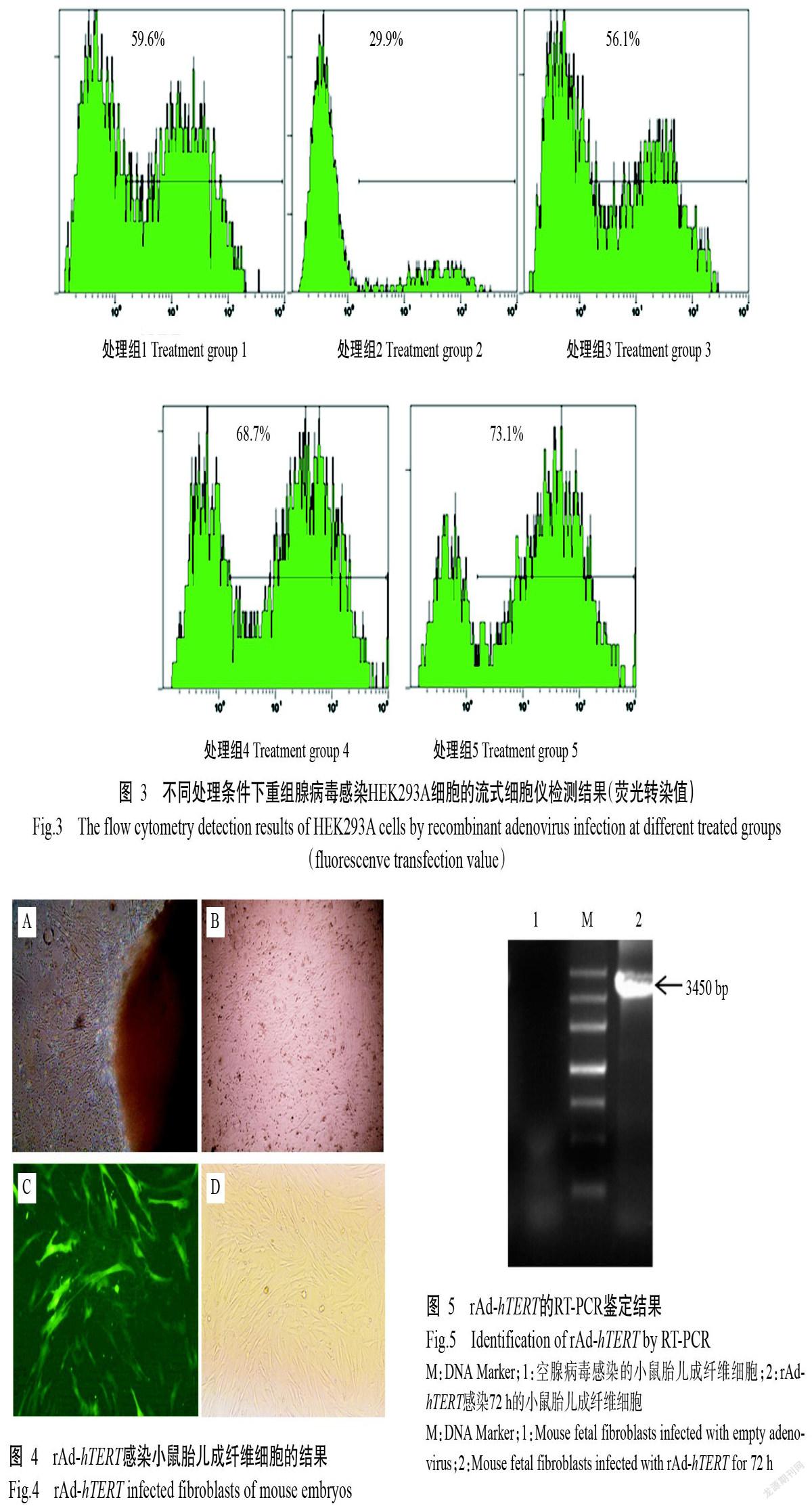
通过流式细胞仪检测不同包装处理条件下的病毒感染效率,并计算感染7~10 d后收集的病毒滴度,以此评价重组腺病毒包装效率。结果表明,脂质体法优于电转法,且胎牛血清对重组腺病毒的包装效率有一定影响,随胎牛血清浓度的增加,病毒包装效率及病毒滴度均呈增长趋势(表1和图3)。处理4与处理5相比,尽管病毒包装效率在高浓度胎牛血清中较高,但病毒滴度基本一致。综合考虑试验成本,因此确定处理4为最佳病毒包装条件,即脂质体法转染HEK293A细胞后采用15%胎牛血清进行病毒包装,该条件下收集获得的病毒滴度最高。
2. 4 rAd-hTERT感染小鼠胎儿成纤维细胞的特征
采用组织块贴壁法获取小鼠胎儿成纤维细胞,2 d后周边迁出长梭状细胞(图4-A),继续扩大培养至汇合度达90%以上(图4-B)时即可进行后续的感染试验。以携带hTERT基因的腺病毒(rAd-hTERT)感染小鼠胎儿成纤维细胞72 h后,发现其感染效率较高(图4-C和图4-D)。
2. 5 rAd-hTERT活性功能鉴定结果
采用RT-PCR鉴定hTERT基因在小鼠胎儿成纤维细胞中的表达情况,结果显示,从rAd-hTERT感染72 h的小鼠胎儿成纤维细胞中可扩增出预期的目的基因条带,片段大小约3450 bp(图5);而以空腺病毒载体感染的小鼠胎儿成纤维细胞未扩增出任何条带。
3 讨论
以腺病毒作为载体工具有诸多优点,包括生物安全性高、宿主范围较广、可搭载大多数蛋白基因等,已被广泛应用于基因功能研究及疾病模型构建等方面(刘玉玲和钟柏茂,2018)。重组腺病毒载体包装效率决定了目的基因表达的效果,而病毒包装效率主要取决于包装的方法及血清浓度、细胞状态等因素。本研究结果表明,采用脂质体包装腺病毒的效果明显优于电转法,虽然采用的电转法是参照周磊等(2015)研究得出的最优条件(300 V,75 μs,3次),但无论是包装荧光检测效果还是病毒滴度均不理想,可能与HEK293A细胞性质有关,其贴壁率较低,电刺激易使细胞成簇漂起且出现较多死亡细胞,因此包装不稳定。至今,有关腺病毒包装过程中胎牛血清浓度影响的研究鲜见报道。本研究发现,胎牛血清浓度在重组腺病毒包装过程中发挥较大作用,浓度越高其病毒包装效率及获得的病毒滴度也越高,可能与胎牛血清中含有的生长因子和活性蛋白有利于维持细胞体外活力有关,但胎牛血清的成本较高,因此最终确定重组腺病毒的最佳包装条件为:以脂质体法转染HEK293A细胞后采用15%胎牛血清进行病毒包装,该条件下病毒收集获得的滴度最高。
目前,有关端粒酶与细胞重编程互作方面的研究报道较少。Marion等(2009)研究认为只有供体细胞中具有端粒酶活性才能有效诱导产生细胞重编程;Huang等(2011)研究证实供体细胞缺乏端粒酶活性会引起DNA受损,进而阻碍细胞重编程。Pech等(2015)的研究结果也表明,端粒酶活性在胚胎发育和体细胞重编程过程中发挥着重要作用。本研究通过重组包装获得携带端粒酶基因的腺病毒(rAd-hTERT),并以其感染小鼠胎儿成纤维细胞,经RT-PCR鉴定证实,hTERT基因能在小鼠胎儿成纤维细胞中成功表达,且具有明显的生物学活性功能,但后续研究需利用免疫印迹试验及端粒酶活性检测试剂盒进一步检测验证端粒酶活性表达情况,为探究端粒酶与细胞重编程互作机制提供基础数据,进而有效提高细胞重编程效率,最终为哺乳动物体细胞核移植技术提供保障。
4 结论
采用脂质体法结合15%胎牛血清包装获得的携带hTERT基因重组腺病毒具有较高病毒滴度,感染小鼠胎儿成纤维细胞能成功表达hTERT基因,进一步证实端粒酶具有蛋白功能的生物学活性。
参考文献:
贺小英,荆乾鸽,姜欣颖,吴宪,兰宗宝,马利兵. 2019. 端粒酶与体细胞重编程的最新研究进展[J]. 南方农业学报,50(5):1133-1140. [He X Y,Jing Q G,Jiang X Y,Wu X,Lan Z B,Ma L B. 2019. Research progress of telomerase and somatic cell reprogramming[J]. Journal of Southern Agriculture,50(5):1133-1140.]
刘玉玲,钟柏茂. 2018. 腺病毒载体构建研究进展[J]. 国际儿科学杂志,(3):163-166. [Liu Y L,Zhong B M. 2018. Pro-gress on the construction of adenovirus vectors[J]. International Journal of Pediatrics,(3):163-166.]
钟天映,陈媛媛,毕利军. 2009. 端粒与端粒酶的研究——解读2009年诺贝尔生理学或医学奖[J]. 生物化学与生物物理进展,36(10):1233-1238. [Zhong T Y,Chen Y Y,Bi L J. 2009. Telomere and telomerase:To decode 2009 Nobel Prize in Physiology or Medicine[J]. Progress in Biochemistry and Biophysics,36(10):1233-1238.]
周磊,李強,李一星. 2015. 人胚肾细胞HEK293T电转染的方法:CN104846016A[P]. 2015-08-19. [Zhong L,Li Q,Li Y X. 2015. Method for electrotransfection of human embryonic kidney cell HEK293T:CN104846016A[P]. 2015-08-19.]
Cheng D,Li Z,Liu Y,Gao Y,Wang H. 2012. Kinetic analysis of porcine fibroblast reprogramming toward pluripotency by defined factors[J]. Cellular Reprogrammining,14(4):312-323.
He X Y,Zheng Y M,Lan J,Wu Y H,Yan J,He X N,Zhang T,He Y L,Zheng Y L,Zhang Y. 2011. Recombinant adenovirus-mediated human telomerase reverse transcriptase gene can stimulate cell proliferation and maintain primitive characteristics in bovine mammary gland epithelial cells[J]. Development,Growth & Differentiation,53(3):312-322.
Hidema S,Fukuda T,Date S,Tokitake Y,Matsui Y,Sasaki H,Nishimori K. 2016. Transgenic expression of Telomerase reverse transcriptase(Tert) improves cell proliferation of primary cells and enhances reprogramming efficiency into the induced pluripotent stem cell[J]. Bioscience,Biotechnology,and Biochemistry,80(10):1925-1933.
Huang J,Wang F,Okuka M,Liu N,Ji G,Ye X,Zuo B,Li M,Liang P,Ge W W,Tsibris J C,Keefe D L,Liu L. 2011. Association of telomere length with authentic pluripotency of ES/iPS cells[J]. Cell Research,21(5):779-792.
Jeon H Y,Hyun S H,Lee G S,Kim H S,Kim S,Jeong Y W,Kang S K,Lee B C,Han J Y,Ahn C,Hwang W S. 2005. The analysis of telomere length and telomerase activity in cloned pigs and cows[J]. Molecular Reproduction and Development,71(3):315-320.
Kinoshita T,Nagamatsu G,Saito S,Takubo K,Horimoto K,Suda T. 2014. Telomerase reverse transcriptase has an extratelomeric function in somatic cell reprogramming[J]. The Journal of Biological Chemistry,289(22):15776-15787.
Kishigami S,Wakayama S,Hosoi Y,Iritani A,Wakayama T. 2008. Somatic cell nuclear transfer:Infinite reproduction of a unique diploid genome[J]. Experimental Cell Research,314(9):1945-1950.
Lanza R P,Cibelli J B,Blackwell C,Cristofalo V J,Francis M K,Baerlocher G M,Mak J,Schertzer M,Chavez E A,Sawyer N,Lansdorp P M,West M D. 2000. Extension of cell life-span and telomere length in animals cloned from senescent somatic cells[J]. Science,288(5466):665-669.
Leão R,Apolónio J D,Lee D,Figueiredo A,Tabori U,Castelo-Branco P. 2018. Mechanisms of human telomerase reverse transcriptase (hTERT) regulation:Clinical impacts in cancer[J]. Journal of Biomedical Science,25(1):22. doi: 10.1186/s12929-018-0422-8.
Marion R M,Strati K,Li H,Tejera A,Schoeftner S,Ortega S,Serrano M,Blasco M A. 2009. Telomeres acquire embryonic stem cell characteristics in induced pluripotent stem cells[J]. Cell Stem Cell,4(2):141-154.
Niemann H,Tian X C,King W A,Lee R S. 2008. Epigenetic reprogramming in embryonic and foetal development upon somatic cell nuclear transfer cloning[J]. Reproduction,135(2):151-163.
Nishino K,Umezawa A. 2016. DNA methylation dynamics in human induced pluripotent stem cells[J]. Human Cell,29(3):97-100.
Pech M F,Garbuzov A,Hasegawa K,Sukhwani M,Zhang R J,Benayoun B A,Brockman S A,Lin S,Brunet A,Orwig K E,Artandi S E. 2015. High telomerase is a hallmark of undifferentiated spermatogonia and is required for maintenance of male germline stem cells[J]. Genes & Development,29(23):2420-2434.
Shin J,Kim J,Park H,Kim J. 2018. Investigating the role of Sirtuins in cell reprogramming[J]. BMB Reports,51(10):500-507.
Spiegl-Kreinecker S,Lötsch D,Neumayer K,Kastler L,Gojo J,Pirker C,Pichler J,Weis S,Kumar R,Webersinke G,Gruber A,Berger W. 2018. TERT promoter mutations are associated with poor prognosis and cell immortalization in meningioma[J]. Neuro-Oncology,20(12):1584-1593.
Takasawa K,Arai Y,Yamazaki-Inoue M,Toyoda M,Akutsu H,Umezawa A,Nishino K. 2018. DNA hypermethylation enhanced telomerase reverse transcriptase expression in human-induced pluripotent stem cells[J]. Human Cell,31(1):78-86.
Zvereva M I,Shcherbakova D M,Dontsova O A. 2010. Telomerase:Structure,functions,and activity regulation[J]. Biochemistry,75(13):1563-1583.
(責任编辑 兰宗宝)

