应用冠状动脉CT评估冠心病合并亚临床甲状腺功能减退病人的斑块特征
李玲 陈峰 刘岩


[摘要] 目的 應用冠状动脉CT评估冠心病合并亚临床甲状腺功能减退症(SCH)病人的斑块特征。方法收集我院2016年1月—2018年12月确诊SCH并经冠状动脉CT检查确诊为冠心病的病人46例(SCH组),并以同期甲状腺功能正常、经冠状动脉CT检查确诊为冠心病的病人46例作为对照(对照组)。对比分析两组病人的基线特征和斑块特征,其中斑块特征包括斑块性质及钙化积分,斑块性质又分为钙化斑块、非钙化斑块、混合斑块。
结果 SCH组病人的促甲状腺素(TSH)水平显著高于对照组(t=3.47,P<0.05),低密度脂蛋白胆固醇(LDL-C)升高病人的比例显著高于对照组(χ2=3.21,P<0.05),LDL-C水平也显著高于对照组(t=3.15,P<0.05),而两组高敏C反应蛋白(hs-CRP)水平差异无显著性(P>0.05)。SCH组的斑块钙化积分明显低于对照组(t=2.72,P<0.05);SCH组非钙化斑块的比例显著高于对照组(χ2=3.11,P<0.05),而对照组混合斑块的比例显著高于SCH组(χ2=2.74,P<0.05)。
结论 合并SCH的冠心病病人LDL-C水平较未合并SCH病人更高,非钙化斑块的比例明显升高,而混合斑块的比例较低。
[关键词] 冠状动脉疾病;甲状腺功能减退症;斑块,动脉粥样硬化;体层摄影术,X线计算机
[中图分类号] R541.4;R581.2
[文献标志码] A
[文章编号] 2096-5532(2019)06-0631-04
doi:10.11712/jms201906001
EVALUATION OF PLAQUE CHARACTERISTICS IN PATIENTS WITH CORONARY HEART DISEASE COMPLICATED BY SUBCLINICAL HYPOTHYROIDISM BY CORONARY COMPUTED TOMOGRAPHY
LI Ling, CHEN Feng, LIU Yan
(Department of Endocrinology, the 971th Hospital of the PLA Navy, Qingdao 266071, China)
[ABSTRACT] Objective To investigate the plaque characteristics in patients with coronary heart disease complicated by subclinical hypothyroidism (SCH) by coronary computed tomography (CT).
Methods A total of 46 patients who were diagnosed with SCH and coronary heart disease by coronary CT in our hospital from January 2016 to December 2018 were enrolled as SCH group, and 46 patients with normal thyroid function who were diagnosed with coronary heart disease by coronary CT during the same period of time were enrolled as control group. Baseline characteristics and plaque characteristics were compared between the two groups. Plaque characteristics included plaque properties and calcification score, and plaque properties were classified as calcified plaques, non-calcified plaques, and mixed plaques.
Results Compared with the control group, the SCH group had significantly higher level of thyroid stimulating hormone (t=3.47,P<0.05), proportion of patients with increased low-density lipoprotein cholesterol (LDL-C) (χ2=3.21,P<0.05), and level of LDL-C (t=3.15,P<0.05), and there was no significant difference in the level of high-sensitivity C-reactive protein between the two groups (P>0.05). Compared with the control group, the SCH group had a significantly lower calcification score (t=2.72,P<0.05) and a significantly higher proportion of patients with non-calcified plaques (χ2=3.11,P<0.05), and the control group had a significantly higher proportion of patients with mixed plaques than the SCH group (χ2=2.74,P<0.05).
Conclusion Compared with the patients with coronary heart disease and without SCH, the patients with coronary heart disease and SCH have a higher level of LDL-C, a higher proportion of patients with non-calcified plaques, and a lower proportion of patients with mixed plaques.
[KEY WORDS] coronary artery disease; hypothyroidism; plaque, atherosclerotic; tomography, X-ray computed
冠心病的经典危险因素包括血脂异常、高血压、糖尿病、吸烟等,冠心病的一级和二级预防主要是针对这些经典危险因素进行干预。但是接受标准的一级或二级预防的人群仍有心血管事件的发生,临床表现为心绞痛、心肌梗死等,因此有必要查找经典危险因素以外的冠心病危险因素并明确其特征。甲状腺素是一种重要的循环激素,可维持心血管稳态。促甲状腺素(TSH)升高导致的亚临床甲状腺功能减退症(SCH)与冠心病之间存在一定的关联性[1]。有研究显示,SCH病人的心血管疾病发病率和死亡率增加20%~80%[2-3],表明合并SCH的冠心病病人的预后较差。作为一种非传统的心血管疾病风险因素,SCH的作用常被低估,并且缺少相关的临床研究。斑块特征与冠状动脉事件是密切相关的,但目前对于冠心病合并SCH病人的斑块特征尚不清楚。冠状动脉CT可以精确评估冠状动脉狭窄程度,并具有无创、准确、简便的优势,可用于冠心病斑块特征的评估。本研究首次应用冠状动脉CT评估合并SCH的冠心病病人的冠状动脉斑块特征。现将结果报告如下。
1 对象与方法
1.1 研究对象
2016年1月—2018年12月,收集在我院诊治SCH并经冠状动脉CT检查确诊为冠心病的病人46例(SCH组)。SCH的诊断符合第8版《内科学》的诊断标准。冠心病的诊断标准为冠状动脉CT确定至少1支血管≥50%狭窄。该组病人均未使用甲状腺素替代治疗。按照1∶1配比,选择同期甲状腺功能正常、经冠状动脉CT检查确诊为冠心病的病人46例作为对照组。本研究得到了我院伦理委员会的批准,所有病人均签署了知情同意书。
1.2 研究方法
对比分析两组病人的基线特征和斑块特征,其中斑块特征使用X射线计算机断层成像仪(Aqui-
lion,佳能)自带的分析软件进行分析,包括斑块性质及钙化积分,斑块性质分为钙化斑块、非钙化斑块、混合斑块。
1.3 统计分析
采用SPSS 19.0统计软件进行分析。计量资料以±s表示,组间比较采用t检验;计数资料组间比较采用χ2检验或Fisher精确性检验。以P<0.05为差异有统计学意义。
2 结 果
2.1 两组基线特征比较
SCH组病人的TSH水平显著高于对照组(t=3.47,P<0.05),低密度脂蛋白胆固醇(LDL-C)升高病人的比例显著高于对照组(χ2=3.21,P<0.05),而且LDL-C水平也显著高于对照组(t=3.15,P<0.05),两组病人年龄、性别、糖尿病、高血压、高敏C反应蛋白(hs-CRP)水平等冠心病危险因素差异无显著性(P>0.05)。见表1。
2.2 两组冠状动脉斑块特征比较
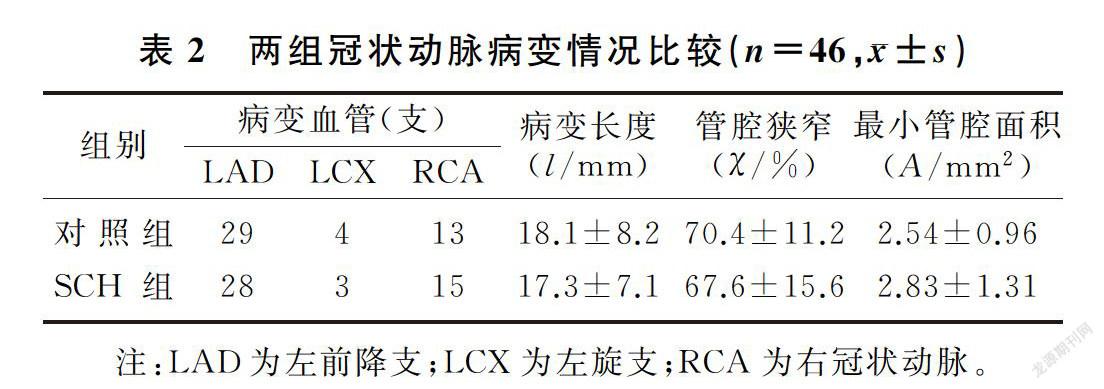
两组病变血管均为46支,SCH组共有斑块46个,对照组共有斑块66个。SCH组的斑块钙化积分明显低于对照组(t=2.72,P<0.05);SCH组非钙化斑块的比例显著高于对照组(χ2=3.11,P<0.05),而对照组混合斑块的比例显著高于SCH组(χ2=2.74, P<0.05)。两组斑块在血管中的分布、病变长度、管腔面积和血管狭窄程度等比较差异无显著性(P>0.05)。见表2、3。
3 讨 论
近年来研究发现,甲状腺功能减退是冠心病的又一危险因素,但目前对于冠心病合并甲状腺功能减退病人的冠状动脉斑块特征并不清楚。冠状动脉CT可准确评估冠状动脉血管的狭窄程度、斑块性质以及钙化程度,具有无创、简便的特点。故本研究应用冠状动脉CT评估冠心病合并SCH病人的冠状动脉斑块特征。
本文结果表明,合并SCH的冠心病病人较未合并SCH病人有更高的LDL-C水平,非钙化斑块的比例明显升高,而混合斑块的比例较低。分析产生这种差异的原因主要为SCH导致了以脂代谢紊乱为主的代谢异常。脂质代谢异常是动脉粥样硬化的主要原因之一,血脂升高使得血液中的脂质更易沉积于血管壁内膜,脂质与复合糖类在血管壁内膜聚集,引起血管壁内膜炎性反应,进一步导致纤维组织的增生、钙质的沉淀,逐渐使动脉血管壁失去弹性,血管腔变得狭窄,形成动脉粥样硬化斑块。有研究表明,SCH病人的TC、TG、LDL-C水平明顯升高[4-8]。TSH对血脂影响的具体机制较为复杂。有文献报道,TSH能够促进3-羟基-3-甲基戊二酸单酰辅酶A还原酶的表达,加快胆固醇合成的速率,促进胆固醇的合成,从而增加血浆中胆固醇的浓度[9-11]。SCH发生后,ATP结合盒转运子盒卵磷脂胆固醇酰基转运酶的活性降低,从而导致高密度脂蛋白颗粒的合成和成熟过程受到抑制,HDL-C的水平降低。本研究未观察到SCH组病人HDL-C水平低于对照组,可能与研究样本量小有关[12-13]。但本文研究结果显示,SCH组LDL-C升高病人的比例及LDL-C水平显著高于对照组,提示冠心病合并SCH病人的斑块形成及特征与更高的血脂水平相关。从斑块特征来看,SCH组有更高的非钙化斑块比例,在冠状动脉CT中,非钙化斑块代表腔内影像学中的脂质斑块[14],这从斑块特征方面证实了血脂升高在斑块形成中的作用。炎症在动脉粥样硬化的发生和进展中起重要作用,hs-CRP是肝脏合成的一种全身性炎症反应急性期的非特异性标志物,被认为是预测冠状动脉斑块不稳定的炎症标志物[15-16]。有文献报道,SCH病人的hs-CRP水平升高[17-19]。本研究中SCH组病人的hs-CRP水平虽然高于对照组,但差异无显著性,可能与本研究的样本量小有关,需要较大样本量和前瞻性设计的研究予以证实。
[參考文献]
[1]RODONDI N, DEN ELZEN W P, BAUER D C, et al. Subclinical hypothyroidism and the risk of coronary heart disease and mortality[J]. JAMA, 2010,304(12):1365-1374.
[2]CAPPOLA A R, FRIED L P, ARNOLD A M, et al. Thyroid status, cardiovascular risk, and mortality in older adults[J]. JAMA, 2006,295(4):1033-1041.
[3]HAK A E, POLS H A, VISSER T J, et al. Subclinical hypothyroidism is an independent risk factor for atherosclerosis and myocardial infarction in elderly women:the Rotterdam Study[J]. Ann Intern Med, 2000,132(4):270-278.
[4]WALSH J P, BREMNER A P, BYLSARA M K, et al. Dyslipidemia dysfunction and serum lipids:a community-based study[J]. Clin Endocrinol, 2015,63(6):670-675.
[5]MARAHA R K, TANDON N, GRAG M K, et al. Dyslipidemia in subclinical hypothyroidism in an Indian population[J]. Clin Biochem, 2016,44(14/15):1214-1217.
[6]LAWAY B A, WAR F A, SHAH S, et al. Alteration of lipid parameters in patients with subclinical hypothyroidism[J]. Int J Endocrinol Metab, 2014,12(3):e17496.
[7]HUESTON W J, PEARSON W S. Subclinical hypothyroidism and the risk of hypercholesterolemia[J]. Ann Fam Med, 2014,2(4):351-355.
[8]INECK B A. Effects of subclinical hypothyrodism and its treatment on serum lipids[J]. Ann Pharmacother, 2013,37(5):725-730.
[9]ZHANG Xiujuan, SONG Yongfeng, FENG Mei, et al. Thyroid-stimulating hormone decreases HMG-CoA reductase phosphorylation via AMP-activated protein kinase in the liver[J]. J Lipid Res, 2015,56(5):963-971.
[10]AHN C H, CHOI S H. New drugs for treating dyslipidemia:beyond statins[J]. Diabetes Metab J, 2015,39(2):87-94.
[11]JABBAR A, PINGITORE A, PEARCE S H, et al. Thyroid hormone and cardiovascular disease[J]. Nat Rev Cardiol, 2017,14:39-55.
[12]BOONE L R, LAGOR W R, MOYA MDA L, et al. Thyroid hormone enhances the ability of serum to accept cellular cholesterol via the ABCA1 transporter[J]. Atherosclerosis, 2011,218(1):77-82.
[13]MIKHAIL G S, ALSHAMMARI S M, ALENEZI M Y, et al. Increased atherogenic low-density lipoprotein cholesterol in untreated subclinical hypothyroidism[J]. Endocr Pract, 2014,14(5):570-575.
[14]VIRMANI R, BURKE A P, FARB A, et al. Pathology of the vulnerable plaque[J]. J Am Coll Cardiol, 2006,47(8 Suppl):C13-C18.
[15]ITHIKI T. Thyroid hormone and vascular remodeling[J]. J Atheroscler Thromb, 2016,23(3):266-275.
[16]JAYASINGH IA, PUTHURAN P. Subclinical hypothyroidia and the risk of hypercholesterolemia[J]. J Family Med Prism Care, 2016,5(5):809-816.
[17]CHRIST-CRAIN M, MEIER C, Guglielmetti M, et al. Elevated C-reactive protein and homocysteine values:cardiovascular risk factors in hypothyroidism? A cross-sectional and a double-blind, placebo-controlled trial[J]. Atherosclerosis, 2003,166(2):379-386.
[18]RIDKER P M. C-reactive protein and the prediction of cardiovascular events among those at intermediate risk:moving an inflammatory hypothesis toward consensus[J]. J Am Coll Cardiol, 2007,49(21):2129-2138.
[19]TSIMIKAS S, WILLERSON J T, RIDKER P M. C-reactive protein and other emerging blood biomarkers to optimize risk stratification of vulnerable patients[J]. J Am Coll Cardiol, 2006,47(8 Suppl):C19-C31.

