槲皮素对人骨髓瘤细胞U266侵袭和迁移的影响
杨军岭 李晓晴 王莉 杨侠
[摘要] 目的 研究槲皮素對骨髓瘤细胞U266侵袭和迁移的影响及机制。
方法 用不同浓度的槲皮素处理人骨髓瘤细胞U266,噻唑蓝(MTT)方法测定细胞存活变化,计算其半数抑制浓度。人骨髓瘤细胞U266分为空白对照组(不做药物处理)、阳性对照组(用地西他滨处理)、槲皮素组(半数抑制浓度的槲皮素处理)、PDTC组(NF-κB信号抑制剂PDTC处理)、PDTC+槲皮素组(半数抑制浓度的槲皮素和PDTC处理)共5组进行细胞培养。各组以MTT检测细胞存活能力,划痕愈合实验检测细胞运动能力,Transwell小室检测细胞侵袭和迁移能力,蛋白免疫印迹(Western blot)检测细胞中基质金属蛋白酶2(MMP-2)、核因子-κBp65亚型(NF-κBp65)和基质金属蛋白酶9(MMP-9)蛋白表达水平。
结果 槲皮素组、PDTC组、PDTC+槲皮素组细胞存活、侵袭、迁移能力及细胞中MMP-2、MMP-9、NF-κBp65表达水低于空白对照组(F=28.419~167.394,P<0.001)。PDTC+槲皮素组细胞存活、侵袭、迁移能力及细胞中MMP-2、MMP-9、NF-κBp65表达水平低于槲皮素组和PDTC组(P<0.05)。
结论 槲皮素能够通过抑制NF-κB信号通路降低骨髓瘤细胞的侵袭和迁移能力。
[关键词] 多发性骨髓瘤;槲皮素;肿瘤侵润;肿瘤转移;NF-κB
[中图分类号] R733.3;R977.29
[文献标志码] A
[文章编号] 2096-5532(2019)06-0643-05
doi:10.11712/jms201906004
[开放科学(资源服务)标识码(OSID)]
EFFECT OF QUERCETIN ON THE INVASION AND MIGRATION OF HUMAN MYELOMA U266 CELLS
YANG Junling, LI Xiaoqing, WANG Li, YANG Xia
(Department of Pharmaceutical, Air Force 986 Hospital, Xi′an 710054, China)
[ABSTRACT] Objective To investigate the effect of quercetin on the invasion and migration of human myeloma U266 cells and related mechanisms.
Methods Human myeloma U266 cells were treated with different concentrations of quercetin. MTT assay was used to measure the change in cell viability, and median inhibitory concentration was calculated. Human myeloma U266 cells were divided into blank control group (without treatment), positive control group (treated with decitabine), quercetin group (treated with quercetin at its median inhibitory concentration), pyrrolidine dithiocarbamate (PDTC) group (treated with the NF-κB signaling pathway inhibitor pyrrolidine dithiocarbamate), and PDTC+quercetin group (treated with quercetin at its median inhibitory concentration and PDTC) for cell culture. MTT assay was used to measure cell viability; the wound healing test was used to evaluate the invasion and migration abilities of cells; Western blot was used to measure the protein expression of matrix metalloproteinase-2 (MMP-2), nuclear factor-kappa B (NF-κB) p65, and matrix metalloproteinase-9 (MMP-9).
Results Compared with the blank control group, the quercetin group, the PDTC group, and the PDTC+quercetin group had significantly lower cell viability, invasion and migration abilities, and expression of MMP-2, MMP-9, and NF-κBp65 (F=28.419-167.394,P<0.001). Compared with the quercetin group and the PDTC group, the PDTC+quercetin group had significantly lower cell viability, invasion and migration abilities, and expression of MMP-2, MMP-9, and NF-κBp65 (P<0.05).
Conclusion Quercetin can reduce the invasion and migration of myeloma cells by inhibiting the NF-κB signaling pathway.
[KEY WORDS] multiple myeloma; quercetin; neoplasm invasivenes; neoplasm metastasis; NF-kappa B
骨髓瘤是一种恶性浆细胞增殖疾病,造血干细胞移植、新型药物的应用等大大提高了骨髓瘤病人的生存期,但是由于骨髓瘤具有易复发、转移快等特点,寻找有效的骨髓瘤治疗方法对病人预后具有重要意义[1]。槲皮素具有抗肿瘤活性,其可以抑制乳癌、卵巢癌、胃癌等肿瘤细胞的生长和转移,但其具体的作用机制尚不明确[2-4]。核因子-κB(NF-κB)是一种在人体内广泛存在的信号转导通路,参与炎症、氧化应激、细胞生长、细胞迁移等多种生理和病理过程,其在恶性肿瘤组织中过度激活,NF-κB抑制剂能够下调肿瘤细胞的恶性表型[5-7]。相关研究显示,槲皮素能够下调肺癌等细胞中NF-κB的激活水平,槲皮素抗肿瘤活性可能与NF-κB信号通路抑制有关[8-9]。有研究结果显示,槲皮素具有抗多发性骨髓瘤细胞生长的作用,槲皮素处理后的NCI-H929细
胞株的存活能力降低[10]。因此,本研究探讨了槲皮素对骨髓瘤细胞增殖、迁移及侵袭的影响及其机制,旨在为延长骨髓瘤病人生存期提供参考。
1 材料与方法
1.1 实验材料
1.1.1 药品、试剂和细胞 HRP标记的二抗购自北京索莱宝科技有限公司,槲皮素购自大连美仑生物技术有限公司,基质金属蛋白酶-2(MMP-2)抗体购自美国Proteintech,基质金属蛋白酶-9(MMP-9)抗体购自美国Santa Cruz公司,NF-κB信号抑制剂PDTC购自美国Sigma公司,核因子-κBp65亚型(NF-κBp65)抗体购自美国Abbkine,人骨髓瘤细胞U266购自上海江林生物科技有限公司(细胞以含体积分数0.10胎牛血清的RPMI 1640培养液培养。细胞培养参数为:37 ℃,饱和湿度,体积分数0.05 CO2培養箱)。
1.1.2 重要仪器 SpectraMax iD3酶标仪购自美国Molecular Devices,TE2000-U倒置显微镜购自日本尼康公司,TGL-18M离心机购自上海卢湘仪离心机仪器有限公司,1658001垂直电泳槽购自美国Bio-Rad。
1.2 实验方法
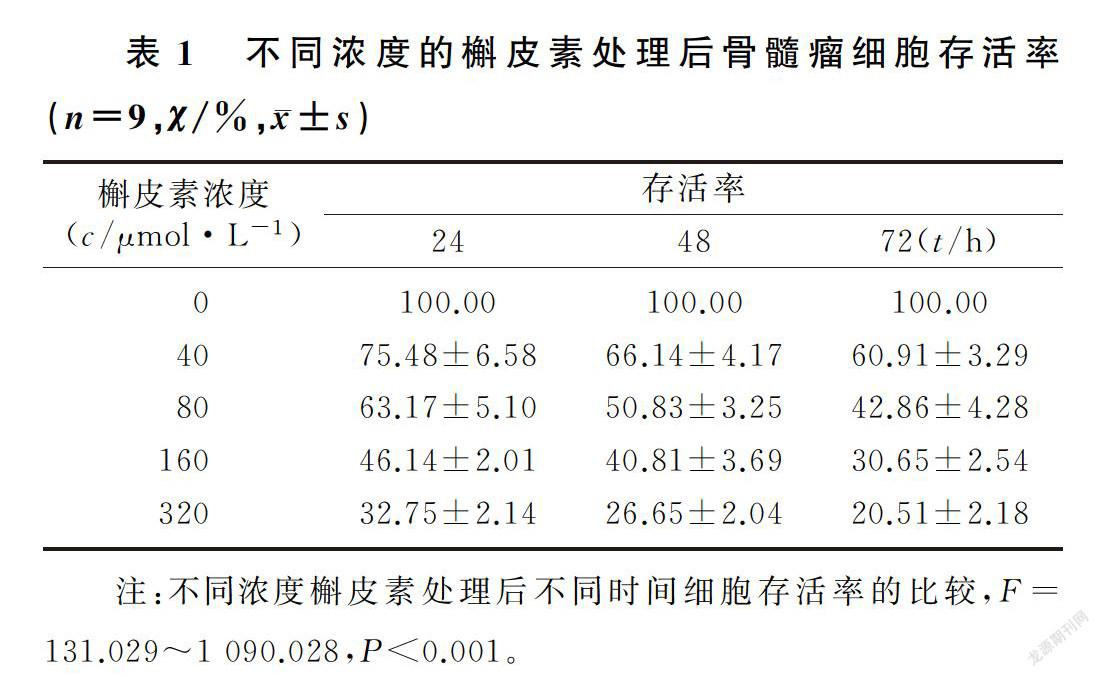
1.2.1 噻唑蓝(MTT)检测槲皮素对骨髓瘤细胞存活影响 取生长至对数期的人骨髓瘤细胞U266,以2.5 g/L的胰蛋白酶消化后,接种到96孔培养板中(接种密度为2×107/L,每孔添加100 μL),放在37 ℃、饱和湿度、体积分数0.05的CO2培养箱中培养过夜。在细胞中添加槲皮素,使槲皮素终浓度分别为0、40、80、160、320 μmol/L,继续培养24 h后,将培养板小心取出,添加20 μL的MTT,置于37 ℃结合4 h,弃上清液。添加二甲基亚砜溶液100 μL,放在振荡器上反应10 min,以酶标仪测定490 nm波长处的光密度(OD)值。经空白孔调零以后,设置0 μmol/L作用组细胞存活率为100%,分析40、80、160、320 μmol/L浓度的槲皮素处理后细胞存活率变化。实验设3个复孔,重复3次。
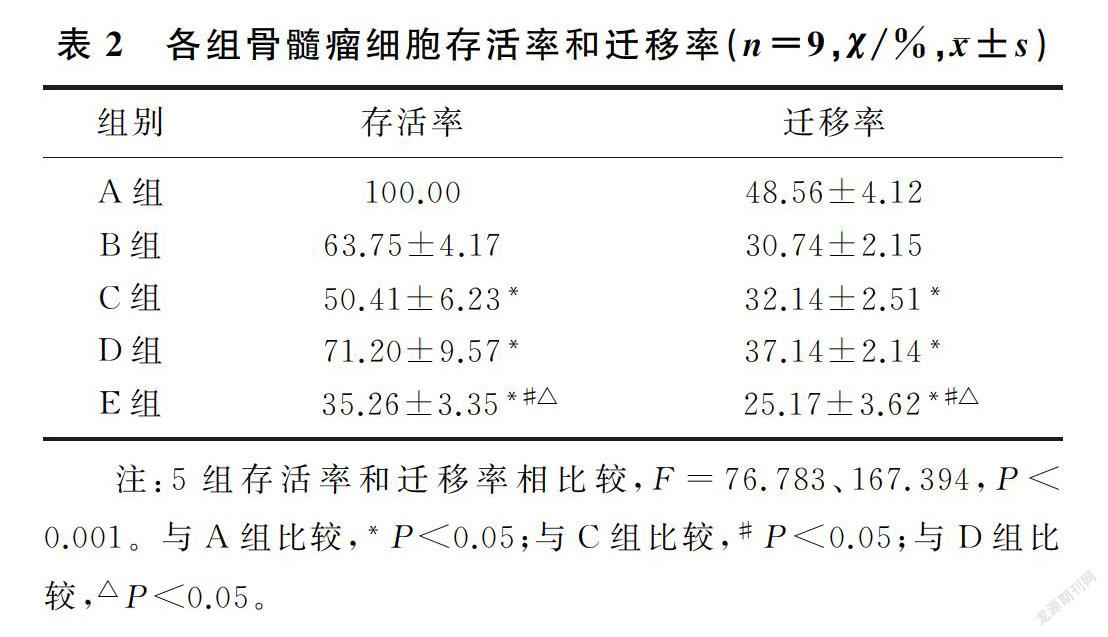
1.2.2 细胞分组 人骨髓瘤细胞U266依次分为:空白对照组(A组)、阳性对照组(B组)、槲皮素组(C组)以及PDTC组(D组)以及PDTC+槲皮素组(E组)共计5组。槲皮素组:采用含有槲皮素终浓度为130 μmol/L的细胞培养液培养;PDTC组:采用含有PDTC终浓度为50 μmol/L的细胞培养液进行培养;PDTC+槲皮素组:采用槲皮素终浓度为130 μmol/L和PDTC终浓度为50 μmol/L的细胞培养液培养;空白对照组:使用不添加槲皮素、地西他滨以及PDTC的细胞培养液培养;阳性对照组:在实验0 h时用3.2 mmol/L的地西他滨细胞培养液培养。以MTT方法检测各组细胞不同培养时间细胞存活率变化,步骤同1.2.1。
1.2.3 Transwell小室检测细胞侵袭和迁移能力
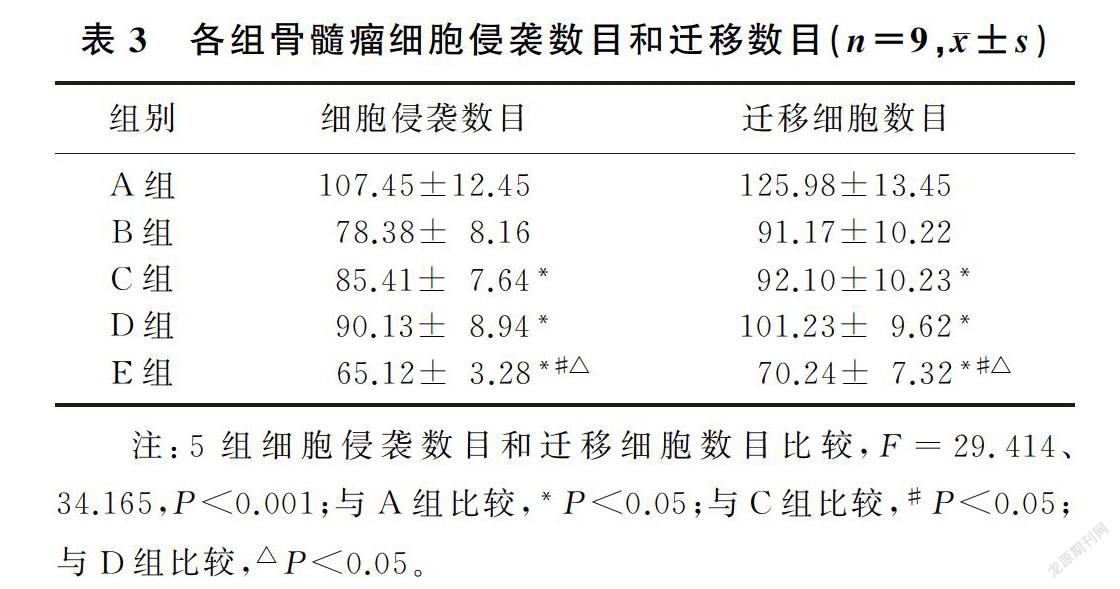
在Transwell小室中添加RPMI 1640稀释的浓度为100 mg/L的Matrigel,放在37 ℃湿化。取空白对照组、阳性对照组、槲皮素组、PDTC组、PDTC+槲皮素组细胞,用不含血清的培养液悬浮,在Transwell小室的上室内添加105个细胞(200 μL),分别在下室中添加600 μL的含体积分数0.10胎牛血清的RPMI 1640培养液,放在37℃、体积分数0.05 CO2培养箱中继续培养24 h。将小室取出,用棉签擦掉没有穿膜的细胞。甲醇固定,吉姆萨染色,光镜下选取5个视野观察侵袭细胞数目。Transwell小室细胞迁移实验同侵袭实验,迁移实验前不用Matrigel湿化。实验设3个复孔,重复3次。
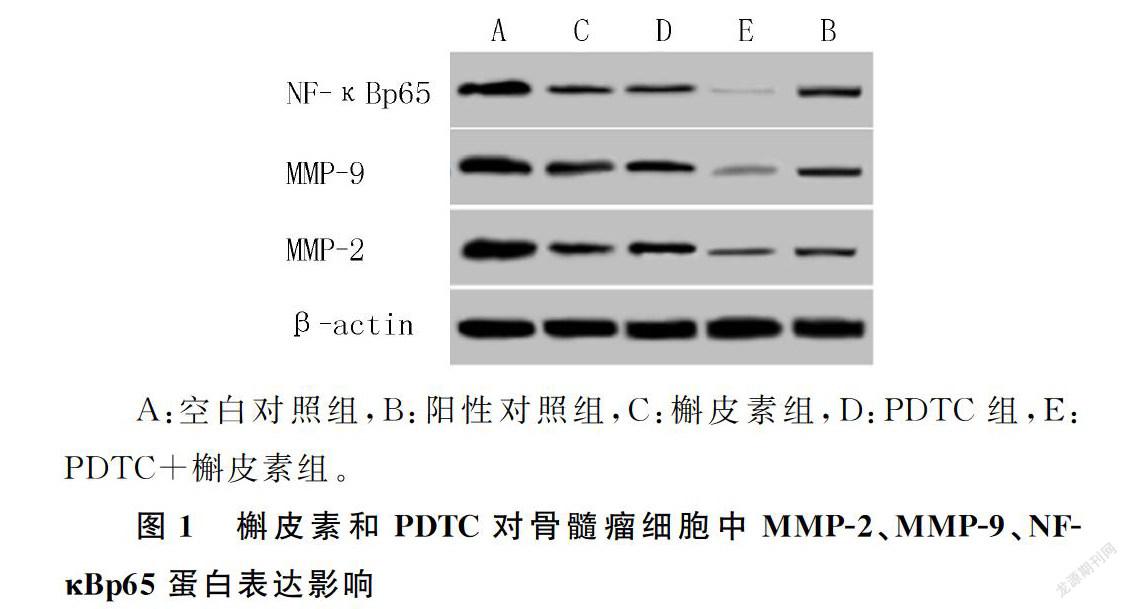
1.2.4 蛋白免疫印迹(Western blot)检测细胞中MMP-2、MMP-9、NF-κBp65蛋白表达 空白对照组、阳性对照组、槲皮素组、PDTC组、PDTC+槲皮素组细胞按照上述方法培养24 h,用常规方法分别提取细胞中的总蛋白,蛋白样品保存在-80 ℃。SDS-PAGE电泳后在冰上转膜70 min。将电转后的NC膜取出,置于含体积分数0.05牛血清清蛋白的封闭液中孵育结合2.0 h。NC膜再与MMP-2、MMP-9、NF-κBp65抗体稀释液在4 ℃过夜反应以后,与HRP标记的二抗反应2.0 h,以ECL发光试剂盒发光。用Quantity One软件扫描分析MMP-2、MMP-9、NF-κBp65条带和内参β-actin条带的灰度值,分析目的条带表达水平。MMP-2、MMP-9、NF-κBp65抗体分别以1∶600、1∶600、1∶400稀释,HRP标记的二抗以1∶4 000稀释。
1.3 统计分析方法
采用SPSS 21.0统计软件进行分析。计量资料数据以±s形式表示,多组间均数的比较采用单因素方差分析,组间两两比较采用SNK(Student-Newman-Keuls)法。
P<0.05为差异有统计学意义。
2 结 果
2.1 槲皮素对骨髓瘤细胞存活能力影响
用40、80、160、320 μmol/L的槲皮素处理后的骨髓瘤细胞,在培养24、48、72 h细胞存活率均降低(F=131.029~1 090.028,P<0.001),槲皮素可以呈浓度依赖性地抑制骨髓瘤细胞存活。计算24 h其半数抑制浓度为(128.58±11.46)μmol/L,选用130 μmol/L的槲皮素处理骨髓瘤细胞做后续实验。见表1。
2.2 槲皮素联合PDTC对骨髓瘤细胞存活和运动能力影响
槲皮素和NF-κB信号通路抑制剂处理后的骨髓瘤细胞存活率和迁移率均降低,槲皮素和NF-κB信号通路抑制剂联合处理后骨髓瘤细胞的存活率和迁移率低于槲皮素或NF-κB信号通路抑制劑单独处理的细胞(F=28.419、66.610,P<0.001)。槲皮素联合NF-κB信号通路抑制剂能够协同降低骨髓瘤细胞存活和运动能力。见表2。
2.3 槲皮素联合PDTC对骨髓瘤细胞侵袭迁移能力影响
槲皮素和NF-κB信号通路抑制剂处理后的骨髓瘤细胞侵袭数目和迁移数目均降低,槲皮素和NF-κB信号通路抑制剂联合处理后骨髓瘤细胞的侵袭数目和迁移数目低于槲皮素或NF-κB信号通路抑制剂单独处理的细胞(F=29.414、34.165,P<0.001)。槲皮素联合NF-κB信号通路抑制剂能够协同降低骨髓瘤细胞侵袭和迁移能力。见表3。
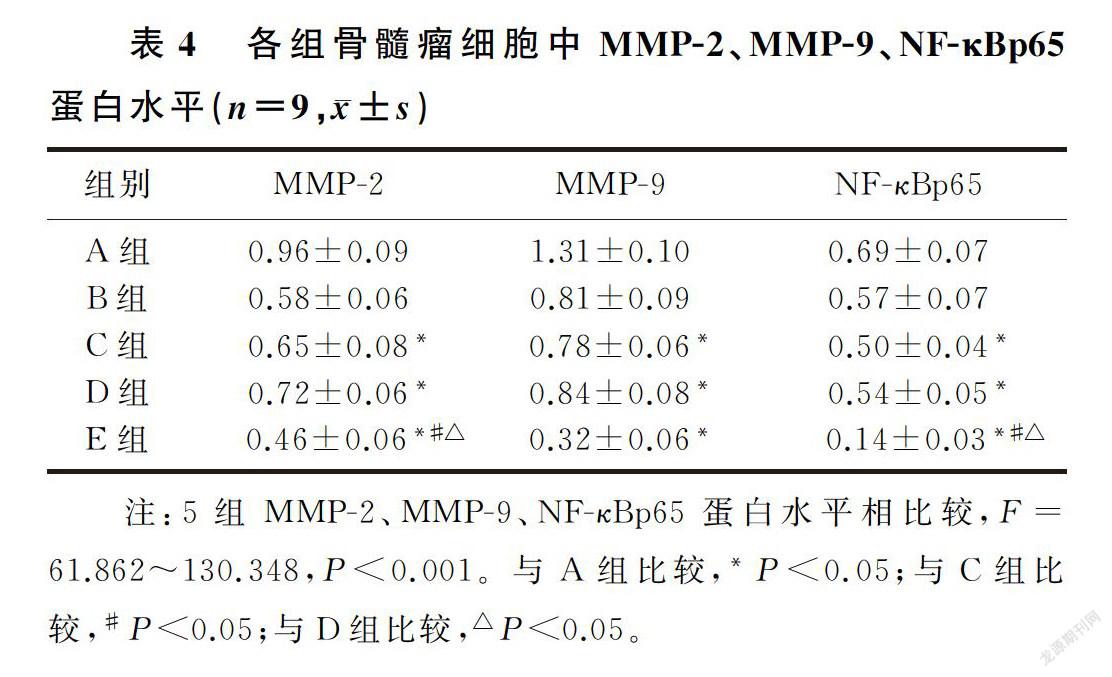
2.4 槲皮素联合PDTC对骨髓瘤细胞中相关蛋白表达影响
槲皮素和NF-κB信号通路抑制剂处理后的骨髓瘤细胞中MMP-2、MMP-9、NF-κBp65蛋白表达水平均降低,槲皮素和NF-κB信号通路抑制剂联合处理后骨髓瘤细胞中MMP-2、MMP-9、NF-κBp65蛋白表达水平低于槲皮素或NF-κB信号通路抑制剂单独处理的细胞(F=61.862~130.348,P<0.001)。槲皮素联合NF-κB信号通路抑制剂能够协同抑制骨髓瘤细胞中MMP-2、NF-κBp65、MMP-9蛋白表达。见图1和表4。
3 讨 论
槲皮素是一种黄酮类的化合物,具有扩张冠状动脉、抗血小板聚集、抗过敏、镇痛等药理作用[11]。
目前的研究表明,槲皮素具有抗肿瘤细胞生长的作用,其可以下调前列腺癌、膀胱癌等肿瘤细胞的生长和侵袭能力[12-13]。本实验的结果表明,不同浓度的槲皮素处理后的人骨髓瘤细胞U266的存活能力降低,细胞的侵袭、迁移和运动能力下降,说明槲皮素不仅具有抗骨髓瘤细胞生长的作用,还具有抑制骨髓瘤细胞转移潜能的作用。
NF-κB是一种转录调控因子,是由多个亚单位组成的蛋白家族,包括Rel、RelB、NF-κBp52、NF-κBp65等,其中NF-κBp65是目前发现的NF-κB信号转导中的必需成员,其表达水平高低与NF-κB信号的激活呈正相关[14-16]。NF-κB具有多种生物学作用,在炎症、免疫调节等方面具有重要作用,NF-κB还参与动脉粥样硬化、肿瘤、低氧复氧组织损伤等病理过程[17-19]。NF-κB在肿瘤组织中过度激活,抑制NF-κB信号通路能够下调肿瘤细胞的恶性表型[20-22]。在肺腺癌等肿瘤病理过程中已经证实,槲皮素可以抑制NF-κB信号通路的激活[8]。本实验的结果也表明,槲皮素能够下调骨髓瘤细胞中NF-κBp65的表达,并且槲皮素和NF-κB信号通路抑制剂具有协同抗骨髓瘤细胞存活、运动、迁移和侵袭的作用,说明槲皮素可以通过抑制NF-κB信号通路的激活调控骨髓瘤细胞的恶性表型。
肿瘤转移是肿瘤引起死亡的重要原因,肿瘤细胞合成的基质金属蛋白酶是肿瘤细胞侵袭和迁移的基础[23-26]。基质金属蛋白酶含有多个蛋白家族成员,这些蛋白家族成员能够降解几乎所有的细胞外基质成分,其中MMP-2和MMP-9是目前研究发现的与肿瘤转移关系最为密切的基质金属蛋白酶成员,二者表达水平升高标志着肿瘤细胞转移能力增加[27-29]。本实验的结果显示,槲皮素和NF-κB信号通路抑制剂能够协同抑制骨髓瘤细胞中MMP-2和MMP-9蛋白表达水平,说明二者能够通过抑制细胞合成MMP-2和MMP-9发挥抗骨髓瘤细胞迁移和侵袭的作用。
综上所述,槲皮素能够抑制骨髓瘤细胞的存活、侵袭、迁移和运动能力,其作用机制可能与抑制NF-κB信号激活和降低MMP-2、MMP-9蛋白表达水平有关。目前对于槲皮素靶向调控NF-κB信号通路的具体机制尚不清楚。本实验结果为研究槲皮素在骨髓瘤细胞迁移中具体作用机制奠定了基础,为研究槲皮素抗肿瘤机制提供了参考,为提高骨髓瘤的治愈率提供了新思路。本实验存在一定的局限性,没有在多株骨髓瘤细胞和体内进行验证,在以后的实验中会对上述部分以及槲皮素的具体作用机制进行探讨。
[参考文献]
[1]GAY F, ENGELHARDT M, TERPOS E, et al. From transplant to novel cellular therapies in multiple myeloma: Euro-
pean Myeloma Network guidelines and future perspectives[J]. Haematologica, 2018,103(2):197-211.
[2]WU Q, NEEDS P W, LU Y, et al. Different antitumor effects of quercetin,quercetin-3′-sulfate and quercetin-3-glucuronide in human breast cancer MCF-7 cells[J]. Food & Function, 2018,9(3):1736-1746.
[3]TIWARI H, KARKI N, PAL M, et al. Functionalized graphene oxide as a nanocarrier for dual drug delivery applications: the synergistic effect of quercetin and gefitinib against ovarian cancer cells[J]. Colloids and Surfaces B-Biointerfaces, 2019,178(1):452-459.
[4]SHANG H S, LU H F, LEE C H, et al. Quercetin induced cell apoptosis and altered gene expression in AGS human gastric cancer cells[J]. Environmental Toxicology, 2018,33(11):1168-1181.
[5]YANG Bin, YAN Ping, YANG Guangzhao, et al. Triptolide reduces ischemia/reperfusion injury in rats and H9C2 cells via inhibition of NF-κB, ROS and the ERK1/2 pathway[J]. International Journal of Molecular Medicine, 2018,41(6):3127-3136.
[6]LIU L, AHN K S, SHANMUGAM M K, et al. Oleuropein induces apoptosis via abrogating NF-kappa B activation cascade in estrogen receptor-negative breast cancer cells[J]. Journal of Cellular Biochemistry, 2019,120(3):4504-4513.
[7]GRINBERG-BLEYER Y, CARON R, SEELEY J J, et al. The alternative NF-κB pathway in regulatory T cell homeostasis and suppressive function[J]. The Journal of Immunology, 2018, 200(7):2362-2371.
[8]WU T C, CHAN S T, CHANG C N, et al. Quercetin and chrysin inhibit nickel-induced invasion and migration by downregulation of TLR4/NF-kappa B signaling in A549 cells[J]. Chemico-Biological Interactions, 2018,292(25):101-109.
[9]MENG Lingquan, YANG Feiya, WANG Mingshuai, et al. Quercetin protects against chronic prostatitis in rat model through NF-kappa B and MAPK signaling pathways[J]. The Prostate, 2018,78(11):790-800.
[10]FATMA G, ISSAM S, RAWYA S, et al. Antioxidant potential of four species of natural product and therapeutic strategies for cancer through suppression of viability in the human multiple myeloma cell line U266[J]. Biomedical and Environmental Sciences, 2019,32(1):22-33.
[11]KUNDUR S, PRAYAG A, SELVAKUMAR P, et al. Synergistic anticancer action of quercetin and curcumin against triple-negative breast cancer cell lines[J]. Journal of Cellular Physiology, 2019,234(7):11103-11118.
[12]SUN S, GONG F, LIU P, et al. Metformin combined with quercetin synergistically repressed prostate cancer cells via inhibition of VEGF/PI3K/Akt signaling pathway[J]. Gene, 2018,664(20):50-57.
[13]LEE Y H, TUYET P T. Synthesis and biological evaluation of quercetin-zinc (Ⅱ) complex for anti-cancer and anti-metastasis of human bladder cancer cells[J]. In Vitro Cellular & Developmental Biology-Animal, 2019,55(6):395-404.
[14]SINGH A K, FECHTNER S, CHOURASIA M, et al. Critical role of IL-1 in IL-1-induced inflammatory responses: coo-
peration with NF-κBp65 in transcriptional regulation[J]. FASEB Journal, 2019,33(2):2526-2536.
[15]陈亚利,欧阳军,孟晶茜,等. 姜黄素对高尿酸血症大鼠肾组织中TGF-β1,NF-κB表达的影响[J]. 郑州大学学报(医学版), 2018,53(3):360-364.
[16]王宏,王瑞英,刘志红,等. TGF-β1及NF-κBP65在妊娠期甲亢大鼠子代肾脏中的表达[J]. 河北医科大学学报, 2019,40(3):281-285,291.
[17]YANG Shujun, LI Jian, CHEN Yu, et al. MicroRNA-216a promotes M1 macrophages polarization and atherosclerosis progression by activating telomerase via the Smad3/NF-kappa B pathway[J]. Biochimica et Biophysica Acta-Molecular Basis of Disease, 2019,1865(7, SI):1772-1781.
[18]陈伟,马磊,杨立山. 甘草次酸对哮喘大鼠的抗氧化应激作用及 NF-κB 信号通路的调控[J]. 郑州大学学报(医学版), 2016,51(6):762-765.
[19]NAN Jing, WANG Yuxin, YANG Jinbo, et al. IRF9 and unphosphorylated STAT2 cooperate with NF-kappa B to drive IL6 expression[J]. Proceedings of the National Academy of Sciences of the United States of America, 2018,115(15):3906-3911.
[20]MING Xiaoyan, ZHANG Xu, CAO Tingting, et al. RHCG suppresses tumorigenicity and metastasis in esophageal squamous cell carcinoma via inhibiting NF-κB signaling and MMP1 expression[J]. Theranostics, 2018,8(1):185-198.
[21]TANIGUCHI K, KARIN M. NF-kappa B, inflammation, immunity and cancer: coming of age[J]. Nature Reviews Immunology, 2018,18(5):309-324.
[22]REN L, LI Z, DAI C, et al. Chrysophanol inhibits proliferation and induces apoptosis through NF-κB/cyclin D1 and NF-κB/Bcl-2 signaling cascade in breast cancer cell lines[J]. Molecular Medicine Reports, 2018,17(3):4376-4382.
[23]ZHOU Yongping, CHEN Yigang, DING Wenzhou, et al. LncRNA UCA1 impacts cell proliferation, invasion, and migration of pancreatic cancer through regulating miR-96/FOXO3[J]. IUBMB Life, 2018,70(4):276-290.
[24]王善容,丁月云,朱宗平,等. SPECT/CT融合骨顯像诊断肺癌单发骨转移的价值[J]. 山东大学学报(医学版), 2018,56(2):41-46.
[25]WOODCOCK C C, HUANG Y, WOODCOCK S R, et al. Nitro-fatty acid inhibition of triple-negative breast cancer cell viability,migration,invasion, and tumor growth[J]. Journal of Biological Chemistry, 2018,293(4):1120-1137.
[26]GUAN Yanxing, ZHANG Mengzhi, CHEN Xuezhong, et al. Lnc RNA SNHG20 participated in proliferation, invasion, and migration of breast cancer cells via miR-495[J]. Journal of Cellular Biochemistry, 2018,119(10):7971-7981.
[27]FENG S Q, ZHANG X Y, FAN H T, et al. Up-regulation of LncRNA MEG3 inhibits cell migration and invasion and enhances cisplatin chemosensitivity in bladder cancer cells[J]. Neoplasma, 2018,65(6):925-932.
[28]DINICOLA S, MASIELLO M G, PROIETTI S, et al. Nicotine increases colon cancer cell migration and invasion through epithelial to mesenchymal transition (EMT): COX-2 involvement[J]. Journal of Cellular Physiology, 2018,233(6):4935-4948.
[29]LIN C C, KUO C L, HUANG Y P, et al. Demethoxycurcumin suppresses migration and invasion of human cervical can-
cer HeLa cells via inhibition of NF-κB pathways NF-kappa B[J]. Anticancer Research, 2018,38(5):2761-2769.

