均匀分散的抗菌类药品供试液及其上清液对菌落回收的影响
佘 凡,高 翔
(1.陕西省杨凌农业高新技术产业示范区药品检验监测评价中心微生物室,陕西 杨凌 712100;2.陕西省食品药品监督检验研究院,陕西 西安 710065)
微生物限度检查方法适用性试验和微生物限度检查首先均需要均匀分散的供试液及其上清液,2010年版《中国药典(一部)》对有抑菌性的样品进行离心沉淀,取上清液混合[1],但2015年版《中国药典(四部)》删除了该方法[2-3]。本研究旨在考察均匀分散的抗菌类药品供试液与其上清液的抑菌性是否等同,现报道如下。
1 材料
仪器:HTY-601型集菌仪(杭州泰林生物技术设备有限公司);FC752型薄膜过滤器、LS-B50L型压力蒸汽灭菌器(上海华线医用核子仪器公司);HFsafe-760S型生物安全柜(上海精宏实验设备有限公司);MJ-250-Ⅲ型霉菌培养箱(上海跃进医疗器械有限公司);SPX-150型生化培养箱(上海金杨州惠科电子有限公司)。
试药:甲硝唑片(金华企业<集团>股份有限公司,批号为170915,规格为每片0.2 g);红霉素肠溶片(西安利君制药有限责任公司,批号为1608439-1,规格为每片0.125 g);盐酸左氧氟沙星片(山东鲁抗医药集团赛特有限责任公司,批号为170601,规格为每片0.1 g);吐温80(天津市天理化学试剂有限公司);无水硫酸镁(西陇化工股份有限公司)。
培养基、稀释液、冲洗液、中和剂:胰酪大豆胨液体培养基(TSB,批号为150922)、胰酪大豆胨琼脂培养基(TSA,批号为 160204)、沙氏葡萄糖液体培养基(SDB,批号为150801),沙氏葡萄糖琼脂培养基(SDA,批号为160602),pH6.8 磷酸盐缓冲液(PBS,批号为20170317),pH7.0氯化钠蛋白胨缓冲液(批号为 20170310),均购自北京路桥技术有限责任公司。
菌属:金黄色葡萄球菌(Staphylococcus aureus)〔CMCC(B)26003〕、铜绿假单胞菌(Pseudomonas aeruginosa)〔CMCC(B)10104〕、枯草芽孢杆菌(Bacillus subtilis)〔CMCC(B)63501〕、白色念珠菌(Candida albicans)〔CMCC(F)98001〕、黑曲霉(Aspergillus niger)〔CMCC(F)98003〕,均来源于中国医学菌种保藏中心。
2 方法与结果
2.1 菌液制备
将金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌分别接种于TSB中,33℃培养24 h;接种白色念珠菌的新鲜培养物至SDB中,23℃培养48 h。上述培养物用无菌0.9%氯化钠溶液制成适宜浓度的菌悬液;将黑曲霉的新鲜培养物接种至SDA上,23℃培养7 d,洗脱孢子,收集孢子悬液,用含0.05%吐温80的无菌0.9%氯化钠溶液制成含菌103~104cfu/mL孢子悬液。
2.2 供试液制备
甲硝唑片供试液上清液(A1液):取甲硝唑片10 g,加TSB至100mL,40℃条件下水浴振摇10 min,使充分溶解,静置30min,使出现明显分层,取上清液,制成1∶10(V/V)的 A1液,用 TSB 进一步稀释成 1 ∶20,1∶50,1 ∶100(V/V)的系列溶液。
甲硝唑片均匀分散供试液(A2液):同A1液制备方法,不静置,吸取前用力振摇,使分散均匀,制成A2系列溶液。
红霉素肠溶片供试液上清液(B1液):取红霉素肠溶片适量,置无菌研钵研成粉末,取10 g,加pH6.8 PBS至100 mL,40 ℃条件下水浴振摇 10 min,静置30min,取上清液,制成 1∶10(V/V)的 B1液,再用 pH6.8 PBS进一步稀释成1∶100(V/V)的B1液。
红霉素肠溶片均匀分散供试液(B2液):同B1液制备方法,不静置,吸取前用力振摇,使分散均匀,制成B2液。
盐酸左氧氟沙星片供试液上清液(C1液):取供试品10 g,加pH7.0氯化钠蛋白胨缓冲液定容至100 mL,其余同A1液制备方法,制成1∶10(V/V)的C1液,再用pH7.0氯化钠蛋白胨缓冲液进一步稀释成1∶100的C1液。
盐酸左氧氟沙星片均匀分散供试液(C2液):同C1液制备方法,不静置,吸取前用力振摇,使分散均匀,制成C2液。
2.3 方法适用性试验
2.3.1 A1液及A2液方法适用性试验(平皿法)
试验组:取A1系列溶液各9.9 mL,加相应菌液0.1 mL,充分混匀,使小于100 cfu/mL,各取1 mL置平皿中。菌液组:取TSB 9.9 mL,其余同试验组方法。供试品对照组:取A1系列溶液,加TSB 0.1 mL,充分混匀,各取1 mL置平皿中,加入TSA或SDA,置规定温度培养。同法操作A2系列溶液。甲硝唑片敏感菌株金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌在A1液中的回收比值大于A2液,金黄色葡萄球、铜绿假单胞菌随着稀释级的增大,药物浓度的降低,A1液和A2液回收比值[回收比值=(试验组平均菌落数-供试品对照组平均菌落数)/菌液组平均菌落数]差距逐渐缩小。详见表1。
2.3.2 B1液及B2液方法适用性试验(平皿法)
取B1系列溶液及B2系列溶液各9.9 mL,分组及操作均同2.3.1项下方法。B1液中铜绿假单胞菌、金黄色葡萄球菌、枯草芽孢杆菌,B2液中金黄色葡萄球菌、枯草芽孢杆菌、铜绿假单胞菌的回收比值均不超过0.11,表明此3种菌为红霉素肠溶片敏感菌株。详见表2。冲洗液对照组回收比值=冲洗液对照组平均菌落数/菌液组平均菌落数。

表1 A1液及A2液各组菌落数及回收比值

表2 B液回收比值(n=3)
2.3.3 B1液及B2液方法适用性试验(薄膜过滤法)
试验组:取 1 ∶10(V/V)B1 液 1 mL,加入 100 mL含1%吐温80的pH7.0氯化钠蛋白胨缓冲液100 mL的过滤器中,滤过,用含1%吐温80的pH7.0氯化钠蛋白胨缓冲液900 mL冲洗,每次100 mL,最后1次冲洗液加入菌落数小于100 cfu的相应菌液,滤干后取滤膜菌面朝上贴于TSA平板上。菌液组:不加B1液,用pH7.0氯化钠蛋白胨缓冲液同法冲洗,其余同试验组。冲洗液对照组:不加B1液,用含1%吐温80的pH7.0氯化钠蛋白胨缓冲液同法冲洗,其余同试验组;供试品对照组:不加菌液,其余同试验组;同法操作1∶10(V/V)的 B2液。B1液中3种菌的回收比值大于B2液。结果见表2。
2.3.4 C1液及C2液方法适用性试验(平皿法)
试验组:取C1系列溶液各9.9 mL,加相应菌液0.1 mL,充分混匀,使小于100 cfu/mL,各取1 mL置含有1 moL/L硫酸镁溶液1 mL平皿中(倾注SDA不加中和剂硫酸镁溶液)。菌液组:不加供试液,不加中和剂,其余同试验组。供试品对照组:不加菌液,其余同试验组。中和剂对照组:同菌液组,置含有1 moL/L硫酸镁溶液1 mL平皿中。同法操作C2系列溶液。结果见表3。
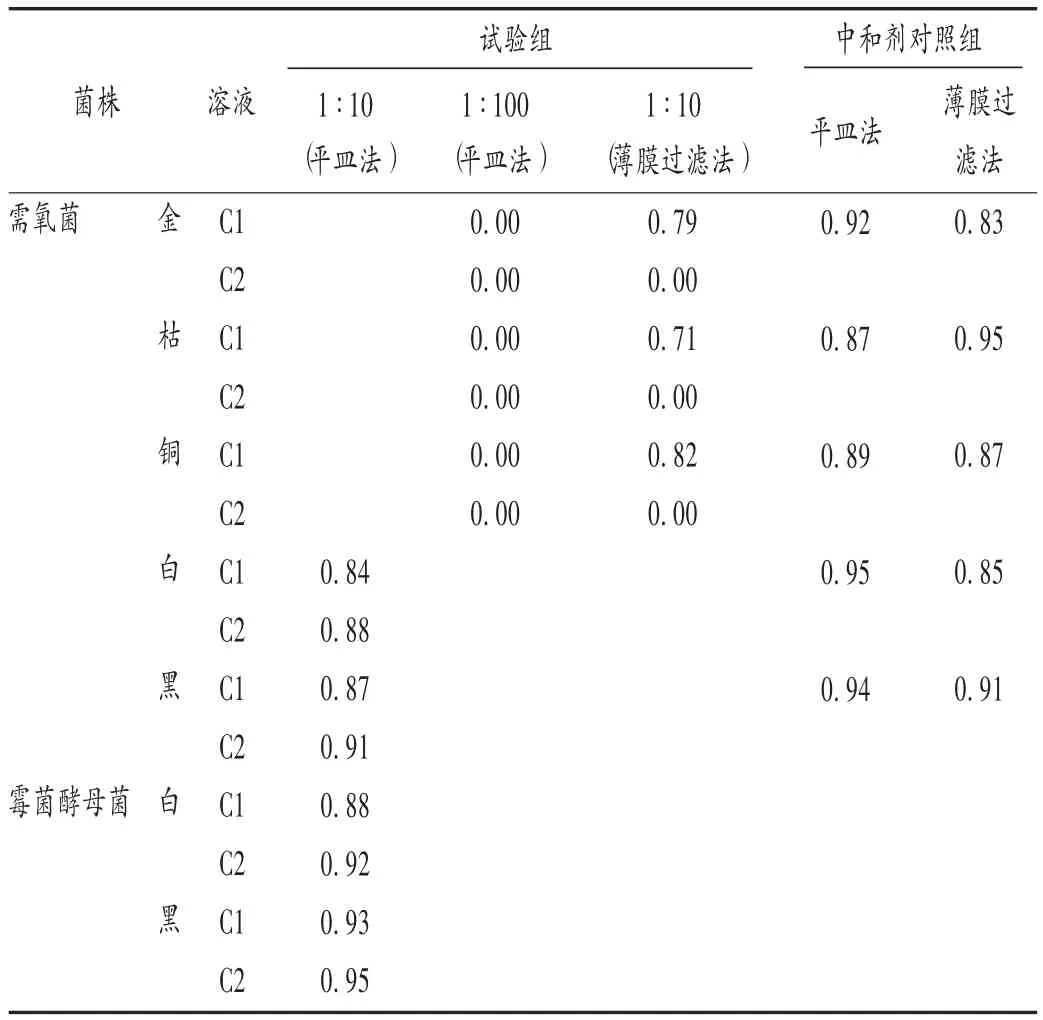
表3 C液回收比值(n=3)
2.3.5 C1液及C2液方法适用性试验(薄膜过滤法)
试验组:取 1∶10(V/V)C1 液 1 mL,加入 pH7.0 氯化钠蛋白胨缓冲液100 mL的滤器中,滤过,用pH7.0氯化钠蛋白胨缓冲液900 mL冲洗,每次100 mL,最后1次冲洗液加入菌落数小于100 cfu的菌悬液,滤干后取滤膜贴于含有1 moL/L硫酸镁溶液(中和液)1 mL的TSA预制平板上;同法操作C2系列液。菌液组:不加供试液,不加中和剂,其余同试验组。供试品对照组:不加菌液,其余同试验组。中和剂对照组:同菌液组操作,滤干后取滤膜贴于含有1 moL/L硫酸镁溶液1 mL的TSA预制平板上。平皿法金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌回收比值均为0,表明此3株菌为盐酸左氧氟沙星片的敏感菌株。薄膜过滤法C1液的回收比值大于C2液,中和剂对照组回收比值(该值=中和剂对照组平均菌落数/菌液组平均菌数)大于0.5,说明1 moL/L的硫酸镁溶液对微生物无毒性,不影响微生物的回收。结果见表3。
3 讨论
微生物试验结果易受试验条件的影响,特别是药品中含有对微生物生长有抑制作用的成分时影响更显著[4-5]。抗菌类药品抑菌性较强,同一样品同一稀释级均匀分散的供试液和供试液上清液敏感菌株的回收比值不同,抑菌性也不同,前者回收比值比后者低,表明前者抑菌性更强。平皿法中取均匀分散的供试液时所含药物固体颗粒及药物含量较上清液多,注皿时可见较多细小的药物固体颗粒;薄膜过滤法中取均匀分散的供试液时,相比于上清液有较多药物固体颗粒被截留在滤膜上,不溶性颗粒无法冲洗干净,抑菌性不易去除,造成回收比值较上清液低。供试液经自然静置后的沉降作用,上清液中药物含量明显低于均匀分散的供试液,导致了回收比值的差异。
本试验中选取3种抗菌药品进行方法适用性试验,取均匀分散的供试液进行需氧菌总数测定时,抑菌性并未去除,原本污染的微生物难以检出,导致假阴性结果,表明供试液的制备和取样直接影响试验结果的准确性[6]。
均匀分散的供试液和供试液上清液中非敏感菌株回收比值无明显差异,表明不同的供试液均不影响非敏感菌株微生物的回收。因此本试验中选取的1∶10(V/V)均匀分散的供试液或供试液上清液进行霉菌和酵母菌总数测定均可,均不影响检验结果的准确性和可靠性。
常用的抗菌药物有八大类,本试验中选取了硝咪唑类的甲硝唑片[7]、大环内酯类的红霉素肠溶片[8]和喹诺酮类的左氧氟沙星片[9]。2015年版《中国药典(四部)》规定,供试品有抗菌活性,应尽可能去除或中和,当回收比值大于0.5,方可消除供试品的抑菌活性,常联用增加稀释液、加入中和剂、采用薄膜过滤法等方法[10]。
文献报道的 β-内酰胺类的阿莫西林胶囊[11]、头孢类的盐酸头孢他美酯干混悬剂[12]、大环内酯类的抗生素微生物限度方法验证时均取其上清液进行验证试验[13],若取均匀分散的供试液,则不能有效检出供试品中污染的微生物,导致试验结果无法体现污染的真实情况。
综上所述,抗菌类药品均匀分散的供试液抑菌性强于供试液上清液。微生物限度检查时,应按适用性试验确定的方法制备供试液,以保证检验结果的准确性[14]。

