内侧隔核胆碱能神经元参与SNI 神经病理性疼痛大鼠模式分离障碍*
江颖颖 郑 杰 伊 鸣,4,△
(1首都医科大学 北京市神经外科研究所,北京100070;2北京大学神经科学研究所;3北京大学基础医学院神经生物学系;4 教育部/国家卫生健康委员会神经科学重点实验室,北京100191)
根据最新的疼痛定义,疼痛是由实际或潜在的组织损伤所引起的感觉和经历,包括感觉、情绪、认知及社会成分[1]。根据这一定义可知疼痛与认知是紧密相关的。疼痛会导致认知受损,而增加非疼痛相关的认知活动会减轻疼痛[2]。目前临床上提出了一些非药物治疗慢性痛的策略,如认知行为疗法、音乐疗法等,这些疗法大多数是非创伤性的,成本和风险低[3]。目前临床上有超过69%的慢性痛病人接受过非药物治疗,对改善患者生活质量有较好效果[4]。因此研究疼痛与认知的关系对研究疼痛机制及治疗措施具有很重要的临床意义。
为了识别外部环境的细微变化,大脑必须区分类似的神经元活动模式,而这是通过“模式分离(pattern separation)”来实现的。模式分离是指将神经回路类似的输入活动模式转换成更明显的输出模式。模式分离在空间记忆活动中起着非常重要的作用[5]。已有行为学证据表明,海马齿状回被认为是“模式分离器(pattern separator)”[6,7],在模式分离中扮演非常重要的角色。
此外,已有研究表明SNI 神经病理性疼痛会导致海马双侧齿状回(dentate gyrus, DG)的新生神经元数目明显减少[8]。因此我们推测SNI 神经病理性疼痛会导致大鼠模式分离障碍,而这种障碍与海马齿状回密切相关。
另一方面,病毒逆行示踪实验表明,海马齿状回内新生神经元不仅接受来自海马内部神经元(中间神经元,苔藓细胞以及成熟颗粒细胞)投射,而且接受内侧隔核胆碱能神经元投射[9],并且齿状回内神经元新生受到内侧隔核内的胆碱能神经元调节。此外,已有文献表明,当用192 IgG-saporin (SAP)损毁内侧隔核胆碱能神经元后,齿状回内的新生神经元数目明显减少[10]。因此我们提出假设,SNI 神经病理性疼痛导致的空间认知能力障碍与内侧隔核内的胆碱能神经元密切相关。
本研究旨在解决SNI 神经病理性疼痛导致的模式识别障碍与内侧隔核中胆碱能神经元的关系,研究内侧隔核内的胆碱能神经元是为了进一步探讨模式识别的调控机制,为临床治疗治疗疼痛提供新的靶点。
方 法
1.实验动物
成年雄性Sprague-Dawley (SD)大鼠,体重为200 ~240 g,由北京大学医学部实验动物科学部提供。12 h 昼夜节律交替,其中8:00 ~20:00 为黑暗环境。每笼2 ~4 只大鼠,除了限制饮食时间段外,其余时间大鼠自由饮食、饮水。所有的实验程序都遵循国际疼痛学会的研究和伦理问题的指导方针[11],经北京大学医学部动物保护与使用委员会批准。在进行实验前,大鼠由实验操作者多次抚摸(handling)。所有的行为学实验均为双盲。
2.实验方法
(1)部分神经损伤模型(spared nerve injury,SNI)的建立:用1%戊巴比妥钠(瑞尔欣德科技有限公司,中国北京)麻醉大鼠,对其左后腿进行备皮消毒,沿垂直于左后腿方向剪开皮肤,之后用镊子钝性分离肌肉组织,找到坐骨神经三根分支,结扎剪断其中较粗的胫神经和腓总神经,保留细长的腓肠神经,并且在结扎线远心端剪去约2 mm 的神经,以防止剪断的神经重新愈合。之后缝合肌肉及皮肤,用碘酒和酒精消毒伤口以防感染。对照组(sham SNI)组大鼠,除了不剪断神经外,其余操作同SNI[12]。
(2)机械缩足阈值测定:大鼠SNI 神经病理性疼痛的测定如参考文献[13]所述,简单来说,在测试前三天,将大鼠放入测试板适应。正式进行测试时,待大鼠处于安静状态,用不同克数的von Frey hair(0.41、0.70、1.20、2.00、3.63、5.50、8.50 和15.10 g)(Stoelting, Wood Dale, IL, 美国)刺激大鼠左后足底外侧皮毛交界处。将纤维丝弯曲成S 行,观察大鼠是否出现包括抬足、舔足、甩足等缩足反应。本研究采用的是“up and down”方法进行,具体过程参见文献[13]。
(3)八臂迷宫实验:在为期一周的实验中,所有实验大鼠均限制饮食,自由饮水。将大鼠体重保持在实验开始前体重的80%~90%,此举是为了保证大鼠对八臂迷宫中的食物有探索欲望。大鼠全程自由饮水。在实验开始前,将大鼠放入迷宫中适应半个小时,八臂迷宫所有臂的入口处的门均打开,并且在每个臂的末端都放奶酪小球。八臂迷宫周围用布帘围起来,并且布帘上放不同形状的图案,作为大鼠识别方向的标识。
大鼠进行为期7 天、每天随机四次的测试。每次测试分为两步,首先只开放一个固定的臂(见图1A,B),然后将大鼠放入起始臂,待大鼠进入固定臂,并吃掉奶酪球后,将大鼠取出,用75%医用酒精消毒迷宫,排除气味干扰。这次测试的时间上限为2 min,如果大鼠在2 min 内未进入固定臂,则将大鼠指引进入固定臂,并吃掉奶酪球。第二步为随机开放另一个臂,并在末端放奶酪球,此时迷宫除了起始臂和固定臂(此时未放奶酪球)开放外,多了一个随机开放的臂,将大鼠再次放入起始臂,记录大鼠第一次选择进入的臂。如果选择随机开放的臂则为正确,若进入固定臂或者回到起始臂均为错误。如果选择错误,则允许大鼠在迷宫中自由探索2 min。根据随机臂开放的方向,将模式分离(pattern separation)分为S1、S2、S3、S4 四种模式(见图1A)。统计两组大鼠每天的正确率,正确率为正确次数/总次数[14,15]。
(4)内侧隔核胆碱能神经元损毁:首先使用1%戊巴比妥钠麻醉大鼠,注射剂量为0.55 ml/100 g。将大鼠头部备皮消毒,沿正中线剪开皮肤,暴露颅骨,以前囟为原点,前囟前(anterior-posterior, AP) 0.6 mm,向左旁开(medial-lateral, ML) 0 mm,用颅钻钻开颅骨直至硬脑膜出现,然后轻挑硬脑膜,暴露脑表面,此过程防止出血及碰触脑组织。将装有0.5 μl 浓度为 0.35 μg/μl 的 192 IgG-saporin (SAP)(Advanced Targeting Systems, 美国)或者生理盐水的微量注射器以上述坐标进入脑组织[16],向下深度为6.8 mm。然后以0.1 μl/min 速度,持续5 min 微量注射药物,待药物注射完后,留针5 min,防止药物随针道扩散。最后缝合皮肤,全程无菌操作[17]。
(5)免疫组织化学:用1%戊巴比妥钠麻醉大鼠,待大鼠深度麻醉后,剪开腹部组织,暴露心脏,将针头经心室心房进入主动脉,剪开心耳。首先灌注约400 ml 生理盐水,以最大速度冲干净动脉内的血液。之后换上300 ml 左右4%多聚甲醛(paraformaldehyde, PFA) 固定组织。前 1/3 的 PFA快速进入动物体内,后2/3 的PFA 降慢速度,以便PFA 渗透进入脑组织。灌流完毕,取脑组织并放入PFA 中于4 ℃冰箱中后固定12 h。之后依次换上20%、30%蔗糖溶液对脑组织进行脱水。脱水过后用包埋剂(Leica,德国)将脑组织包埋,并放入-80℃冰箱中迅速冷冻组织。之后在冰冻切片机进行冠状面切片,厚度为30 μm,将内侧隔核脑片保存在防冻液中。
将脑片放入磷酸盐缓冲液(phosphate-buffered saline, PBS)中漂洗3 × 5 min 后,放入3%双氧水中,室温孵育1 h 以灭活脑组织本身的过氧化物酶,此过程注意避光。然后用PBS 漂洗3×5 min,将脑片放入10%羊血清中,室温封闭打孔1 h。用胆碱能神经元标志物:乙酰胆碱转移酶(choline acetyltransferase, ChAT) 抗体在4℃冰箱孵育脑片24~36 h,ChAT抗体(AB18736,Abcam,英国)的浓度为1:200。之后用PBS 漂洗3×5 min,之后孵育二抗(中杉金桥二步法免疫组化检测液),室温孵育1 ~1.5 h;PBS 漂洗3×5 min 后,用3-二氨基联苯胺(diaminobezidin, DAB)染色液(A 液:B 液=1:20)(北京中杉金桥公司)室温孵育脑片约5 min,根据脑片着色深浅做出适当调整,然后裱片,将贴有脑片的载玻片放于37 ℃烤箱中烤2 ~3 d,之后进行梯度酒精脱水,封片,放于显微镜(Leica 倒置荧光显微镜,DMI 4000B)明场模式下观察或拍照[18,19]。用image J 软件计数两组大鼠内侧隔核内的胆碱能神经元数目,即ChAT 阳性神经元数目,然后进行统计分析。
3.实验动物分组与统计学分析
实验大鼠分为四组:sham SNI、SNI、假损毁、SAP 损毁,每组7 ~8 只。为保证实验准确性,数据分析者不清楚实验分组,使用GraphPad Prism 5.0软件并采用双因素方差分析(two-way ANOVA)和非配对t检验(un-pairedttest)进行数据统计。数据以均数±标准误(±SEM)表示,P<0.05 认为差异有统计学意义。
结 果
1.SNI 神经病理性疼痛大鼠模式分离能力降低
根据已有文献,SNI 导致的神经病理性疼痛在术后24 h 开始出现,并持续至少6 个月。本实验中,在SNI 造模7 d 后进行模式分离实验。结果发现SNI 组大鼠在四种模式中的正确率均比对照组低(S1: group effect:F(1,6)= 9.26,P<0.05, time effect:F(6,6)= 2.99,P> 0.05, 见图 1C; S2: group effect:F(1,6)=280,P<0.001, time effect :F(6,6)= 25.50,P<0.001,见 图 1D; S3: group effect:F(1,6)= 33.60,P<0.01; time effect:F(6,6)= 0.56,P> 0.05, 见图 1E; S4: group effect:F(1,6)= 30.50,P<0.01, time effect:F(6,6)= 0.12,P> 0.05, 见图1F; two-way ANOVA with Bonferroni' s post-test)。
此外本研究综合分析了大鼠在低分辨模式(S2)和高分辨(S3、S4)模式中的正确率,发现不管是在低分辨模式(S2)中,还是在高分辨模式(S3、S4)中,SNI 组大鼠的正确率明显比对照组低(见图2A: group effect:F(1,24)= 60.60,P<0.001; interaction:F(1,24)= 0.01,P> 0.05. 见图 2B: group effect:F(1,24)= 56.99,P<0.001;interaction:F(1,24)= 0.37,P> 0.05, ANOVA with Bonferroni's post-test)。
2.SNI 神经病理性疼痛导致内侧隔核胆碱能神经元数目减少
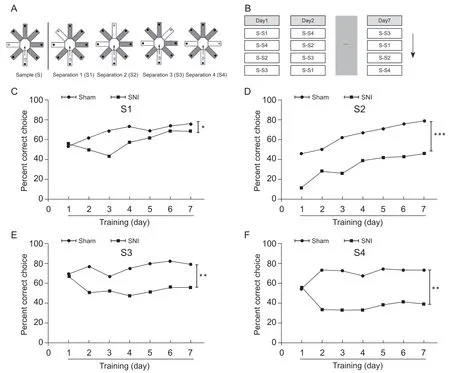
图1 SNI神经病理性疼痛导致大鼠模式分离能力降低(±SEM)Fig.1 Decreased pattern separation in neuropathic pain rats with SNI(±SEM)

图2 SNI 和sham SNI 组大鼠在低分辨模式(S2)和高分辨模式(S3、S4)中的正确率(±SEM)Fig.2 Percent of correct choice in neuropathic pain rats in low discrimination (S2) and high discrimination (S3, S4) model in SNI and sham SNI groups (±SEM)
由于海马齿状回在模式识别中扮演非常重要的角色[6,7],而海马齿状回接受来自内侧隔核胆碱能神经元投射和调控[9],因此推测内侧隔核胆碱能神经元参与SNI 导致的模式识别,接下来检测了SNI 或sham 术后28 d,内侧隔核胆碱能神经元数目的变化(见图3)。首先对比了SNI 和sham组大鼠的机械痛阈值,SNI 组大鼠机械痛阈值明显低 于 sham 组(time effect:F(5,80)=36.56,P<0.001;group effect:F(1,80)= 1375,P<0.001; interaction:F(5,80)= 35.95,P<0.001, two-way ANOVA with Bonferroni' s post-test,见图3A),表明模型成功建立。在SNI 或sham 术后28 d 将大鼠灌流取材,对内侧隔核胆碱能神经元进行DAB 染色,对比两组大鼠内侧隔核内的胆碱能神经元数目(见图3C,D),结果发现SNI 导致内侧隔核内的胆碱能神经元数目明显减少(t= 4.43,P< 0.001, unpaired t test,见图3B)。这一结果表明,内侧隔核胆碱能神经元参与SNI 慢性神经病理性疼痛。
3.内侧隔核胆碱能神经元损毁明显降低大鼠空间认知能力
为了证明内侧隔核胆碱能神经元是否参与模式识别,首先,使用SAP 特异损毁大鼠内侧隔核胆碱能神经元,然后采用模式分离中的S4 模式检测损毁组与对照组的正确率。因为SNI 会导致模式识别(PS)受损,如果在损毁MS 胆碱能神经元后进行SNI 手术再检测PS,最后出现的PS 受损没办法分清是MS 胆碱能神经元受损还是SNI 导致的。所以我们选择MS 胆碱能神经元损毁后在正常大鼠中进行PS 实验。结果发现,损毁组大鼠在S4 中的正确率明显低于对照组(time effect:F(6,72)= 20.20,P<0.001; group effect:F(1,72)= 7.80,P<0.05; interaction:F(6,72)= 0.51,P> 0.05, two-way ANOVA with Bonferroni' s post-test,见图4A)。实验结束后,将大鼠灌流取材,使用DAB 染色检测内侧隔核内的胆碱能神经元,以此确定损毁是否成功。结果发现损毁组大鼠内侧隔核内胆碱能神经元数目明显少于对照组(见图4B,C),说明损毁成功。这些结果说明内侧隔核胆碱能神经元参与了模式分离。
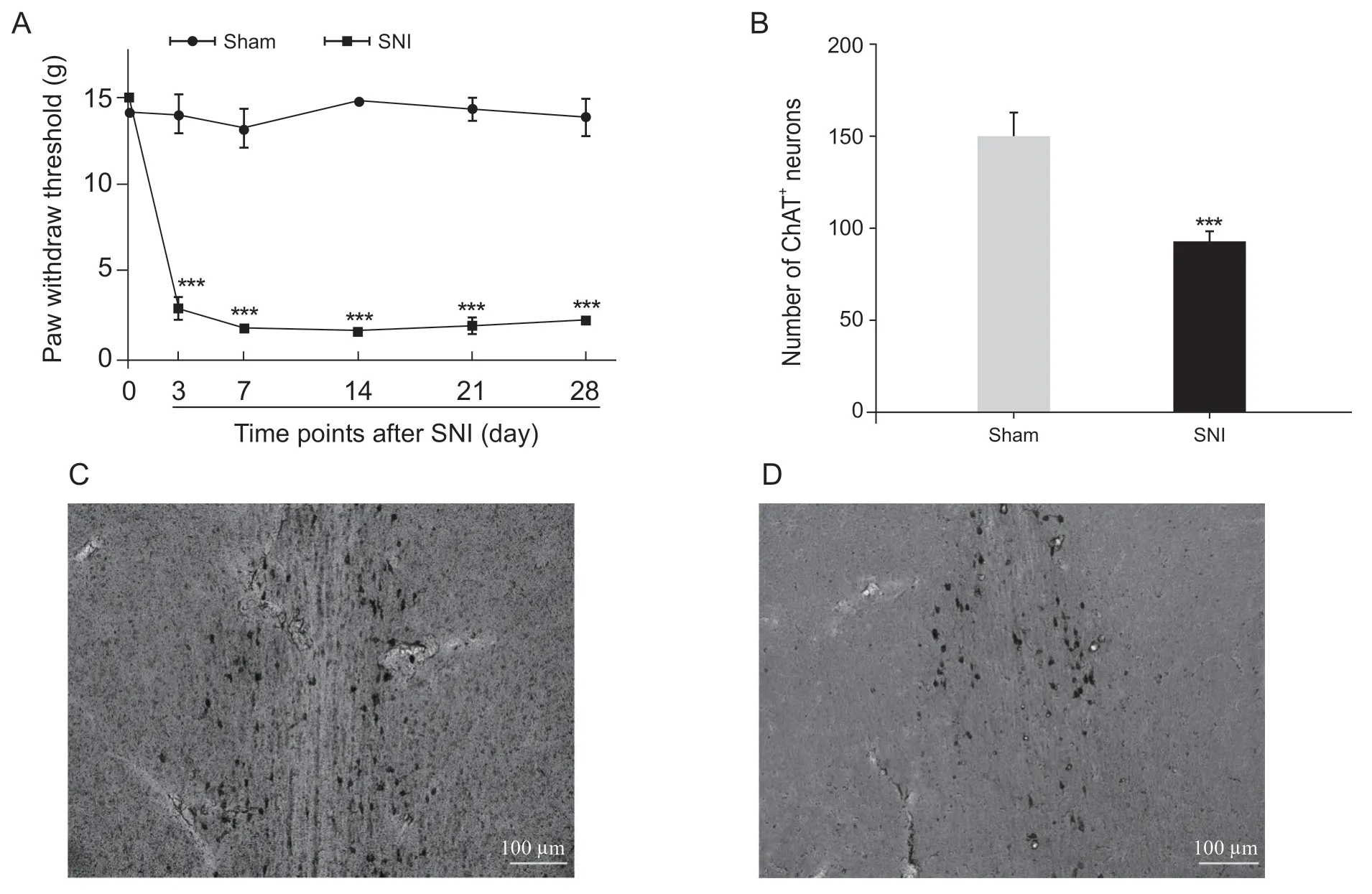
图3 SNI神经病理性疼痛导致内侧隔核胆碱能神经元数目减少(±SEM)Fig.3 SNI-induced neuropathic pain reduced the number of cholinergic neurons in medial septum (±SEM)
讨 论
在处理记忆信息时,海马中有若干种不同的计算过程,其中一种是模式分离,海马会用不同的神经活动编码相似的信息,让相似的信息变得更加不同,并且在不干扰其他记忆表现的情况下准确形成新的空间记忆[20]。海马齿状回(dentate gyrus, DG)的神经元新生对模式分离非常关键[21]。已有研究表明在成年大鼠中存在神经元新生的只有两个脑区:DG 和室管膜下区(subventricular zone)[22]。关于DG最重要的理论是其参与模式分离。减少DG 内的神经元新生会损害动物在模式分离中的表现,而增加DG 神经元新生明显提高模式分离的正确率[5~7]。
疼痛包含感觉、情绪、认知和社会成分。神经病理性疼痛会导致大脑很多结构发生改变,包括丘脑、杏仁核、前扣带回皮质、岛叶、前额叶皮质海马等结构[23]。目前已有研究表明慢性神经病理性疼痛会导致海马功能异常,包括海马体积减小、长时程增强缺失、DG 神经元新生降低、细胞凋亡增加等[8]。因此认为SNI 神经病理性疼痛会导致模式分离障碍。我们的结果证实了这一点:在四种模式分离中神经病理性疼痛大鼠正确率均明显低于对照组大鼠。
DG 新生神经元除了接受来自海马内神经元的投射(中间神经元、苔藓细胞、CA3 以及成熟颗粒细胞)外,还接受来自内侧隔核(medial septum,MS)的胆碱能神经元投射[9]。并且有研究表明用192 IgG-saporin 特异损毁MS 内的胆碱能神经元会明显减少DG 神经元新生[10]。因此我们推测SNI 神经病理性疼痛导致模式分离障碍与MS 内的胆碱能神经元有关。我们的结果也证明了损毁MS 胆碱能神经元明显降低大鼠在模式分离中的正确率。
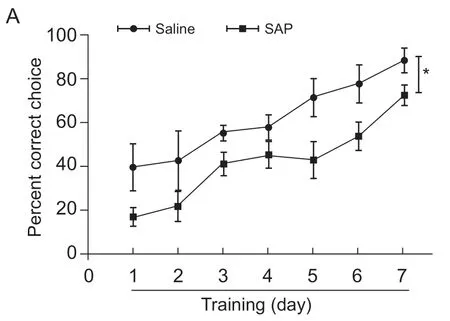

图4 损毁内侧隔核胆碱能神经元降低神经病理性疼痛大鼠的模式分离能力 (±SEM)Fig.4 Cholinergic neurons lesion in medial septum decreased the pattern separation in neuropathic pain rats (±SEM)
本实验首先证明了SNI 导致大鼠模式识别受损,同时表明SNI 会降低内侧隔核内的胆碱能神经元数目,此外损毁内侧隔核胆碱能神经元能明显降低大鼠模式识别。综上所述,SNI 神经病理性疼痛导致大鼠模式分离正确率明显降低,并且这种表现的降低可能与内侧隔核内的胆碱能神经元相关。
本实验存在一定局限性,由于影响模式分离的脑区以及神经元类型很多,为了证实内侧隔核胆碱能神经元与SNI 神经病理性疼痛导致的模式分离障碍有关,需要进一步采用更精确的实验方法,比如化学遗传、光遗传以及在体多通道记录等手段。此外为了更加明确因果关系,可以在持续增加内侧隔核胆碱能神经元活性的基础上进行SNI 造模,看能否逆转SNI 导致的模式识别正确率降低,这需要进一步证明。

