连续胸椎旁神经阻滞对乳腺癌术后疼痛综合征的影响*
靳红绪 张同军 孙学飞 张 华 王福朝 吕东海 姚长青 王忠义
(河北省衡水市哈励逊国际和平医院麻醉科,衡水053000)
乳腺癌术后疼痛综合征(post-mastectomy pain syndrome, PMPS)是发生于乳腺癌术后的一种慢性神经病理性疼痛,指继发于手术急性疼痛之后,在胸部、腋窝、上臂及肩部出现的慢性疼痛,并且超过3 个月以上[1,2]。PMPS 是乳腺癌根治术后的主要并发症之一,其发病率高达20%~52%[3~5],PMPS 可持续数年,严重影响了病人术后的生活质量,增加了病人的经济负担并带来一系列严重的社会问题[6]。有研究认为有效地治疗乳腺癌术后急性疼痛可以很大程度上预防PMPS 的发生[7]。近年来,随着超声引导技术在区域麻醉中的逐步普及,胸椎旁神经阻滞(thoracic paravertebral block, TPVB)逐渐应用于乳腺癌根治术中及术后镇痛中。本研究通过将超声引导下连续胸椎旁神经阻滞应用于乳腺癌切除术病人围术期镇痛,评价其对术后PMPS 的影响,旨在为预防乳腺癌切除术病人PMPS和术后疼痛治疗提供新的思路和方法。
方 法
1.一般资料
本研究方案经哈励逊国际和平医院医学伦理委员会批准,所有病人均签署知情同意书。选择2015年1 月至2017 年3 月,在本院拟行单侧乳腺癌根治术的女性病人206 例,年龄32 ~76 岁,体质量指数 (BMI) 17.3 ~34.5 kg/m2, ASA 分级Ⅰ或Ⅱ级。采用计算机随机数字表法,将其随机分为两组:连续胸椎旁神经阻滞联合全麻组(PG 组)和单纯全麻组 (GA 组)。8 例因术后失联未能完成随访而被剔除,完成全部受试及随访共198 例,PC 组102例,PA 组 96 例。
排除标准:慢性疼痛病史及长期服用镇痛药物者;穿刺部位存在感染;严重脊柱畸形或有开胸手术史者;酰胺类局麻药过敏史;心、脑、肝、肾等重要脏器功能不全;凝血功能障碍;精神和神经系统疾患;术后发生感染及二次手术者。
2.方法
所有病人常规禁饮禁食,无术前用药。入室后开放外周静脉通路,常规监测心率 (HR)、脉搏血氧饱和度 (SpO2)、心电图 (ECG)、呼气末二氧化碳 (PETCO2)和脑电双频谱指数 (BIS)。GA 组行常规全麻诱导:依次静脉注射咪达唑仑0.03 mg/kg,芬太尼3 μg/kg,丙泊酚1.5 mg/kg 及顺式阿曲库铵0.15 mg/kg。喉罩置入成功后连接麻醉机行机械控制通气。PG 组首先在超声(Terason 3000 +二维超声显像仪,25 mm 高频线阵探头,频率6 ~13 MHz)引导下行术侧肋间入路T3椎旁神经阻滞并置管。取侧卧位,患侧在上,触摸确定骨性标志并标记拟穿刺节段上下的棘突,定位T3椎间隙,常规消毒铺巾,将探头在T3水平旁矢状切面沿肋间上下移动探头扫查,将探头放置在两根肋骨之间,避开肋骨在超声下可见横突、肋横突韧带和胸膜,横突和其外侧与胸膜围成的空间即为胸椎旁间隙。采用18 G Touchy 穿刺针在探头外侧进针,进针过程保持穿刺针在超声影像中全程可见,针尖抵达肋横突韧带,尝试推注2 ml 生理盐水,确认针尖所在位置,缓慢进针突破肋横突韧带,回抽无血和脑脊液后注射0.5%的盐酸罗哌卡因20 ml,可见壁层胸膜因药物注入向下受压,椎旁间隙扩张,即可确认针尖到达理想部位。注药完毕后退出针芯向胸椎旁间隙置入导管约3 cm,皮下隧道妥善固定导管。测定阻滞平面(以痛觉或温度觉减退范围不小于T2-T5为阻滞成功),阻滞失败的剔除实验组。起效15 min 后开始全麻诱导,方法同GA 组。麻醉维持两组均以1%丙泊酚静脉靶控输注(效应室浓度2 ~3 μg/ml),间断静注芬太尼,术中维持BIS 值在45 ~60 之间。若切皮后HR、MAP 明显升高,每次追加芬太尼0.15 μg /kg,维持病人HR、MAP 波动范围在基础值的±20%内,必要时酌情给予去甲肾上腺素或乌拉地尔。缝皮时停止输注丙泊酚,病人苏醒后拔出喉罩送麻醉恢复室 (PACU) 继续观察。
GA 组采用病人自控静脉镇痛 (patient controlled intravenous analgesia, PCIA):舒芬太尼 2 μg/kg +地佐辛0.3 mg/kg +阿扎司琼30 mg +生理盐水至250 ml,背景输注剂量 5.0 ml/h,PCA 剂量 3.0 ml,锁定时间15 min。PG 组病人采用连续胸椎旁神经自控镇痛 (patient controlled thoracic paravertebral analgesia,PCPA):0.2%罗哌卡因250 ml,背景剂量5.0 ml/h,PCA 3.0 ml,锁定时间15 min。术后疼痛管理的目标是确保病人术后 NRS<4 分,当 NRS ≥ 4 分时则给予地佐辛5 mg 静脉注射进行补救镇痛。
3.观察指标
记录术中芬太尼和丙泊酚的用量、术后48 h 镇痛泵有效按压次数、补救镇痛例数、镇痛满意率情况(若病人术后NRS<3 分认为术后镇痛满意)。记录术后嗜睡、恶心呕吐 (PONV) 和尿潴留等不良反应发生情况。随访并复查术后3、6、12 个月时病人PMPS 的发生情况。PMPS 的诊断可参照文献[8]及国际疼痛学会的标准,从疼痛部位、疼痛性质和疼痛时间三个方面评估:疼痛部位多位于术侧腋窝、上肢及肩部受损神经所支配的区域,主要为前胸,其次是腋窝、手臂;疼痛性质多为麻木、电击痛、烧灼痛、针刺痛,并可出现与幻肢痛类似的乳房幻觉痛;疼痛可在术后即刻出现,一般长达2个月以上,多呈间歇性发作。使用NPS 量表[9]进行神经病理性疼痛的筛查,包含相关症状、疼痛特征、痛觉过敏及蚁走感4 个方面共10 个问题,每个问题记1 分,总分4 分以上即可诊断为PMPS。
4.统计学分析
采用SPSS 22.0 统计学软件进行处理。正态分布的计量资料采用均数±标准差±SD)表示,组间比较采用独立样本t检验,偏态分布可采用Mann-Whitney U 检验;计数资料组间比较采用X2检验。P<0.05 为差异有统计学意义。
结 果
1.两组病人一般情况和围术期资料的比较
本研究起始共纳入206 例乳腺癌病人,8 例因术后失联未能完成随访而被剔除。完成全部受试及随 访 的 198 例 病 人,PG 组 102 例,GA 组 96 例。两组病人年龄、BMI、ASA 分级、手术时间、术中失血量等一般情况差异均无统计学意义(P>0.05)。PG 组术中丙泊酚用量和芬太尼用量明显少于GA组(P<0.05,见表 1)。
表1 两组病人一般情况和围术期资料的比较±SD)Table1 Comparison of general information and perioperative data between groups ±SD)
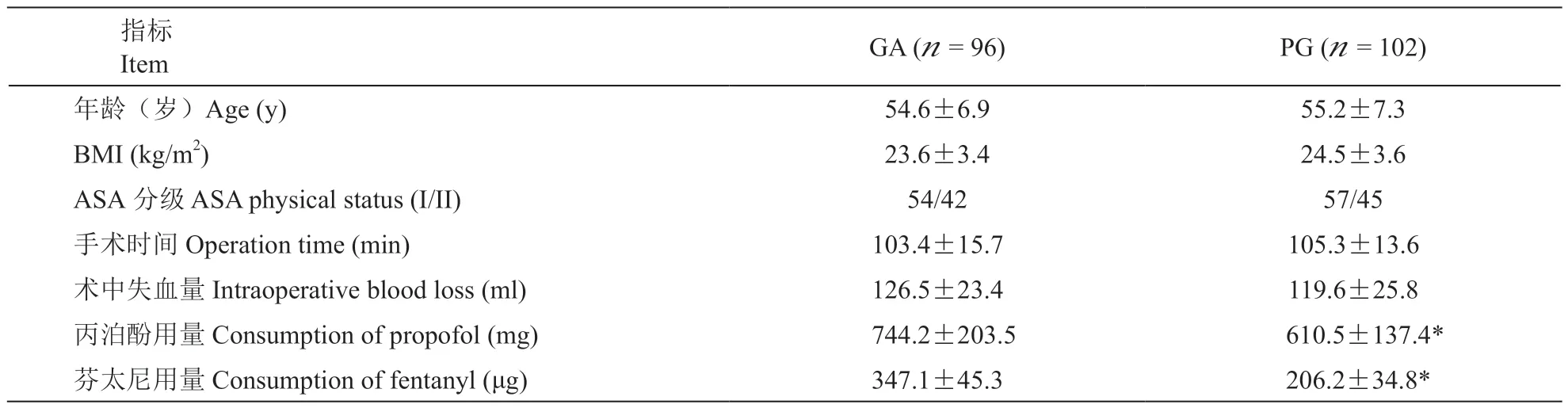
表1 两组病人一般情况和围术期资料的比较±SD)Table1 Comparison of general information and perioperative data between groups ±SD)
*P < 0.05,与 GA 组比较;*P < 0.05, compared with group GA.
GA (n = 96) PG (n = 102)年龄(岁)Age (y) 54.6±6.9 55.2±7.3 BMI (kg/m2) 23.6±3.4 24.5±3.6 ASA 分级 ASA physical status (I/II) 54/42 57/45手术时间 Operation time (min) 103.4±15.7 105.3±13.6术中失血量 Intraoperative blood loss (ml) 126.5±23.4 119.6±25.8丙泊酚用量 Consumption of propofol (mg) 744.2±203.5 610.5±137.4*芬太尼用量 Consumption of fentanyl (μg) 347.1±45.3 206.2±34.8*指标Item
2.两组病人术后镇痛情况的比较
PG 组术后48 h 内镇痛泵有效按压次数、补救镇痛例数均显著少于GA 组,术后镇痛满意率显著高于GA 组(P<0.05,见表2)。PG 组病人术后嗜睡、PONV及尿潴留等不良反应的发生率分别为0(0 例)、2.9%(3 例)和 0(0 例),明显低于 GA 组的13.5%(13 例)、27.1%(26 例)、和10.4%(10 例)(P<0.05)。
表2 两组病人术后镇痛情况的比较±SD)Table2 Comparison of postoperative analgesia between groups (±SD)

表2 两组病人术后镇痛情况的比较±SD)Table2 Comparison of postoperative analgesia between groups (±SD)
*P<0.05,与 GA 组比较;*P<0.05, compared with group GA.
镇痛满意率(%)Satisfaction rate of analgesia GA 96 14.6±5.6 9 (9.4) 78.5 PG 102 2.5±1.2 * 2 (2.0) * 95.1*组别Group例数Cases有效按压次数(次)Effective compression times (time)补救镇痛例数 [n (%)]Remedy for analgesia
3.两组病人术后PMPS 发生情况的比较
PG 组病人术后3、6、12 个月PMPS 的发病率明显低于 GA 组(P<0.05,见表3)。

表 3 两组病人术后PMPS 发生情况的比较[n (%)]Table 3 Comparison of postoperative incidence of PMPS between groups [n (%)]
讨 论
乳腺癌术后病人常常经历中度以上的急性疼痛,这是由于手术操作导致乳腺周围组织和胸壁神经损伤,痛觉信号经传导通路到达相应的脑皮质区域产生痛觉。乳腺癌术后的急性疼痛若控制不佳,可引起外周伤害性感受器持续受到刺激,促使损伤组织产生炎性介质和致痛因子,形成外周敏化,继而使脊髓背角神经元发生可塑性改变,产生中枢敏化和PMPS 的发生[10]。PMPS 的病因和机制尚不完全明确,影响因素很多,涉及围术期的各个阶段,目前主要观点是乳房切除术后对肋间神经的损伤引起的肋间神经痛,同时手术类型,尤其是全腋窝淋巴结清扫、放疗、化疗、年龄、术后急性疼痛的管理等均是引起PMPS 的重要危险因素[11]。其中,术后急性疼痛的严重程度是导致术后疼痛慢性化重要风险因素,因此,通过直接降低风险因素或间接控制敏感因素来阻止术后急性疼痛向PMPS 转化,从而降低PMPS 的发病率,改善病人预后。
PMPS 属于慢性神经病理性疼痛,而慢性疼痛的发生发展与急性期疼痛的管理有关,最常见的慢性疼痛是由急性术后疼痛管理不当引起的。Borghi等[12]研究发现,围手术期积极有效地控制疼痛可以显著降低PMPS 的发病率。近年来,以区域神经阻滞为代表的多模式镇痛技术受到了临床的广泛推崇,并成为多模式镇痛的重要手段。超声引导下TPVB 通过局麻药直接作用于肋间神经、脊神经后支、脊膜返支和胸交感神经链,阻滞该侧的运动、感觉和交感神经,单点阻滞局麻药可上下扩散产生4 ~5 个节段的感觉阻滞,且对血流动力学影响轻微[13]。Karmakar 等[14]将TPVB 应用于乳腺癌根治病人的术中镇痛,发现其只是减低了慢性疼痛的疼痛强度,并没有降低术后慢性疼痛的发生率。本研究结果与其不尽相同,可能与本研究选取的局麻药剂量和浓度不同,穿刺针的入路等有所不同,造成的肋间神经阻的范围不同。此外,选择的PMPS 评估标准不同,也会造成预测和诊断PMPS 的效度和灵敏度不同。本研究采用超声可视下将穿刺针尖准确引导至胸椎旁间隙并置入导管,使镇痛贯穿整个术中和术后,术中芬太尼的使用量大为减少,术后镇痛泵按压次数和术后补救镇痛的需求例数明显少于对照组,镇痛满意率较对照组亦明显升高。本研究使用NPS 量表进行术后神经病理性疼痛的筛查,病人术后3、6、12 个月时PMPS 的发生率较对照组显著降低。本研究提示超声引导下TPVB 对乳腺癌手术病人的术后急性疼痛和乳腺癌术后疼痛综合征均具有较好的临床效果。
PMPS 发生的确切机制仍未完全清楚,现有研究认为与手术部位神经损伤、神经可塑性改变、持续炎症反应以及下行传导通路的改变有关[1]。手术创伤导致炎症反应,交感神经末梢释放大量炎症介质,神经元内神经递质及离子通道和受体表达水平发生改变,进一步增加伤害性感受神经元对传入信号的敏感性,产生外周敏化,放大传入的疼痛信号。随着疼痛信号在脊髓表达的增强,通过影响抑制性中间神经元的功能甚至促进抑制性神经元凋亡,使得抑制性神经元功能缺失,导致中枢敏化。本研究采用胸椎旁神经阻滞降低乳腺癌病人PMPS 的发生率,其机制可能与预先镇痛可以有效减轻外周神经感受器的伤害性刺激,阻断信号传导通路及炎性反应,从而避免外周和中枢敏化的产生,抑制神经元可塑性变化[15]。
综上所述,超声引导下连续胸椎旁神经阻滞镇痛用于乳腺癌根治术病人效果确切,不良反应发生少,可有效减少乳腺癌根治术病人PMPS 的发生率,其发生机制还有待进一步研究和探索。

