硫辛酸对炎性痛小鼠脊髓背角c-Fos 和Iba-1 的影响*
许祥影 沈晶晶 朱 贺 刘 倩 陶怡嘉 逯 晨△
(1徐州医科大学 江苏省麻醉学重点实验室,徐州221004;2徐州医科大学附属医院麻醉科,徐州221004)
硫辛酸(α-lipoic acid, ALA)化学名称为1,2-二硫戊环-3-戊酸,分子式为C8H14O2S2。在1950年由Reed 等美国学者合成[1]。硫辛酸属于维生素B类化合物,二硫键的存在使其容易反应生成还原型产物二氢硫辛酸(ihydmlipoic acid, DHLA),因而具有较强的抗氧化作用。硫辛酸既可以在水溶性环境,也在脂溶性环境中发挥抗氧化功能,有学者甚至将其誉为“万能抗氧化剂”[2]。硫辛酸作为一个强抗氧化剂已广泛应用于糖尿病及糖尿病慢性并发症的预防和治疗[3],研究表明硫辛酸对糖尿病性神经病性神经病理性疼痛有明显作用,近年来研究表明硫辛酸与神经系统炎症反应密切相关,如阿尔茨海默病等[4],具有抗炎和神经保护作用。
此外最新研究表明其对临床常见的坐骨神经痛[5]、偏头痛[6]以及女性盆腔痛[7]和产后疼痛[8]等也有一定的改善作用,目前硫辛酸已经列入治疗疼痛可能的替代药物,但目前其缓解疼痛的具体机制尚未完全明确。
慢性炎性痛是临床上最常见的病理性疼痛之一,小胶质细胞是介导中枢神经系统炎症的关键。慢性炎性痛条件下,脊髓背角小胶质细胞明显活化、数量增加,通过分泌细胞因子及炎性介质使脊髓背角神经元兴奋性增加,促进中枢敏化的维持[9]。c-Fos 蛋白是由即刻早期基因c-fos 的编码产物,常被作为反应神经元兴奋性的良好指标。炎性痛条件下脊髓背角浅层神经元c-Fos 蛋白表达增加,神经元的兴奋性明显增强[10]。
研究表明硫辛酸能明显降低内毒素脂多糖(lipopolysaccharide, LPS)诱导的 NF-κB 的活性,影响小胶质细胞的活化[11],硫辛酸作为重要的抗炎抗氧化剂以及神经保护作用,推测其可以逆转慢性炎性痛的病理生理过程,通过影响小胶质细胞活化,降低脊髓背角中枢炎症反应,降低慢性炎性痛脊髓背角神经元的异常兴奋,从而对炎性痛具有明显的抑制作用。基于此,通过在小鼠足底注射完全弗氏佐剂(complete Freund's adjuvant, CFA)模拟慢性炎性痛,首先观察硫辛酸对慢性炎性痛小鼠痛行为的影响,继而从小胶质细胞的形态及数量变化观察硫辛酸对小胶质细胞活化的影响,并检测脊髓背角神经元兴奋性从而探讨硫辛酸对慢性炎性痛的作用及可能的机制,从而为临床上应用硫辛酸治疗或缓解慢性炎性痛提供理论依据。
方 法
1.实验动物与分组
SPF 级雄性昆明小鼠,18 ~20 g,由徐州医科大学实验动物中心提供。动物置于室温和12 h/12 h明暗交替的安静环境中,自由进食进水,所有动物遵守《实验动物使用规范》。采用随机数字表法,将40 只小鼠随机分成4 组(n= 10):对照组(Control 组)、炎性痛组(CFA 组:足底注射30 μl完全弗氏佐剂)、硫辛酸组[ALA 组:腹腔注射ALA 100 mg/kg (Sigma, USA)]和炎性痛+硫辛酸组(CFA + ALA 组:足底注射30 μl 完全弗氏佐剂3 d后腹腔注射ALA 100 mg/kg)。术后3 d,分别于ALA 注射后 0、10、30、60、90、120 min (T0-T6)检测热缩足潜伏期(PWL)。T4 时间点行免疫组织化学法检测脊髓背角Iba-1 和c-Fos 表达。
2.炎性痛模型的建立
用微量注射器将30 μl 完全弗氏佐剂(Sigma,USA)注入小鼠左侧后肢足底中心皮下,从而建立炎性痛模型[12,13]。
3.给药、小鼠右后足趾肿胀程度及行为学测定
造模后第3 天,在给予硫辛酸100 mg·kg-1后120 min 后使用游标卡尺测量各组右侧后爪跖底的厚度。
造模后第3 天,各组小鼠测量热缩足反射潜伏期 PWL 后,分别在给予硫辛酸 100 mg·kg-1后 0、10、30、60、90、120 min 进行 PWL 的检测。
将小鼠放到有机玻璃箱(7 cm×9 cm×11 cm)置于3 mm 厚的玻璃板上适应2 h,用热辐射刺激仪照射小鼠足底固定部位,照射开始至小鼠出现抬腿回避时间为PWL。热刺激强度调整为基础值12 ~15 s,在整个实验过程中维持一致,自动切断时间为20 s,以免造成热辐射损伤。为避免或减少前一次刺激对随后刺激效应造成的影响,同一部位刺激的间隔时间为3 min,连续测定5 次,去掉最大值和最小值,取3 次平均值进行计算。
4.样本制备
戊巴比妥钠(40 mg·kg-1)腹腔注射将小鼠麻醉后,经升主动脉用生理盐水快速灌注冲洗血液直至液体清亮,然后用4%多聚甲醛的0.1 mol.L-1磷酸缓冲液 (PB, PH7.4)先快后慢进行滴注30 min。灌注完取脊髓腰膨大,放入上述固定液内4℃后固定6 h,然后移入30%蔗糖溶液直到组织沉底。然后对脊髓腰膨大做冰冻切片,片厚30 μm。
5.免疫组织化学染色
切片经 0.01 M PBS 漂洗,5 分钟 /次 × 3 次,随后滴入3%H2O2溶液,室温下孵育10 min,以清除内源性过氧化物酶;PBS 漂洗,5 分钟/次 × 3 次,加入含1%BSA 和0.3%的Trixton X-100 封闭液室温下封闭1 h,加入兔源c-Fos 一抗(1:200, Santa Cruz);加入羊源Iba-1 一抗(1:200, Abcam) 4℃孵育24 h。PBS 漂洗,5 分钟/次 × 3 次,分别加入生物素标记的二抗(1:200, Vector)室温孵育30 min;PBS 漂洗,5 分钟/次×3 次,然后加入ABC 复合物中室温孵育30 min,PBS 漂洗,5 分钟/次×3 次,DAB 显色后用PBS 漂洗终止反应。将切片贴于防脱玻片室温风干,梯度酒精脱水,二甲苯透明,中性树胶封片。
6.摄片及计数
使用光学显微镜(Leica, Germany)进行摄片。所得图像使用Image- Pro Plus 6.0 软件进行脊髓背角c-Fos 和Iba-1 阳性细胞的定量分析,每组6 只动物进行比较,其中每只小鼠随机选取L4-6三张切片,计数脊髓背角浅层Iba-1 和c-Fos 的表达,取平均值。
7.统计学分析
采用SPSS 16.0 软件对实验数据进行统计学分析,计量资料使用均数±标准差(±SD)表示。组间比较采用单因素方差分析,组间两两比较采用q检验,P<0.05 为差异有统计学意义。
结 果
1.硫辛酸对炎性痛小鼠痛行为的影响
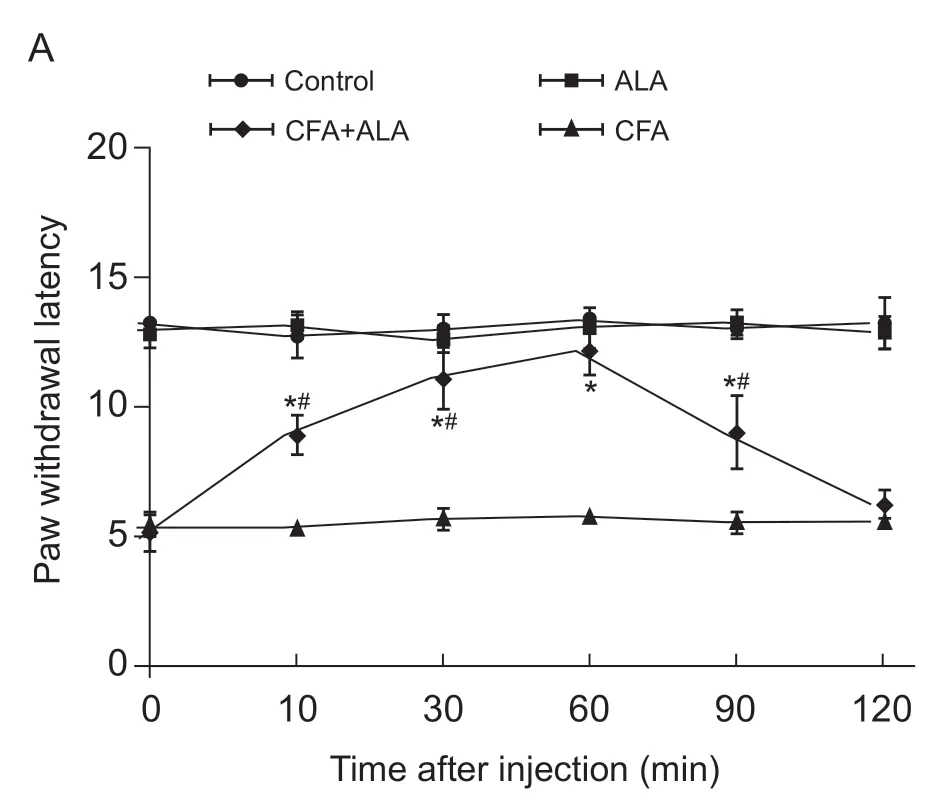
图1 腹腔注射硫辛酸对炎性痛小鼠热缩足潜伏期的影响(±SD)Fig.1 Effects of ALA on PWT in mice with inflammatory pain (±SD)
Control 组小鼠痛阈(12.98±0.50 s)一直保持在基础痛阈水平。CFA 组小鼠足底注射CFA 后第3 天,痛阈较Control 组相比明显降低,维持在(5.10±0.88 s),差距具有统计学意义 (P< 0.05)。CFA + ALA 组小鼠腹腔注射ALA 可以明显逆转炎性痛的痛阈降低(P< 0.05)。给予ALA 后,约10 min 开始起效 (P<0.05),30 min 痛阈继续上升,60 min 痛阈达到最高,和Control 组无明显差异,随后痛阈逐渐下降,药效持续约120 min,而正常组小鼠腹腔注射ALA 后前后痛阈无明显差异(见图1)。以上表明腹腔注射ALA 可以明显提高炎性痛小鼠的疼痛阈值。
2.硫辛酸对炎性痛小鼠足趾肿胀程度的影响
CFA 造模3 天后,CFA 组小鼠右后足均明显红肿,测量右后足足趾厚度和Control 组相比明显变厚,差距具有统计学意义(P<0.05)。在ALA 注射120 min 后,与CFA 组相比CFA + ALA 组足趾肿胀程度显著降低,足趾厚度明显减小,具有统计学意义(P<0.05,见图2),表明ALA 可以有效减轻CFA 诱导的炎性反应引起的足趾肿胀。
3.硫辛酸对炎性痛小鼠脊髓背角Iba-1 表达的影响
Control 组小鼠脊髓背角小胶质细胞数量较少,形态为树枝状,胞体较小,有多根细长的突起 (见图3A,B);CFA 炎性痛小鼠脊髓背角小胶质细胞数量明显增多(P<0.05),转化为“活化态”,胞体变大变圆,去分支化分支变短变少呈阿米巴样(见图 3C);腹腔注射ALA 后(见图3D),可以明显逆转炎性痛小鼠脊髓背角小胶质细胞的数量增多和形态学变化(P<0.05),胞体呈小分支细长状。腹腔注射ALA 后,小胶质细胞活化数量明显减少44.1%(P<0.05,见图3E),胞体区域面积平均比CFA组减小了 54% (P<0.05,见图 3F)。而 ALA组脊髓背角小胶质细胞数量和形态均无明显差异。腹腔注射ALA 可明显降低CFA 诱导的炎性痛小鼠脊髓背角小胶质细胞活性,表现为数量和形态的改变。
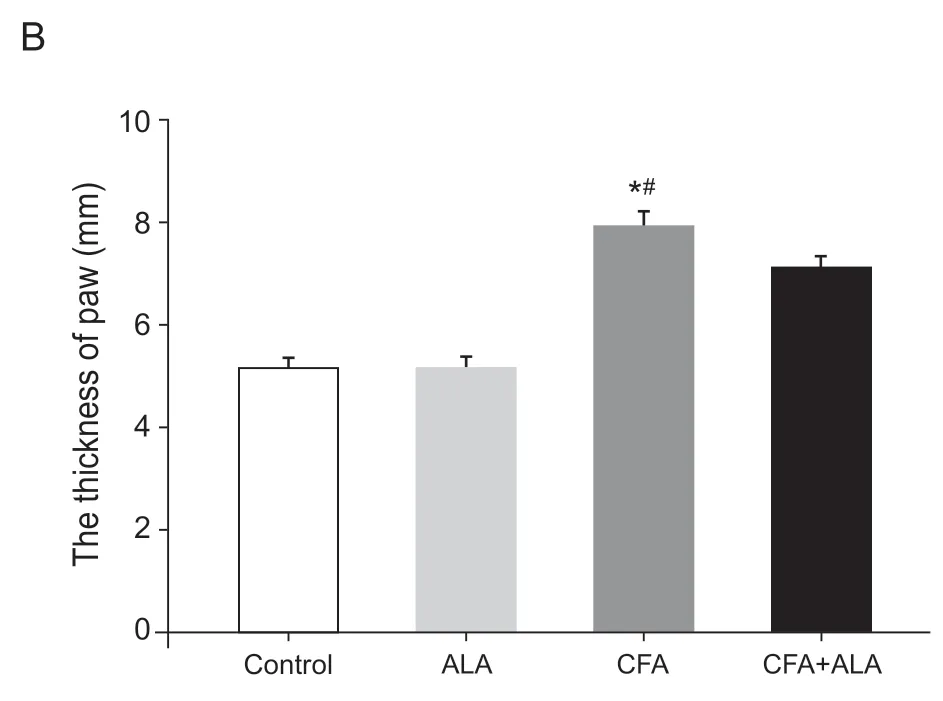
图2 腹腔注射硫辛酸120min对炎性痛小鼠足趾厚度的影响(±SD)Fig.2 Effects of ALA on the thickness of paw in mice with inflammatory pain (±SD)
4.硫辛酸对炎性痛小鼠脊髓背角c-Fos 蛋白表达的影响
Control 组脊髓背角c-Fos 蛋白表达量很少(见图4A),CFA 组c-Fos 蛋白表达量明显增多,呈强阳性分布在脊髓背角浅层(见图 4C),CFA + ALA组小鼠腹腔注射硫辛酸后60 min脊髓背角浅层c-Fos蛋白量明显减少(见图4D),差异有统计学意义(P< 0.05),而ALA 组脊髓背角c-Fos 蛋白表达量无明显变化(见图 4B)。因此,腹腔注射ALA 抑制了炎性痛小鼠脊髓背角神经元的活性。
讨 论
硫辛酸因其具有非常强的抗氧化性及神经保护作用,被广泛用于治疗糖尿病神经病变等神经系统疾病。慢性炎性痛时外周炎症部位受化学性刺激,以及局部产生的组胺、5-羟色胺等使伤害性感受器持续性激活,导致脊髓背角神经元持续兴奋。脊髓背角小胶质细胞介导的中枢炎症反应加重了脊髓背角神经元的异常兴奋,促进了慢性炎性痛的产生和维持。所以,阻断或干预慢性炎性痛的病理过程对缓解疼痛的产生和维持至关重要。
小鼠足底注射CFA 后,局部肿胀明显,热缩足潜伏期明显降低,且持续约两周时间,常被用来模拟慢性炎性痛。在给予硫辛酸后,可以明显逆转小鼠注射CFA 后的炎性痛反应,热缩足潜伏期明显延长, 改善小鼠足趾肿胀程度。硫辛酸可能通过降低外周炎症部位的氧自由基,清除局部的氧化代谢产物,降低外周伤害性感受器的持续性激活,从而抑制慢性炎性痛的发生发展。除此之外,硫辛酸对脊髓背角神经元的兴奋性及中枢炎症反应有无改善呢?为了验证这个假设,我们对炎性痛小鼠脊髓背角中神经元活性标志物小胶质细胞c-Fos 蛋白[10]以及Iba-1[9]的表达进行了检测。
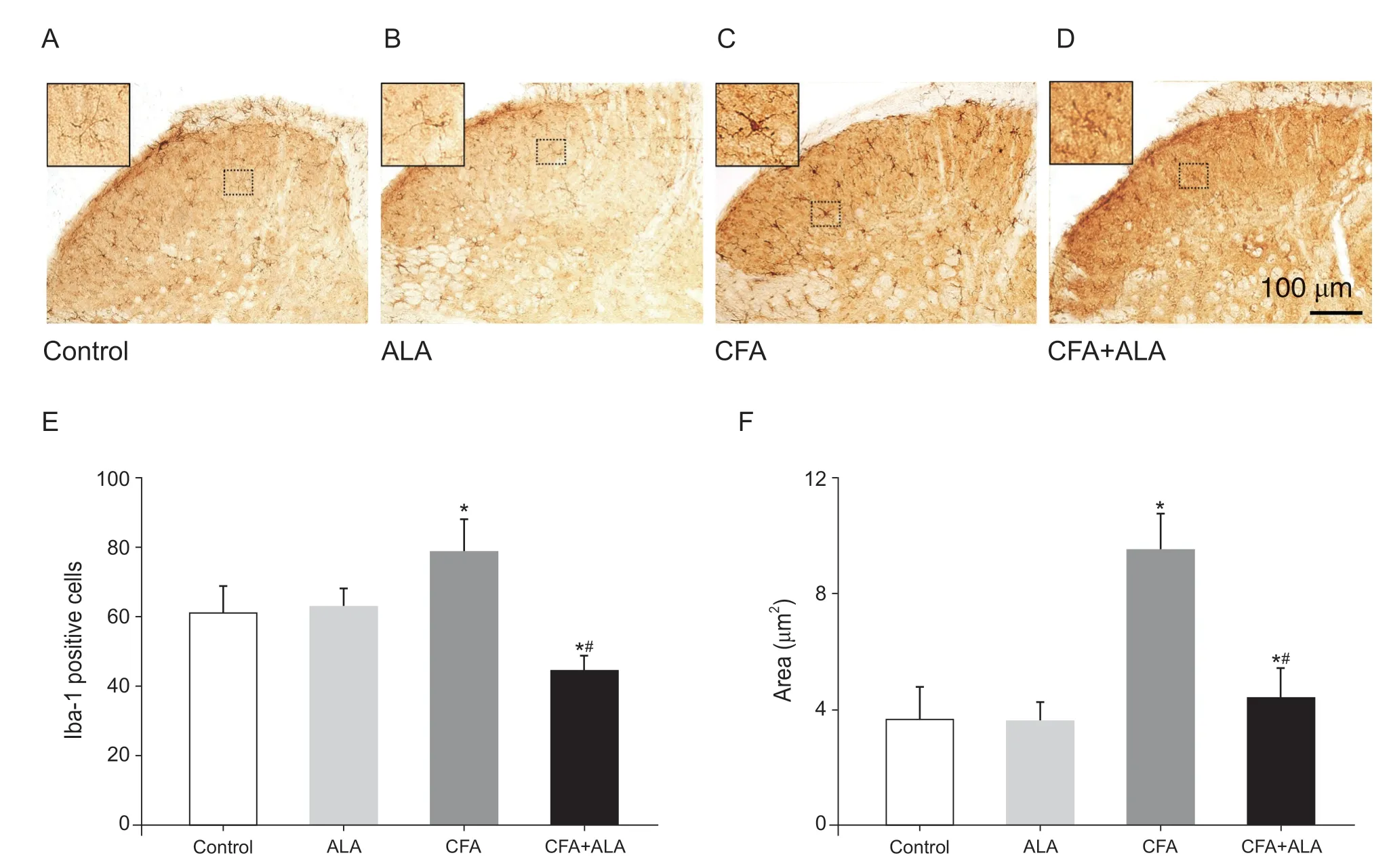
图3 腹腔注射硫辛酸对炎性痛小鼠脊髓背角Iba-1 表达的影响(图片取自L5 节段)Scale bar = 100 μm;左上角小图为大图虚线框的放大部分Fig.3 Changes of Iba-1 in dorsal horn of spinal cord after injecting ALA in mice with inflammatory pain (picture taken from L5 segment) Scale bar = 100 μm
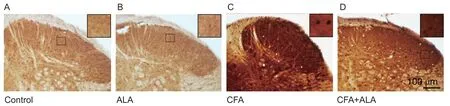
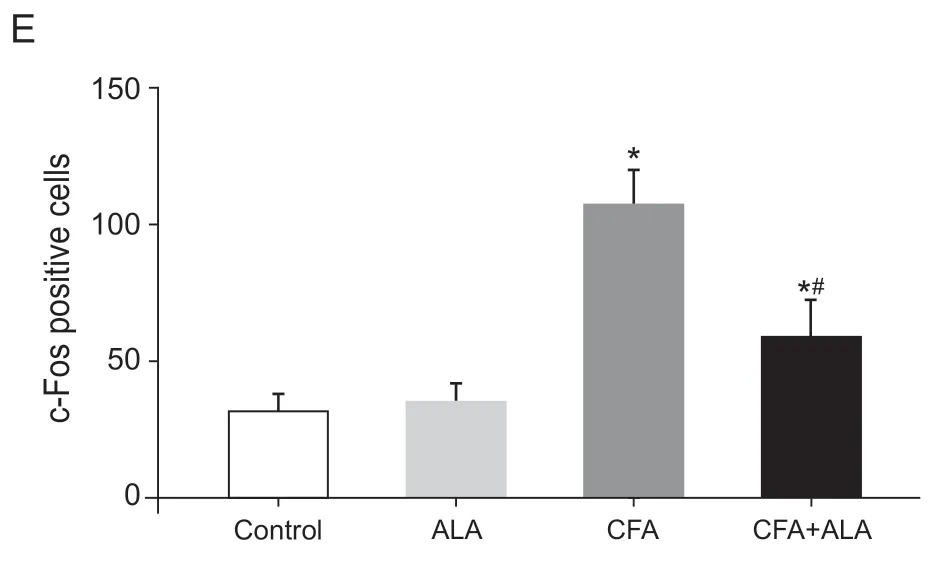
图4 腹腔注射硫辛酸对炎性痛小鼠脊髓背角c-Fos 蛋白表达的影响 (图片取自L5 节段) Scale bar = 100 μm;右上角小图为大图虚线框的放大部分Fig.4 Changes of c-Fos expression levels in dorsal horn of spinal cord neurons after injecting LA in mice with inflammatory pain (picture taken from L5 segment)Scale bar = 100 μm
慢性炎性痛小鼠给予硫辛酸后,可以明显降低小鼠脊髓背角c-Fos 蛋白的表达,从而缓解脊髓背角神经元的异常兴奋。1965 年Melzack 和Wall 等人提出的闸门控制学说指出,脊髓背角的神经元兴奋性是疼痛发生发展的重要环节之一。外周炎症刺激导致脊髓背角神经元活化,从而进一步通过脊髓丘脑束等活化高位中枢,如丘脑腹后核、大脑感觉皮层等。硫辛酸抑制脊髓背角神经元的异常兴奋,可能是其发挥抑制慢性炎性痛的机制之一。
除此之外,中枢神经系统小胶质细胞激活,从而介导的炎症反应,是慢性炎性痛发展及维持的重要原因。慢性炎性痛条件下,脊髓背角小胶质细胞数量增加[9,15],以及形态由静息状态的分支状变成活化状态的“阿米巴”样,表现为胞体面积的增加[14],是反应小胶质细胞活化的重要指标。抑制小胶质细胞的活化可以缓解慢性疼痛的产生和维持[15]。慢性炎性痛小鼠在给予硫辛酸后可以抑制脊髓背角小胶质细胞的数量增加以及形态学变化,提示硫辛酸可以抑制脊髓背角的中枢炎症反应从而发挥镇痛作用。
综上所述,硫辛酸对慢性炎性痛具有明显的镇痛作用,一方面可能通过降低外周炎症局部的炎性反应,另一方面可能通过降低脊髓背角神经元的兴奋性以及脊髓背角中枢炎症反应从而发挥镇痛效应。硫辛酸抑制慢性炎性痛脊髓背角神经元的兴奋性可能是直接效应,也可能是同时通过抑制小胶质细胞活化,降低中枢炎症反应,从而间接抑制脊髓背角神经元的兴奋性。使用硫辛酸治疗慢性炎性痛,尚未发现阿片类药物的成瘾性、依赖性,也没发现有其他镇痛药物严重的不良反应,从而为临床上治疗慢性炎性痛的治疗提供新的方法与思路提供理论依据。

