异源表达板栗坚果淀粉合成酶基因对水稻籽粒淀粉合成的影响
王玉龙,张 卿,赵永廉,刘建玲,秦 岭,曹庆芹,邢 宇*
(1a.北京农学院植物科学技术学院/北京林果业生态环境功能提升协同创新中心/农业应用新技术北京重点实验室,1b. 北京农学院生物与资源环境学院/农业农村部华北都市农业重点实验室,北京 102206;2.北京市怀柔区板栗试验站,北京101405)
板栗(CastaneamollissimaBlume)是壳斗科(Fagaceae)栗属(Castanea)植物,分布于中国26个省(市、区),适应性强,是重要的生态经济兼用树种[1]。作为以坚果为主要经济来源的物种,坚果的产量及品质成为种质资源评价的重要指标。而淀粉是板栗坚果的主要成分,是影响坚果口感和加工品质的主要因素之一。淀粉在板栗坚果干物质中含量较大,占干重46%~64%[2]。其中直链淀粉和支链淀粉的比例对板栗加工的口感有较大的影响。抗性淀粉(Resistant Starch, RS)是种新型的膳食纤维,它指的是“在健康者小肠中不被吸收的淀粉及淀粉的降解物”[3]。板栗中的抗性淀粉含量较高,可以达到68.93%,吃板栗可以调养人体健康状况[4]。
淀粉合成是一个复杂的生化过程,其主要以光合作用所产生的蔗糖为碳源,经水解后以1-磷酸葡萄糖(G1P)的形式进入造粉体中[5]。在直链淀粉合成酶的催化下,G1P单体的葡糖基通过α1-4糖苷键连接至直链淀粉非还原性末端,支链淀粉的合成是在淀粉分支酶催化下通过α1-6糖苷键将葡糖基连接至分支点处。这其中还有淀粉脱支酶,异淀粉酶,磷酸化酶等的参与。淀粉的生物合成是多种酶共同作用的结果。
虽然淀粉在生物体中合成的机理目前已经有比较深入的研究,但是板栗淀粉合成酶基因的功能目前还没有得到验证。由于板栗属于木本植物,生长周期长,不易获得转基因植株;另外,板栗胚性愈伤组织诱导困难、数量少、周期长,限制栗属植物重要基因功能的验证[6]。本试验将水稻作为转基因材料的受体,通过将板栗可溶性淀粉合成酶(soluble starch synthase, SSS)、淀粉分支酶(starch branching enzyme, SBE)和淀粉去分支酶(pullulanase, PUL)的编码基因在水稻中过量表达,测定其对水稻籽粒淀粉含量的影响,以期为板栗淀粉合成酶基因功能的验证提供试验参考。
1 材料与方法
1.1 植物材料
过表达中国板栗SSSII、SSSIII、SSSIV、SBEI、SBEII和PUL基因的转基因水稻‘日本晴(Oryzasativa, Nipponbare)’种子,发芽后40 d水稻叶片,用于DNA检测和RNA表达量的检测,成熟水稻种子,用于淀粉含量测定。
水稻种植地点为海南陵水四川农业大学水稻南繁育种基地。其中过表达载体为PBW(1300改进)载体,转化菌种为EHA105根癌农杆菌。
1.2 试验方法
1.2.1 侵染转化 利用农杆菌介导法将植物过表达载体PBW转化到水稻成熟胚愈伤组织获得转基因水稻幼苗,经卡那抗性筛选和PCR扩增检测获得转基因阳性苗,并收获F1代种子[7]。
1.2.2 试验样品及处理 分别取转基因株系F1代种子以及转空载体对照株系种子做催芽处理,每个株系取催芽萌发的幼苗200株种植田间。取发芽后40 d的叶片2~3片作为转基因植株鉴定的材料,采集后迅速置于干冰冻存,置于-80 ℃冰箱保存。水稻成熟后,收割成熟期水稻种子,晒干后保存备用。
干种子样品制备:剥去种子颖壳,磨粉后过0.45 mm筛子,45 ℃烘干备用[8]。每个样本3次重复。
1.2.3 转基因植株检测 剪取1 cm左右的水稻叶片,快速提取基因组DNA[9],进行PCR鉴定。其中PCR引物设计使用DNAMAN软件,上游引物为插入基因序列,下游引物为载体序列,引物信息如表1所示;扩增体系为:95 ℃预变性5 min,95 ℃变性1 min,退火30 s,72 ℃延伸30 s,25个循环。扩增产物用2%琼脂糖凝胶电泳检测。
1.2.4 转基因植株叶片RNA提取及荧光定量PCR检测 叶片总RNA提取使用Plant RNA Kit(OMEGA),DNA消化使用RapidOut DNA Removal Kit(Thermo Scientific),cDNA的合成使用Reverse transcriptase M-MLV (RNase H)(Takara)。实时荧光定量PCR引物的设计利用Primer Premier 5软件,内参基因选用水稻18S rRNA基因[10],引物如表2所示。实时荧光定量PCR使用罗氏Light Cycler96 Real Time PCR系统。
实时荧光定量PCR采用10 μL反应体系,其中SYBR©Premix Ex Taq (Takara)5 μL, ddH2O 2.5 μL,稀释60倍cDNA 2 μL,上游、下游引物各0.25 μL。反应程序:第一步预变性:95 ℃ 10 min;第二步扩增:95 ℃ 20 s,退火20 s,72 ℃ 20 s,39个循环;第三步溶解:95 ℃ 10 s,65 ℃ 30 s,97 ℃ 1 s。每个反应3次重复。

表1 PCR引物列表Tab.1 PCR Primer

表2 实时荧光定量PCR引物列表Tab.2 Real-time Quantitative PCR primer
1.2.5 水稻种子淀粉含量测定
经荧光定量PCR检测得到的转基因阳性植株,分别检测阳性植株籽粒的直链淀粉、支链淀粉、总淀粉和抗性淀粉的含量,并与转空载体对照株系进行比较。直链淀粉和支链淀粉含量测定采用Megazyme Amylose/Amylopectin kit检测试剂盒[11],总淀粉含量测定采用Megazyme total starch kit检测试剂盒[12],抗性淀粉含量测定采用Megazyme Resistant starch kit检测试剂盒[13],每个转基因株系测定3株,每个样品测量3次,取平均值。
1.3 数据分析
采用Microsoft Excel绘制图表,计算平均数;利用SPSS20.0软件进行方差分析和显著性分析。
2 结果与分析
2.1 转基因水稻株系筛选
PCR扩增检测F2代水稻叶片外源基因,检测结果见图1。CmSSSII、CmSSSIV、CmSBEI和CmPUL转基因水稻株系均扩增出相应片段大小的条带,且检测到3个以上阳性植株,表明这些植株均携带外源基因。而CmSSSIII和CmSBEII转基因水稻株系未扩增出目的条带,表明植株为非阳性植株,未携带外源基因。
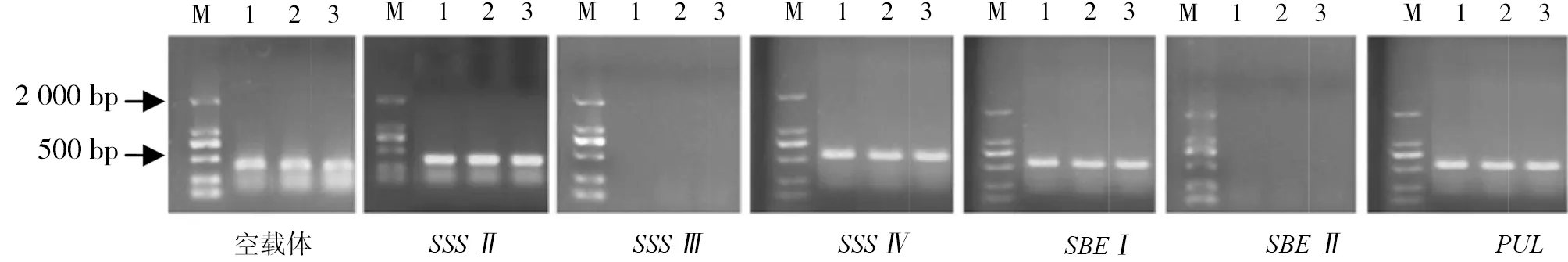
注:M表示Marker,1-3表示样本。Note:M is Marks , 1-3 means every sample.图1 转基因水稻叶片的PCR检测Fig.1 PCR detection of transgenic rice leaves
2.2 转基因水稻中外源基因的表达量分析
为了检测外源基因在转基因水稻中的表达情况,采用实时荧光定量PCR技术,对阳性转基因水稻叶片进行检测。外源基因CmSSSII、CmSSSIV、CmSBEI和CmPUL对应转基因水稻植株叶片的表达量显著高于转空载体水稻叶片的表达量。同时,外源基因在转空载体水稻叶片中均有少量的表达(图2),可能是由于水稻基因组中含有与板栗同源性较高的基因序列。
2.3 转基因水稻植株的株型分析
在F2代转基因水稻发芽后60 d(图3),统计水稻植株的株高、穗长、剑叶长、剑叶宽、分蘖数和籽粒千粒重(表3)。与转空载体对照株系相比,CmSSSII转基因株系分蘖数显著升高、籽粒千粒重显著降低,CmSSSIV转基因株系分蘖数显著升高,CmSBEI转基因株系籽粒千粒重显著降低,CmPUL转基因株系的株型没有显著变化。
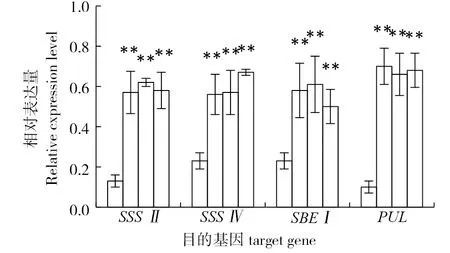
注:每组柱形图分别为转空载体和三个转基因样本;**表示与转空载体对比差异极显著(P<0.01)。Note:Each group of column means the trans empty vector and three transgenic samples ; ** indicates a highly significant level of variation compared to the trans empty vector transgenic rice line (P<0.01).图2 目的基因在转基因水稻植株中的相对表达量Fig.2 Relative expression level of target genes in transgenic rice samples

图3 转基因水稻的株型Fig.3 Plant shape of transgenic rice
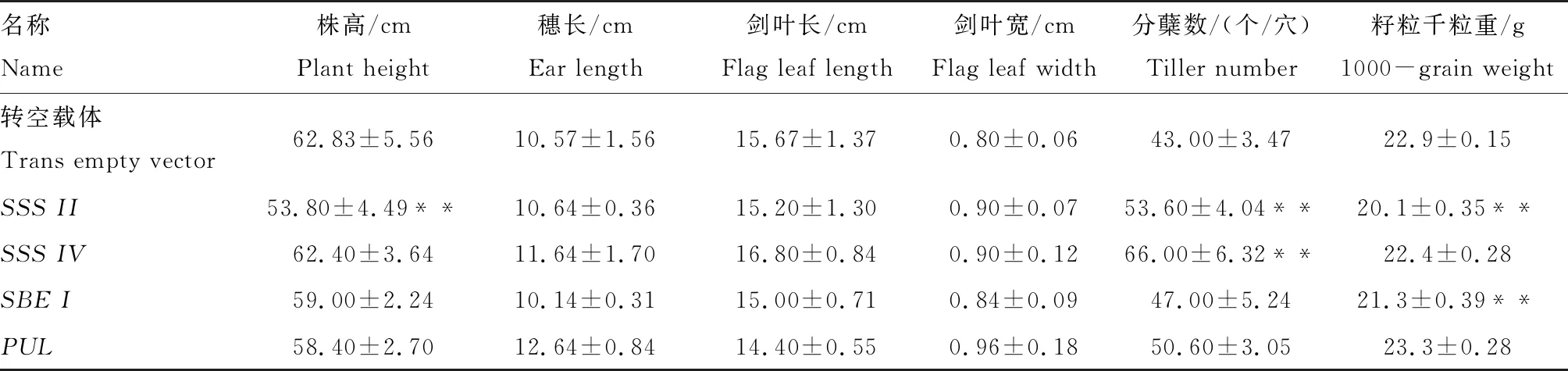
名称Name株高/cmPlant height穗长/cmEar length剑叶长/cmFlag leaf length剑叶宽/cmFlag leaf width分蘖数/(个/穴)Tiller number籽粒千粒重/g1000-grain weight转空载体Trans empty vector 62.83±5.5610.57±1.5615.67±1.370.80±0.0643.00±3.4722.9±0.15SSS II53.80±4.49**10.64±0.3615.20±1.300.90±0.0753.60±4.04**20.1±0.35**SSS IV62.40±3.6411.64±1.7016.80±0.840.90±0.1266.00±6.32**22.4±0.28SBE I59.00±2.2410.14±0.3115.00±0.710.84±0.0947.00±5.2421.3±0.39**PUL58.40±2.7012.64±0.8414.40±0.550.96±0.1850.60±3.0523.3±0.28
注:**表示转空载体相比差异极显著(P<0.01)。
Note:** indicates a highly significant level of variation compared to the trans empty vector transgenic rice line (P<0.01).
2.4 转基因水稻淀粉含量变化
收获转基因水稻成熟种子,测定其直链淀粉、支链淀粉、总淀粉和抗性淀粉含量。CmSSSII转基因水稻种子直链淀粉含量显著高于转空载体水稻种子直链淀粉含量,而CmSBEI转基因水稻种子直链淀粉含量显著低于转空载体水稻种子直链淀粉含量;CmSSSII和CmSBEI转基因水稻种子支链淀粉含量显著高于转空载体水稻种子支链淀粉含量;CmSSSII、CmSBEI和转基因水稻种子总淀粉含量显著高于转空载体对照水稻种子总淀粉含量,其中CmSSSII转基因水稻株系总淀粉含量升高的原因是由于直链淀粉和支链淀粉均升高所致,而CmSBEI转基因水稻株系总淀粉含量升高的原因是由于支链淀粉含量的升高程度大于直链淀粉含量的降低;CmSSSII和CmSBEI转基因水稻种子抗性淀粉含量显著高于转空载体水稻种子抗性淀粉含量(图4)。
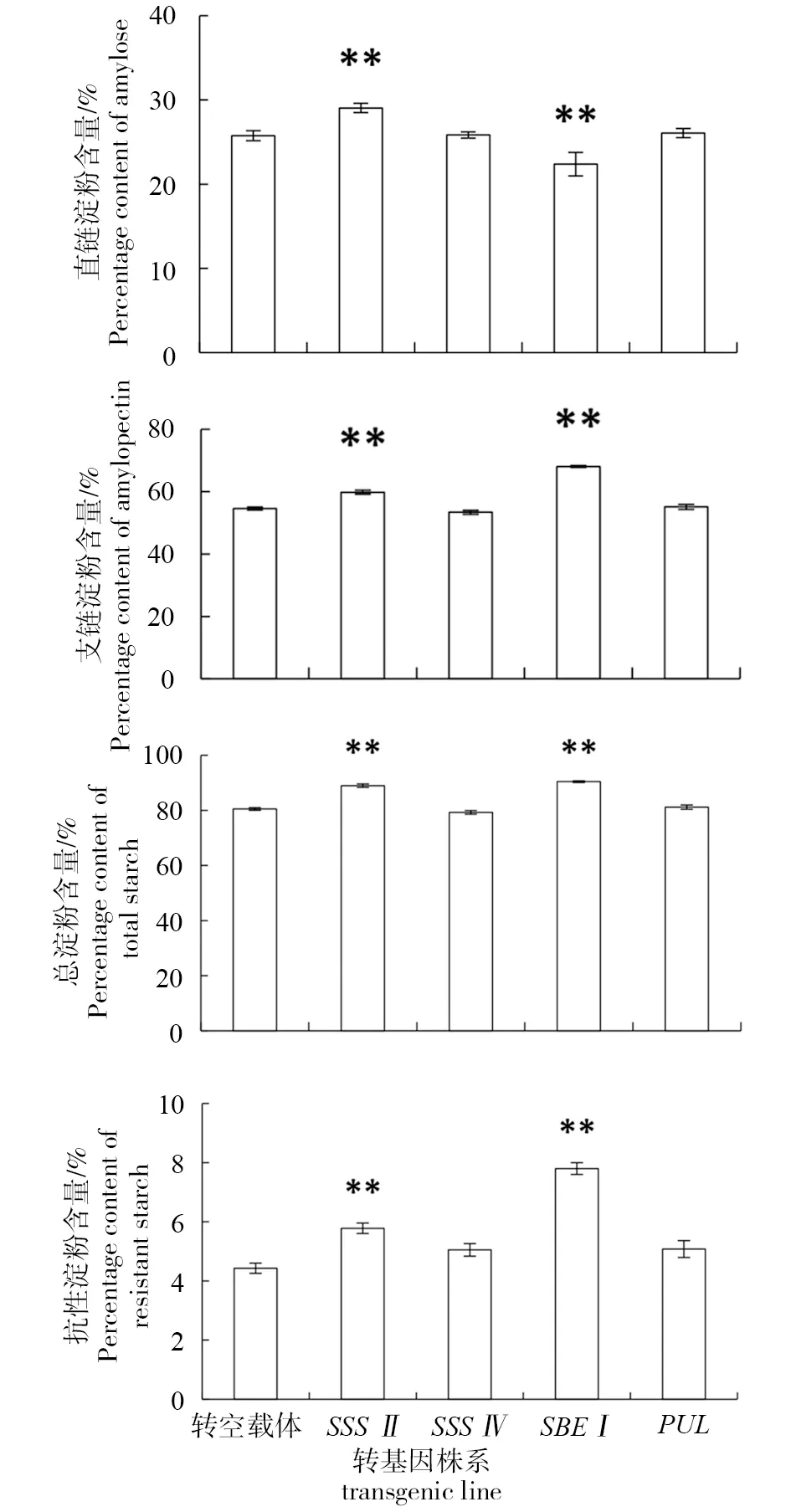
注:**表示与转空载体株系相比差异极显著(P<0.01)。Note:** indicates a highly significant level of variation compared to the trans empty vector transgenic rice line (P<0.01).图4 不同转基因水稻株系种子直链淀粉、支链淀粉、总淀粉和抗性淀粉含量Fig.4 Percentage content of amylase, amylopectin, total starch and resistant starch in the grain of different transgenic rice lines
3 讨 论
淀粉含量是评价板栗品质的重要指标,直链淀粉和支链淀粉的比例对板栗的口感有较大的影响,梁丽松等系统研究板栗淀粉糊化特性与直链淀粉含量及淀粉粒粒径之间的关系[14],陈良珂等研究板栗坚果不同发育时期的淀粉积累规律及其特性,同时挖掘影响支链淀粉合成的关键基因[15],但对于板栗淀粉合成关键酶的基因功能未进行相关验证工作。SSS基因作为淀粉合成酶的关键基因,主要参与直链淀粉的合成[16],在本试验中,CmSSSII基因过量表达使水稻籽粒直链淀粉含量和总淀粉含量显著升高,这与Bin Tian等[17]对SSS基因的功能验证相符合。
SBE为支链淀粉合成酶,不但参与催化支链淀粉分支的形成,而且在分支的非还原末端添加单糖残基,决定淀粉分支的类型和支链淀粉含量[18],在本研究中,CmSBEI基因过量表达使水稻种子支链淀粉含量、总淀粉含量和抗性淀粉含量显著增高,直链淀粉含量显著降低。与David A Brummell等[19]的相关报道相符合。
在水稻中,PUL属于DBE即淀粉脱支酶家族的成员,主要参与支链淀粉的去分支化[20],在本研究中,CmPUL基因过量表达对水稻种子淀粉含量没有显著影响。
CmSSSII和CmSBEI基因的功能与其他物种中的同源基因功能验证的结果相符合。CmSSSIII和CmSBEII转基因株系未能鉴定到转基因阳性植株,可能是该基因在水稻中过量表达导致水稻的败育,无法获得下一代水稻转基因株系。CmSSSIV、CmPUL转基因株系已鉴定到阳性植株却没有表型上的变化,可能是该基因在不同宿主中未表达,导致该基因未能发挥功能。本试验仅初步探讨板栗淀粉合成酶基因的功能,为了更进一步验证问题,还需深入的研究。

