从TLRs介导的炎症信号通路研究补肾方的抗肝损伤机制*
赵彬彬 汪 蓉 姜煜资 张 莹 高月求 陈建杰 王灵台 聂红明△
1.上海中医药大学附属曙光医院(上海,200021) 2.上海市浦东新区中医医院
大多数慢性肝病是一种严重的进展性疾病,肝损伤伴随慢性肝病进展的全部过程。因此,有效的治疗肝损伤对于延缓慢性肝病的进展具有重要的意义。肝损伤是多种肝脏疾病共有的病变结果,乙醇、药物、毒物、病毒等许多因素都可以诱导肝损伤。肝损伤的发生机制复杂,例如氧化应激、CYP450 酶系代谢异常、内毒素、免疫反应、炎症因子以及各种信号通路等。其中Toll 样受体(TLRs) 作为一个模式识别受体家族,其介导的炎症信号通路广泛参与和加剧了各种肝损伤的发生发展[1~8]。
补肾方是由王灵台教授所创,历经30多年的临床验证及其课题组相关研究,表明补肾方具有显著抗肝损伤作用,但其作用机制尚待明确。前期研究中已经发现,补肾方具有下调多种炎症介质作用,如TNF、IL-6、IL-1等,同时,我们还发现,补肾方能下调TLR3/9的表达,补肾方的抗肝损伤作用可能与其抑制TLRs相关炎症信号通路,从而下调炎症介质相关[9~11]。因此,本文试从TLRs介导的炎症信号通路来进一步阐明补肾方的抗肝损伤机制。
1 材料与方法
1.1 实验材料
1.1.1实验动物 SPF级健康成年C57BL小鼠42只,雌雄各半,体质量18~22g,购自上海西普尔必凯实验动物中心,实验小鼠均饲养于上海中医药大学动物实验中心SPF 级动物房,清洁饮水,自由取食。
1.1.2 实验药物及主要试剂 采用以补肾方及其拆方为组方的我院院内制剂—补肾冲剂(沪卫药N(97)-080,均采用深圳华润三九现代中药有限公司生产的中药免煎颗粒。)补肾方:由仙灵脾、菟丝子、甜苁蓉、桑寄生、生地、枸杞子、虎杖、黄芩、苦参各15g、青皮10g;补肾方拆方:补肾阳组(仙灵脾、菟丝子、甜苁蓉各15g)、补肾阴组(桑寄生、生地、枸杞子各15g)、清化湿热组(虎杖、黄芩、苦参各15g);引经药:青皮9g。
刀豆蛋白A(ConA)购自Sigma-Aldrich。肝功能试剂盒购自南京建成生物工程研究所。 ELISA试剂盒购自武汉华美生物科技有限公司。蛋白质印迹分析使用的一抗:抗TLR4,抗TLR3和抗TLR9购自NovusBiologicals LLC;抗TNF-相关联因子(TRAF)6,抗IFN调节因子(IRF)3,抗TBK1,抗TRAF相互作用蛋白(TIRP)购自Abcam;反核因素(NF)-κB,抗MyD88购自Cell Signaling Technology。二抗购自R&DSystems。
1.2 实验方法
1.2.1 实验动物处理 雌雄不限,随机分成7组。A组(正常,Control):等体积生理盐水(NS);B组(模型组,Con A):等体积NS;C组(补肾全方组,BSQ):等剂量补肾方;D组(补肾阳组,BSY):等剂量补肾阳药物;E组(补肾阴组,BSC):等剂量补肾阴药物;F组(清化湿热组,QH):等剂量清化湿热药物;G组(引经组,YJ):等剂量引经药物。各组均予以灌胃给药,A、B组给予同体积的生理盐水,C~G组给予同剂量相应药物,每天给药1次,连续给药7天,第7天给药后4h,除正常组外均给予ConA15mg/kg尾静脉注射,注射后18h处死老鼠。
1.2.2 指标检测 肝功能指标:丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、总胆红素(TBil)、直接胆红素(DBil)和胆碱酯酶(ChE);肝组织HE染色;ELISA法检测外周血相关炎症介质如(IL-1、IL-6、TNF-α、TNF-β);Western Blot法检测TLR3/4/9相关信号通路链中的关键蛋白,如(TBK1、IRF3、TLR9、TLR4、TLR3、TRAF6、NF-κB、TIRP、MyD88)。
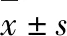
2 结果
2.1 补肾方对实验小鼠肝功能的影响 见图1。

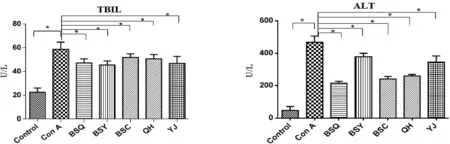
图1 各组实验小鼠肝功能指标的变化(*P<0.05)
2.2 各组实验小鼠肝组织病理变化情况 肝组织HE染色表明,补肾全方及拆方各组均具有一定的改善肝组织炎症坏死的作用,但补肾全组、补肾阳组中坏死区域的面积与模型组相比显著减小。见插页图2。
2.3 各组初小鼠外周血炎症因子水平 见图3。
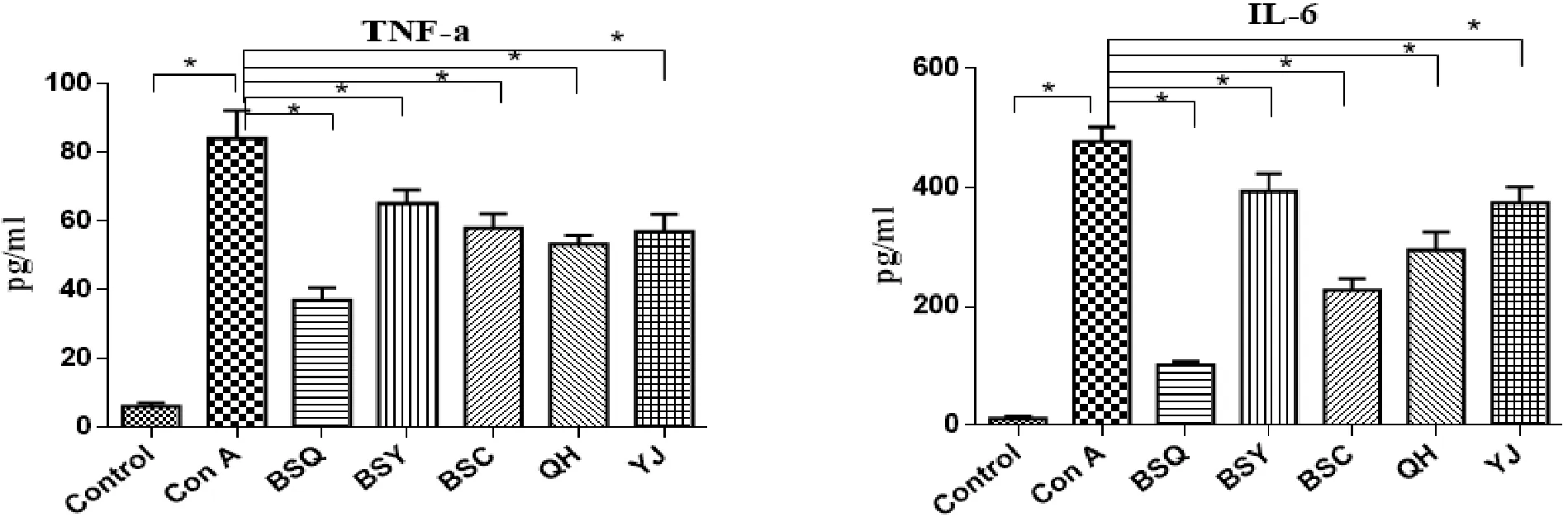
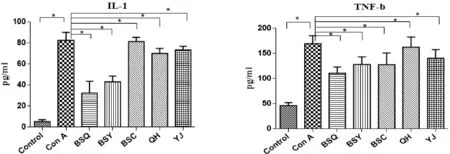
图3 各组实验小鼠主要炎症因子IL-6、TNF-α、TNF-β、IL-1的表达情况
2.4 各组实验小鼠TLR3/4/9信号通路关键蛋白的表达情况 Western Blot检测结果表明,ConA处理后TLR3/4/9相关信号通路链中的关键蛋白如TBK1、IRF3、TLR9、TLR4、TLR3、TRAF6、NF-κB、TIRP、MyD88的表达均增加,补肾全方及其拆方处理后,TBK1、IRF3、TLR9、TLR4、TLR3、NF-κB、MyD88在补肾全组中表达减少,TLR9、TLR4、TRAF6、NF-κB、MyD88在补肾阳组中表达减少,TLR9、TLR3、TRAF6、NF-κB在补肾阴组中表达减少,TRAF6在清化湿热组中表达减少。
3 讨论
Toll样受体(TLR)是参与天然免疫的一类重要蛋白质分子,通过特异识别病原微生物及其细胞壁上的一些保守成分,启动非特异性免疫,并诱导特异性免疫,是连接天然免疫和特异性免疫的桥梁。所有TLR由氨基末端结构域组成,其特征在于多个富含亮氨酸的重复序列和羧基末端TIR与含TIR的适配器交互的域。Toll样受体(TLRs)构成一系列受体,直接识别广谱的外源性和内源性配体,在实现先天性和适应性免疫应答中发挥关键作用,并参与细胞增殖,存活,凋亡,血管生成,组织重塑和修复[12]。在先天免疫髓样细胞中,TLRs诱导炎症分泌因子[13]。
TLR主要激活信号传导介质MyD88(下游所有TLR成员除了TLR3)和TRIF(含有TIR域的衔接子诱导干扰素-β)最终导致激活NF-κB通路和几种促炎症分泌细胞因子[14]。MyD88 通路活化包括三条途径:通过 NF-κB-促炎性细胞因子通路,激活炎性细胞因子 IL-6、TNF-α 基因致其表达;通过 IRF3/5-IFNα/β或IRF7/5-IFNα/β 通路激活 I 型干扰素基因致其表达;通过MAPK激活CD80、CD86 共剌激因子表达,参与获得性免疫反应。MyD88 通路中的NF-κB促炎通路参与炎症慢性化和癌症发生发展;MyD88 通路中的非 NF-κB 促炎通路和非MyD88 通路(TRIF-IRF3/5/7-IFNα/β),通过介导干扰素产生,并启动特异性免疫。已知TLR和MyD88是NF-κB的上游调节因子,在各种类型的细胞中,MyD88介导的信号传导激活转录因子NF-κB和AP-1等,最终导致免疫调节剂(如细胞因子)和抗菌剂(包括AMP)的转录[15]。过盲肠结扎和穿刺(CLP)提高了TLR4,TLR2和(MyD88)蛋白表达水平,曲古菌素A(TSA)可以减弱TLR4,TLR2和(MyD88)蛋白表达水平,其研究结果表明TSA通过抑制脓毒症期间TLR介导的炎症反应来减轻肝损伤[16]。Jung-Woo Kang等研究结果表明,褪黑激素通过调节TLR介导的炎症反应,改善I / R诱导的细胞凋亡从而保护肝脏[17]。先前已有研究表明CD14是TLR依赖性促炎细胞因子产生所必需的,Chen Z等继续研究发现在败血症条件下上调CD14表达时,TLR的MyD88依赖性和TRIF非依赖性途径被激活,该研究破译了TLR与CD14之间的关键性交叉对话[18]。
本课题组从国家六五攻关项目开始确立补肾法为主治疗慢性乙型肝炎的研究,历经 30 余年临床验证,证实补肾法和补肾方治疗慢性乙型肝炎的有效性。同时对补肾法的免疫调控机制进行了系统的研究,在机制探讨中,课题组在各级别课题资助下开展了系列实验研究,证实补肾方通过对免疫的多环节调控作用发挥其抗炎和促生干扰素效应。其效应包括:增强 IL-2、IFN等 Th1 型细胞因子的表达,抑制 IL-4、IL-10 等 Th2 型细胞因子的表达,促进 CD8+的CTL功能活化等;提高 NKT 细胞数量,改善外周血树突细胞共刺激分子表达,促进IFN分泌等。并且发现,补肾方能促进慢性乙型肝炎患者外周血 PBMC中Toll样受体(TLR)3和9表达而介导抗炎效应[9~11]。
本研究进一步证实,补肾方及其各主要配伍组分均有一定的抗肝损伤作用,补肾小鼠方效果,优于各主要配伍组分。值得一提的是,补肾阳组小鼠AST显著下降(P<0.05),补肾阴组小鼠ALT显著下降(P<0.05)),而补肾全方组小鼠ALT、AST均显著下降(P<0.05),也一定程度说明中医配伍的重要性。通过对炎症因子的分析,补肾全方组的IL-6、IL-1、TNF-α、TNF-β均显著下降(P<0.05),补肾阳组的TNF-β、IL-1显著下降(P<0.05),而补肾阴组的TNF-α、TNF-β、IL-6显著下降(P<0.05),再次说明补肾阳与补肾阴在补肾方中的配伍协同性。ConA处理后TLR3/4/9信号通路中关键蛋白TBK1、IRF3、TLR9、TLR4、TLR3、TRAF6、NF-kB、TIRP、MyD88的蛋白表达均显著增加,说明TLR通路被刀豆蛋白A介导的免疫炎症反应激活。TLRs通路激活后,信号转导途径通过细胞外信号调节激酶,如c-JunN-末端激酶、p38、丝裂原活化蛋白激酶和磷酸肌醇3-激酶,转录因子IRF3/5/7,NF-κB,激活蛋白-1以及一些重要的衔接蛋白(如MyD88,TRIF,TRAM、TRAF6等)协调炎症反应[19,20],最终促进相关炎症介质的表达。补肾方干预后的结果表明,补肾方通过抑制TLR3/4/9的表达及其下游通路中关键蛋白的表达,影响TLRs介导的炎症信号通路, 最终下调相关炎症介质,发挥其抗肝损伤作用。 同时发现,不同配伍组分对TLR3/4/9及其下游通路中关键蛋白的影响不尽相同,通过全方配伍后能协同增效,这也是中医组方配伍的魅力所在。
需要指出的是,由于TLRs在肝脏多种免疫细胞的表面均有表达,如T淋巴细胞、肝枯否氏细胞等,若需要进一步明确补肾方对TLRs及其相关信号通路的抑制是作用在哪种细胞,则需要找到更适合的动物模型,该模型既能造成免疫性肝损伤,又能在炎症区域成功分离提取和培养出相关免疫细胞。

