过表达Nrf2对氧化应激状态下骨髓间充质干细胞凋亡的保护作用
汤 娅,石 蓓,赵然尊
(遵义医科大学附属医院 心血管内科,贵州 遵义 563099)
心肌梗死(Myocardial infarction,MI)发生于冠状动脉闭塞,是最常见的心血管疾病之一,发病率和死亡率极高,可导致心肌细胞死亡、瘢痕形成、心室重构,最终导致心肌细胞功能障碍和心功能减退。一般来说,心肌细胞属于不可再生细胞,已损伤的心肌细胞不可恢复其功能,即使药物干预也不能使其恢复[1]。在规定的时间窗内恢复心肌的血流对于逆转心肌损伤的进展和减轻心肌梗死面积的扩大是至关重要的。然而,再灌注本身可能诱导心肌细胞损伤,这大大削弱了其治疗效果,并进一步导致心肌细胞功能恶化。
近年来,干细胞治疗是缺血性心脏病的一种有前景的治疗方法,包括胚胎干细胞(Embryonic stem cells,ESCs)、诱导多功能干细胞(Induced pluripotent stem cells,iPSCs)、内皮祖细胞(Endothelial progenitor cells,EPCs) 、心脏祖细胞(Cardiac progenitor cells,CPCs)及间充质干细胞(Mesenchymal stem cells,MSCs)在内的多种干细胞在心肌梗死中的治疗潜能已被逐渐证实[2]。在这些细胞中,骨髓间充质干细胞(Bone marrow derived-mesenchymal stem cells,BMSCs)具有多向分化潜能和较强的自我更新能力,且取材方便,免疫原性低,被认为是再生医学的理想候选细胞。BMSCs治疗MI已被证明是一种很好的基于细胞治疗策略[3]。已有研究证明,BMSCs通过减少纤维化、促进血管生成,在缺血损伤后改善心功能、延缓心脏重构等方面发挥重要作用[4-5]。此外,大量研究表明,BMSCs移植能有效减轻心肌损伤,改善心功能。然而,由于供体细胞的生存能力较差,干细胞移植治疗效果受到很大的限制[6-7]。BMSCs在缺血缺氧环境中容易发生凋亡,阻碍了其在细胞治疗中的作用发挥[8-9];缺血心肌中严酷的宿主缺血微环境可加速细胞凋亡,进一步损害了移植供体干细胞的存活并影响功能的发挥[10]。因此,提高移植供体细胞存活率和保留时间是增强BMSCs介导的心肌梗死治疗效果的关键[11]。
核因子相关因子-2(Nuclear factor-E2-Related Factor 2,Nrf2)是机体抗氧化反应的重要因子,其活化后可以激活下游多种抗氧化基因和Ⅱ相解毒酶基因的转录和表达,这些基因包括血红素氧化酶-1(HemeOxygenase-1,OH-1)、超氧化物歧化酶、谷胱甘肽过氧化物酶和硫氧还蛋白等。通过与细胞核中的抗氧化反应元件(ARE)结合,调节广泛的抗氧化酶、II相解毒酶和转运体的组成和诱导表达,激活抗氧化酶基因和解毒酶活性,保护心肌细胞免受氧化和亲电应激[12]。在本研究中,通过慢病毒在BMSCs中过表达Nrf2,观察氧化应激状态下BMSCs的凋亡情况,同时探讨过表达Nrf2对BMSCs的保护作用是否通过Nrf2/HO-1信号通路来实现的。
1 材料与方法
1.1 材料
1.1.1 实验动物 3~4周龄Spreagne-Dawley(SD)大鼠,雌雄不拘,体重40~50 g,由重庆腾鑫动物公司提供,动物许可证号:SCXK(渝)2012-0005。
1.1.2 试剂 慢病毒载体Nrf2基因购自北京合生基因科技有限公司;APC标记小鼠抗大鼠CD90 抗体、PE标记小鼠抗大鼠CD45 抗体(BioLegend公司);兔抗大鼠Nrf2抗体、兔抗大鼠NQO1抗体、兔抗大鼠HO-1抗体、兔抗大鼠GAPDH、羊抗兔多克隆抗体IgG (博士德);胎牛血清(Fetal bovine serum,FBS)(澳大利亚MRC公司);DMEM低糖培养基、 0.25%胰蛋白酶、 青霉素(10 000 U/mL)/链霉素(10 000 μg/mL)(美国Hyclone公司);凋亡试剂盒(北京四正柏生物科技公司)。
1.1.3 主要仪器 生物安全柜、孵箱、酶标仪(型号ELx800)(赛默飞);低温高速离心机(Eppendorf Centrifuge);显微镜、倒置荧光显微镜(OLYMPUS);流式细胞计数仪(贝克曼); 高压消毒锅(TOMY);-20℃冰箱(青岛海尔);紫外分光光度仪(TU1810)(谱析仪器厂);超低温冰箱(-80℃)(Forma Scientic);MILLI-Q蒸馏水纯化系统(美国Millipore公司);蛋白质变性加热器(苏州海狸公司);图像分析系统(美国Bio-rad公司)。
1.2 方法
1.2.1 SD大鼠BMSCs的分离和培养 颈椎脱臼法处死大鼠,75%酒精浸泡10 min,无菌条件下取出股骨及胫骨,以2%新洁尔灭冲洗2次,移入超净台,无菌条件下剥离肌肉及筋膜;4%青霉素(10 000 U/mL)/链霉素(10 000 μg/mL清洗两遍,剪开骨骺端,暴露骨髓腔,用5 mL注射器抽取普通低糖DMEM培养基反复冲洗骨髓腔,收集单细胞悬液,1 200 rpm离心5 min,弃上清,加入低糖DMEM完全培养基(含10%FBS及1%双抗),接种于T25培养瓶中,于5%CO2,37℃孵箱中培养;24 h后进行首次全量换液,以后每3~4天换液1次,待细胞生长汇合度达80%~90%时进行传代培养,此后每3~4天传代1次,第三代及以后的细胞用于后续实验。
1.2.2 SD大鼠BMSCs的流式细胞术表型鉴定 取生长状态良好的第三代细胞,0.25%胰酶消化,收集单细胞悬液,1 200 rpm离心5 min,收集上清,平均分为3管,向每管细胞(100 μL)中分别加入CD45-PE、CD90-APC抗体各5 μL ,室温避光孵育2 h;流式细胞仪检测。本课题组前期对大鼠BMSCs提取及鉴定实验[13-14], CD29、CD90流式细胞术鉴定细胞纯度分别为99.3%、99.5%,CD45为1.3%,故只进行了CD90、CD45的流式细胞术鉴定。
1.2.3 SD大鼠BMSCs的Nrf2慢病毒载体转染 各组慢病毒载体购自北京合生基因科技有限公司;取生长状态良好的第三代BMSCs,随机分为5组, Control组、Nrf2-Vector组、si-Nrf2组、Nrf2-Scramble组、LV-Nrf2组;转染病毒之前,加入3 μL 10 mg/mL的Polybrene共培养30 min,后加入MOI为150的病毒量,感染后12 h换回常规完全培养基,分别于感染48 、72 h用显微镜观察病毒荧光表达情况,同时采用Western Blot验证Nrf2转染成功。
1.2.4 流式细胞术探讨H2O2模拟氧化应激环境的最佳浓度及时间 通过查阅相关文献,得知300 μmol/L H2O2处理4 h为诱导BMSCs氧化应激的最佳浓度及时间[15]。选取生长状态良好的第三代BMSCs,分别以0、100、200、300、400 μmol/L H2O2处理4 h(n=3),消化离心后收集细胞;加入5 μL A nnexin V-FITC混匀后,加入10 μL Propidium Iodide(PI),混匀;室温避光反应15 min,上机进行流式细胞仪检测。
1.2.5 流式细胞术检测各组细胞凋亡 各组细胞按照实验要求结束后,消化离心收集细胞;余步骤同1.2.4。
1.2.6 Western blot检测慢病毒转染Nrf2后Nrf2、HO-1及NQO1的表达水平 提取各组细胞总蛋白。10%的SDS-PAGE分离胶进行电泳,PVDF电转,5%的脱脂牛奶封闭1.5 h,TBST洗膜。与一抗结合(兔抗大鼠Nrf2 1∶300、兔抗大鼠NQO1 1∶500、兔抗大鼠HO-1 1∶500、兔抗大鼠GAPDH 1∶300), 4 ℃孵育过夜。洗膜,二抗孵育1 h(羊抗兔多克隆抗体IgG 1∶5000);ECL显色:按照说明书用移液枪以A、B两种发光液按1∶1的比例混匀并均匀滴在PVDF膜上,用Image Lab凝胶成像系统曝光获得成像图片;使用Image Pro Plus软件对图片上每个特异性条带灰阶度进行数字化分析。

2 结果
2.1 SD大鼠BMSCs形态学鉴定 培养第3天,细胞有触角伸出,细胞形态多数呈多角形、棱形,少部分呈现条索状,细胞为成簇状团状生长,胞浆内有颗粒状结构分布。细胞培养至第7天,原代细胞长满80%~90%,即可开始传代培养。传代后细胞进入快速生长期,第3代细胞形态均一,呈鱼群状、漩涡状生长(见图1)。
2.2 SD大鼠BMSCs流式细胞术鉴定 第3代骨髓间充质干细胞CD90阳性表达(97.18%),而CD45弱表达(3.36%,见图2)。
2.3 BMSCs成功转染并表达Nrf2 慢病毒感染BMSCs 48h后,荧光显微镜下可见少量绿色荧光表达,感染72h后,绝大多数细胞呈现出绿色荧光(见图3,对照组图略)。故当MOI=150时,绿色荧光表达最强且细胞形态未见明显变化,表明慢病毒可成功将Nrf2基因转染至BMSCs,且绝大部分细胞呈现出绿色荧光,WB验证转染成功,满足本实验的要求(见图4)。
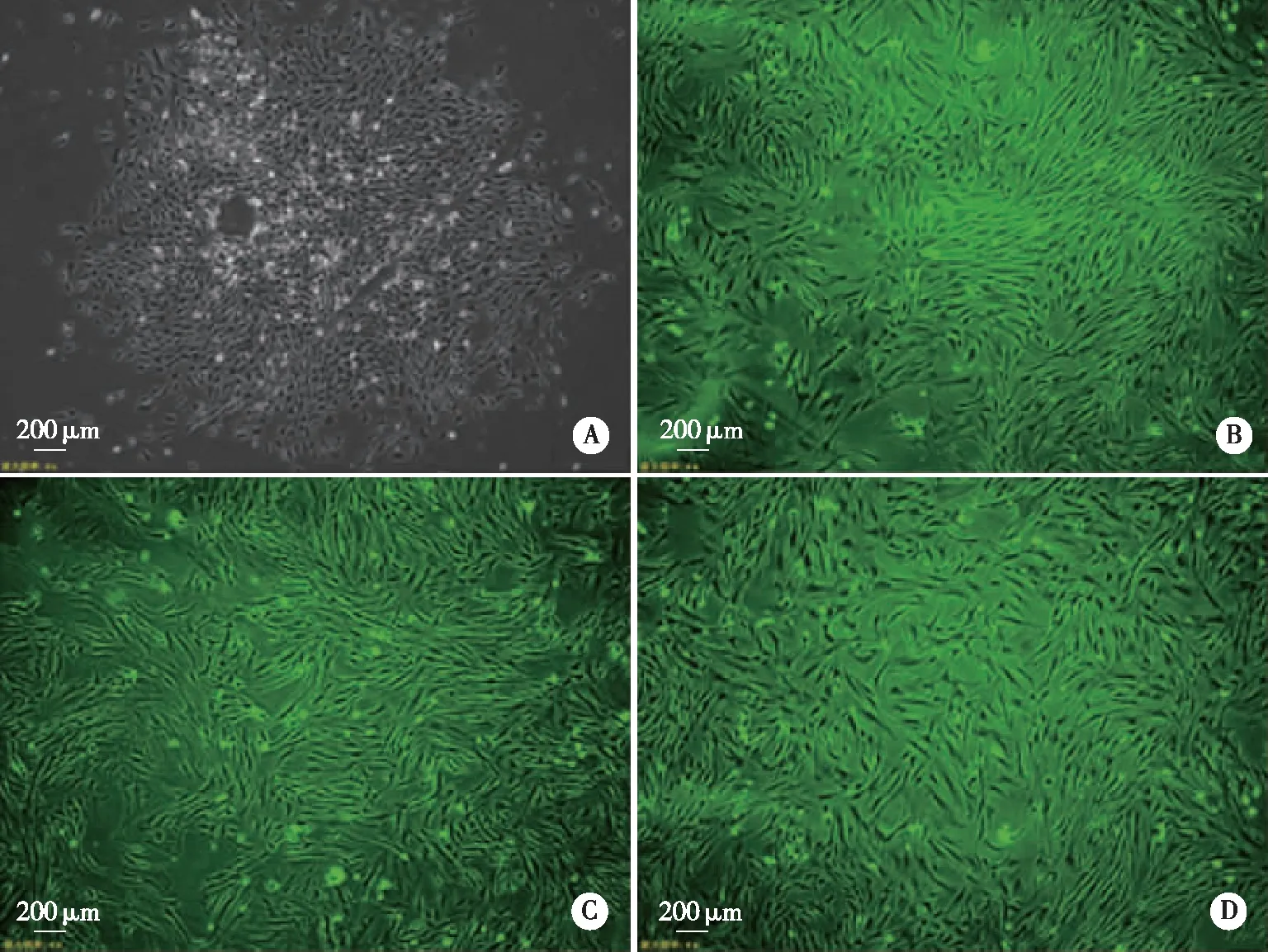
A、B、C、D分别为P0~P3培养细胞。图1 倒置显微镜下观察BMSCs形态
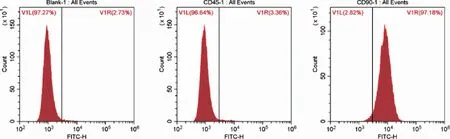
图2 流式鉴定P3MSCs细胞表面标记物
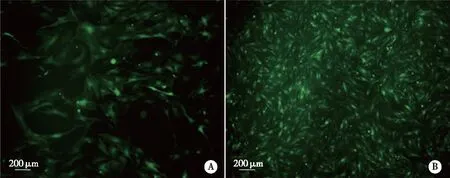
A: 48 h;B:72 h。图3 倒置显微镜下观察病毒转染BMSCs
2.4 H2O2模拟BMSCs氧化应激环境的最佳浓度及时间确定 不同浓度的H2O2(0、100、200、300、400μmol/L)处理BMSCs4h后收集细胞,以流式细胞术检测各组细胞早期凋亡和晚期凋亡(见图5)。结果显示, 300μmmol/L组处理BMSCs 4h凋亡率显著上调(P<0.05)且大部分细胞为早期凋亡,同时死亡细胞量较少。因此选定300μmmol/L H2O2处理BMSCs 4 h作为诱导BMSCs凋亡的最佳浓度和时间,用于体外模拟心肌梗死后氧化应激微环境。
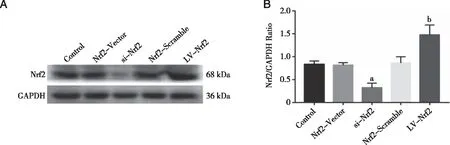
a:与Control组相比较,P<0.05;b:与Control组相比较,P<0.001;n=3。图4 WB检测慢病毒转染后Nrf2水平
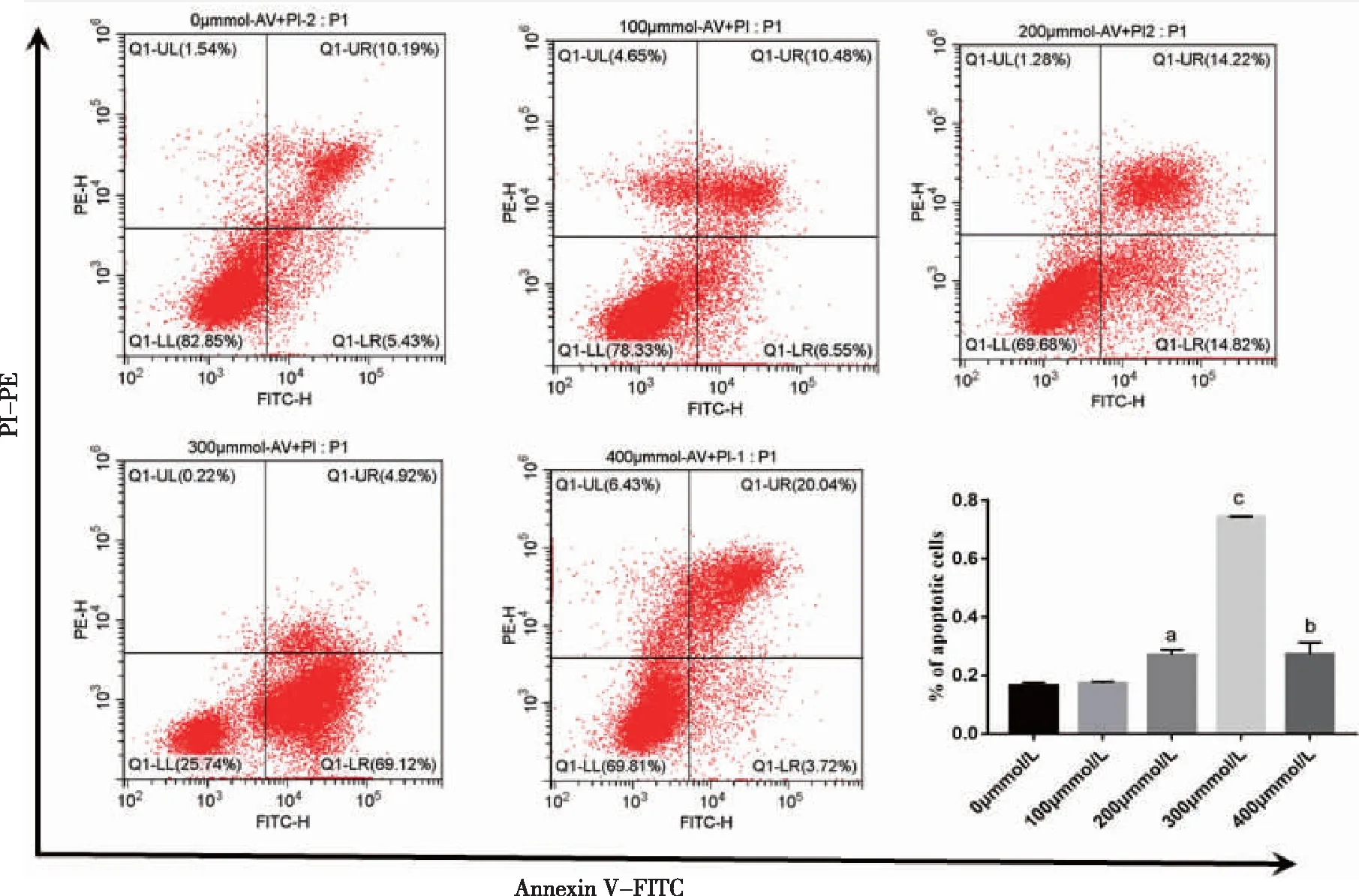
a:与100μmmol/L组比较,P<0.05;b:与300μmmol/L组比较,P<0.001;c:与200μmmol/L组比较,P<0.001;n=3。图5 不同浓度H2O2诱导BMSCs氧化应激模型
2.5 过表达Nrf2降低氧化应激状态下BMSCs的凋亡 Control组、Nrf2-Vector组、si-Nrf2组、Nrf2-Scramble组以及LV-Nrf2组,BMSCs总体凋亡率分别为68.52%±0.04、60.94%±0.02、89.22%±0.02、62.22%±0.01、38.99%±0.06;与Control组相比,si-Nrf2组BMSCs总体凋亡率显著上调(P<0.05),抑制BMSCs中Nrf2表达可促进H2O2诱导BMSCs凋亡。相反,与Control组相比, LV-Nrf2组BMSCs的总体凋亡率显著降低(P<0.05),过表达BMSCs中Nrf2降低H2O2诱导的BMSCs凋亡(见图6)。
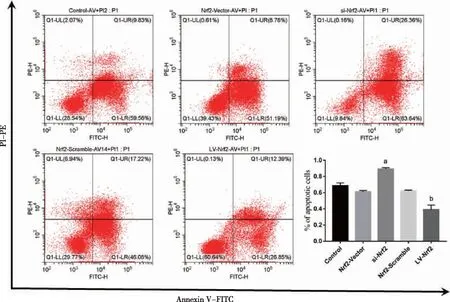
a:与Control组相比较,P<0.001;b:与Control组相比较,P<0.001;n=3。图6 流式细胞术检测各组细胞凋亡
2.6 过表达Nrf2提升BMSCs抗氧化蛋白HO-1、NQO1水平 与Control组相比,LV-Nrf2组Nrf2、HO-1、NQO1蛋白相对表达量显著上调(P<0.05),说明过表达Nrf2可以促进BMSCs内抗氧化蛋白的表达;相反,与Control组相比,si-Nrf2组Nrf2、HO-1、NQO1蛋白相对表达量显著下调(P<0.05),说明敲除Nrf2可以抑制BMSCs内抗氧化蛋白的表达;此外,与Control组相比,Nrf2-Vector组、Nrf2-Scramble组Nrf2、HO-1、NQO1蛋白相对表达量无明显改变(P>0.05,见图7)。
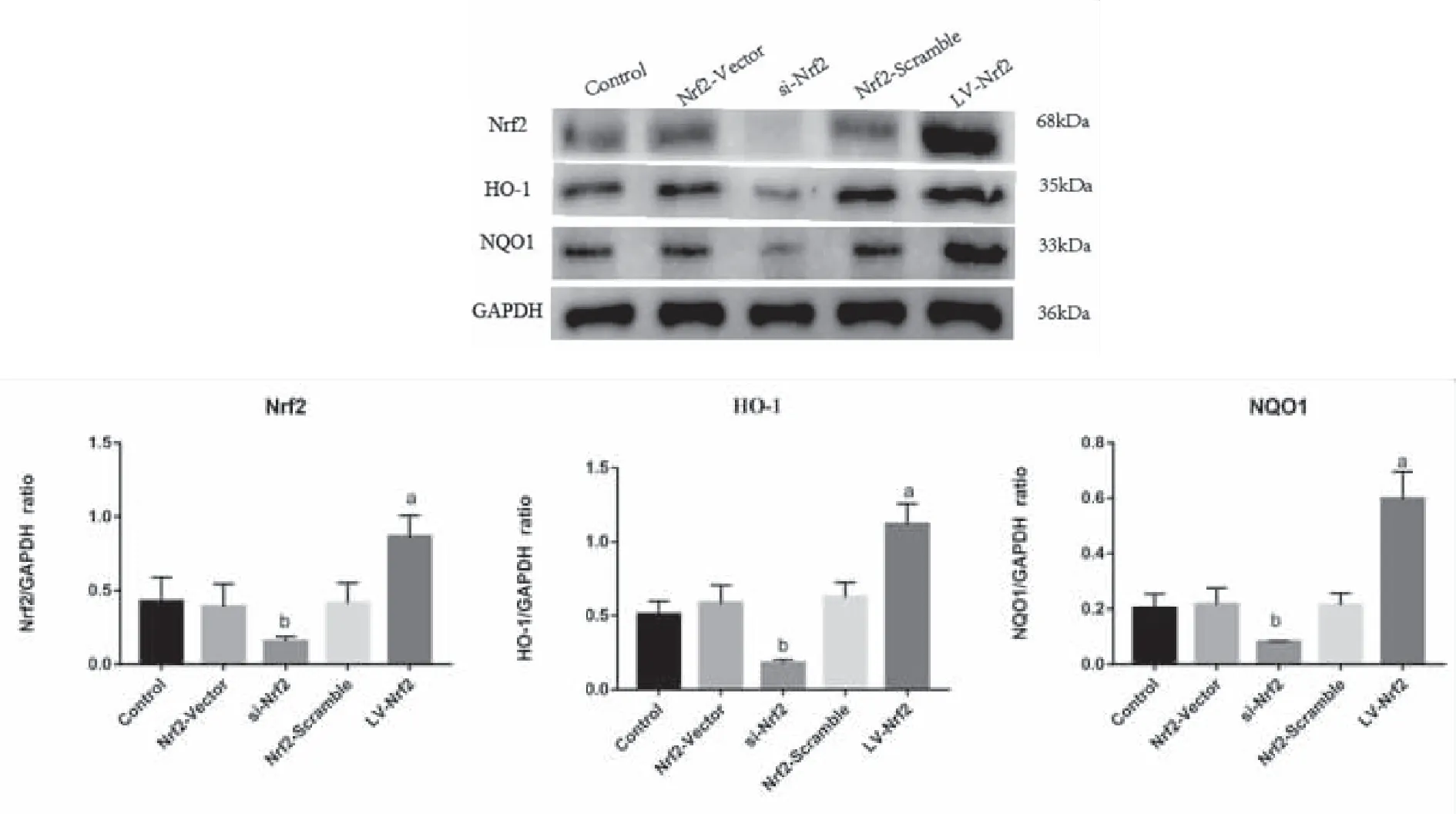
a:与Control组相比较,P<0.001;b:与Control组相比较,P<0.001; n=3。图7 WB检测Nrf2、 HO-1、NQO1的相对表达量
3 讨论
心肌梗死(MI)是最常见的急性心脏损伤,常常导致心力衰竭,近年来,干细胞移植作为心脏再生和心脏修复的一种新方法正在兴起,具有取代传统方法的潜力。骨髓间充质干细胞(BMSCs)因具有易于获得、可快速扩增、无伦理争议和免疫原性低等优势,在异基因移植中受到广泛关注[16]。大量研究表明,BMSCs移植能有效减轻心肌损伤、改善心功能,但确切的分子机制尚不清楚[6-7]。虽然基于BMSCs的心肌梗死治疗已在动物和临床得到证实,但对移植BMSCs的体内追踪显示,只有少数BMSCs在宿主心脏内保留和存活,而大多数移植的BMSCs发生凋亡和衰老,丧失再生活性[17-18],BMSCs移植后低“归巢”率、低存活率和低分化率严重制约了骨髓间充质干细胞移植在临床上的应用。因此,如何提高移植BMSCs的保留和存活,抑制细胞凋亡和衰老,是提高移植BMSCs治疗效果的关键。有研究者发现,基因修饰可有效提高移植BMSCs的存活率;邓宁波等[19]证实人血红素加氧酶1 修饰的大鼠BMSCs对缺血缺氧环境损伤的耐受能力明显增强。此外,陈少强等人发现慢病毒载体可介导外源性基因SDF-1α在大鼠BMSCs中高效表达,并促进骨髓间充质干细胞的增殖和迁移[20]。故本实验使用慢病毒载体介导Nrf2在BMSCs中高表达,从而提高移植BMSCs的抗凋亡能力。
基因修饰可分为病毒载体修饰和非病毒载修饰,而目前较为常用的病毒载体包括慢病毒载体、反转录病毒载体、腺相关病毒载体、腺病毒载体,其中慢病毒载体不仅可感染分裂期和非分裂期细胞,且表达时间长、低免疫原性、安全性高、转染效率高以及可在细胞中稳定表达,在心血管疾病、癌症及神经系统疾病方面被广泛的应用[21],所以本实验选用自我失活的慢病毒质粒载体系统转染BMSCs,建立稳定过表达Nrf2及沉默Nrf2的骨髓间充质干细胞系,促进移植BMSCs的归巢率及存活率。
真核细胞通过激活Nrf2来对抗氧化和其他环境压力,Nrf2是治疗各种炎症和氧化相关健康疾病的潜在治疗靶点;Nrf2/HO-1/NQO1信号通路被认为是一种新型的氧化信号通路,具有抗氧化应激、抗凋亡等多种功能[22]。前期不少研究表明,在各种氧化应激状态下,激活Nrf2/HO-1/NQO1信号通路可有效增强细胞的抗氧化能力[23-27]。因此,本实验选择Nrf2作为目的基因,探讨过表达Nrf2对骨髓间充质干细胞凋亡的影响。在本研究中,我们试图阐明Nrf2转染到BMSCs在氧化应激环境下抗凋亡的可能机制,结果发现,与Control组相比,LV-Nrf2组BMSCs的总体凋亡率显著降低(P<0.05),抗氧化相关蛋白Nrf2、HO-1、NQO1相对表达量显著上调(P<0.05);si-Nrf2组BMSCs总体凋亡率显著升高(P<0.05); si-Nrf2组抗氧化相关蛋白Nrf2、HO-1、NQO1相对表达量显著下调(P<0.05),表明慢病毒转染的BMSCs在氧化应激状态下具有更好的抗凋亡能力,并且极有可能通过激活Nrf2/HO-1/NQO1信号通路来发挥作用的。本实验研究结果显示,Nrf2慢病毒转染后的BMSCs对抗氧化应激的能力比单纯BMSCs效果更强,而Nrf2慢病毒沉默后的BMSCs对抗氧化应激的能力比单纯BMSCs效果更弱.说明Nrf2增强了BMSCs对抗氧化应激损伤的能力,其机制可能是Nrf2转染BMSCs后激活了Nrf2及其下游的抗氧化蛋白的表达,从而发挥保护BMSCs的作用。
综上所述,过表达Nrf2可有效减少氧化应激状态下骨髓间充质干细胞的凋亡,其机制可能是通过激活Nrf2/HO-1/NQO1信号通路,调节Nrf2、HO-1及NQO1的活性有关。
- 遵义医科大学学报的其它文章
- 两种手术方式对单侧完全性唇腭裂患者上颌骨发育影响的对比研究
- Phylogenetic characteristics and population genetic diversity of 15 autosomal STR loci in Tujia population of Guizhou of China
- PAX1甲基化与蛋白检测在宫颈鳞癌及上皮内病变中的应用价值分析
- Effects of icariside II on hepatic cytochrome P450 expression in mice
- 九香虫水提液对锰中毒大鼠睾丸损伤的抗凋亡作用
- 鞘内注射ZD7288对糖尿病大鼠周围神经痛及血糖的作用

