生物素对L-缬氨酸发酵的影响
徐 达,梅漫莉,徐庆阳,2,*,陈 宁,2
(1.天津科技大学生物工程学院,天津 300457;2.代谢控制发酵技术国家地方联合工程实验室,天津市氨基酸高效绿色制造工程实验室,天津 300457)
L-缬氨酸是人体所必需的8 种氨基酸之一,属于分支链氨基酸,是合成各类抗体、激素以及酶等的原料,在人体内有特殊的生理功能,是维持人生命活动的重要物质[1]。目前,L-缬氨酸在自然环境中主要以蛋白质组成成分的形式存在,但是游离的L-缬氨酸在自然界中并不多见,因此,获取L-缬氨酸的途径主要有化学合成法、提取法以及微生物发酵法[2]。随着对L-缬氨酸研究的深入,具有原料成本低、反应条件温和及可大规模生产等优点的微生物发酵法逐渐成为世界范围内生产L-缬氨酸的主要方式,而发酵法生产L-缬氨酸的成本则主要受到发酵水平高低的影响[3-5]。发酵水平的高低在发酵生产的上、中、下游都有不同的体现:发酵生产上游的菌种改造[6-9]、发酵生产中游的过程控制[10-12]以及发酵生产下游的分离提取[13-15]都关乎发酵生产的最终产量。目前,L-缬氨酸主要利用经代谢工程手段改造之后的谷氨酸棒状杆菌进行发酵生产,而这种方法目前主要面临糖酸转化率不高、主产物积累造成反馈抑制以及副产物丙氨酸中后期积累过多影响最终L-缬氨酸提取的问题[16]。
生物素又称VH、VB7和辅酶R,以多种方式参与谷氨酸棒状杆菌的生长代谢,包括丙酮酸脱羧反应,合成吡啶、核苷酸、核酸,形成嘌呤核嘧啶的碱基以及合成脂肪酸、蛋白质和聚糖等。生物素[17-18]是整个生物界生长发育所必需的元素,在使用谷氨酸棒状杆菌作为生产菌株发酵生产L-缬氨酸时,生物素添加量直接影响生产菌的生长、增殖和代谢速率,并决定细胞转型的时间及细胞膜的通透性,添加适量的生物素能够使产酸高峰期提前,延长产酸周期,从而提高L-缬氨酸的产率,因此,确定一个合适的生物素添加量是提高L-缬氨酸产率的有效手段。
本研究着重探究生物素添加量,提高L-缬氨酸的发酵产量以及糖酸转化率;同时,为解决发酵后期主副产物过多的问题,采用膜偶联透析发酵的过程控制方式达到解除产物反馈抑制以及大量去除丙氨酸的目的,使得发酵液中L-缬氨酸和L-丙氨酸含量维持在较低的水平,此工艺能够在生产提取环节中有效降低能源的消耗,提高发酵液的质量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
谷氨酸棒状杆菌XV0505(Leu-+Ile-+2-TAr+α-ABr+SGr),天津科技大学代谢工程研究室保藏菌种。
1.1.2 培养基
斜面培养基:牛肉膏10 g/L、蛋白胨5 g/L、酵母粉10 g/L、玉米干粉10 g/L、NaCl 2.5 g/L、KH2PO41 g/L、MgSO4·7H2O 0.5 g/L。121 ℃灭菌20 min。
种子培养基:葡萄糖30 g/L、KH2PO41.5 g/L、MgSO4·7H2O 0.4 g/L、VB10.3 mg/L、VH 200 μg/L、玉米干粉20 g/L(121 ℃、20 min单独灭菌)、豆粕水解液10 mL/L、酵母粉5 g/L、微量元素混合液1 mL/L、蛋氨酸1 g/L。115 ℃灭菌15 min。
发酵培养基:葡萄糖80 g/L、KH2PO42.5 g/L、MgSO4·7H2O 0.8 g/L、VB10.2 mg/L、VH(20、50、80、120 μg/L)、玉米浆(121 ℃、20 min单独灭菌)、豆粕水解液20 mL/L、微量元素混合液1 mL/L、谷氨酸5 g/L、亮氨酸0.22 g/L、异亮氨酸0.1 g/L、蛋氨酸0.7 g/L。115 ℃灭菌15 min。
透析培养基:KH2PO45 g/L、MgSO4·7H2O 3 g/L、VB12 mg/L、玉米干粉5 g/L(121 ℃、20 min单独灭菌)、微量元素混合液10 mL/L。115 ℃灭菌15 min。
1.2 仪器与设备
SBA-40E生物传感分析仪 山东省科学院生物研究所;5 L自动控制发酵罐、30 L自动控制发酵罐上海保兴生物设备工程有限公司;KQ-C高压蒸汽发生器上海奉贤协新机电厂;1 2 0 0高效液相色谱仪、C18柱(15 mm×4.6 mm,3.5 μm) 美国Agilents Technologies公司;恒温水浴锅HH-4 金坛市科学仪器厂;752分光光度计 上海分析仪器厂;SS-325型全自动灭菌锅 日本Tomy仪器有限公司;生物显微镜日本Olympus株式会社;FA2204B电子天平 上海精密科学仪器有限公司。
1.3 方法
1.3.1 菌种培养与发酵
菌种在-80 ℃的环境下保藏在20%的甘油管中。接种于试管斜面活化24 h,于200 mL茄型瓶上扩培24 h。
5 L罐发酵培养种子,发酵液定容至3 L,温度32 ℃,初始通风量为2 L/min,转速200 r/min,通过自动流加氨水控制pH 7.0~7.2,以泡敌消泡,培养14 h左右,菌体量生长至OD600nm为1.1时接种发酵。
30 L罐进行发酵,接种量15%~20%,定容至15 L,温度32 ℃,初始通风量0.5 m3/h,转速200 r/min,通过自动流加氨水控制pH 7.0~7.2,罐内糖质量浓度降至15 g/L时,按照一定脉冲比流加补糖,维持残糖质量浓度为10~15 g/L,以泡敌消泡,培养52 h。
1.3.2 生物素添加量梯度控制发酵
在发酵培养基中,以生物素添加量为变量,选取20、50、80、120 μg/L四个梯度,分别进行3 个批次实验,记录实验数据并绘制曲线图。
1.3.3 在线膜偶联间歇透析发酵
发酵过程中进行取样测定,在L-缬氨酸与L-丙氨酸达到一定量时,对发酵液进行膜偶联间歇透析发酵[19-21]处理(约28 h),同时向罐内补加新配制的经过灭菌处理的透析培养基,具体控制补加透析培养基速率与透析速率保持一致:每透析出1 L发酵清液,向罐内加入1 L透析培养基,使罐内发酵液体积维持在一定的量(28 h时约16 L)。每次透析时间控制在30 min左右,统计数据绘制曲线时计入实际发酵时间。
1.3.4 指标测定
1.3.4.1 葡萄糖含量测定
每间隔4 h取样离心,取上清液,利用SBA生物分析仪测定发酵液内残糖含量;电子天平称质量测量记录每4 h流加补糖的量。
1.3.4.2 菌体量测定
每间隔4 h取样,样品用去离子水稀释20 倍,在600 nm波长处测定OD值。
1.3.4.3 pH值测定
梅特勒pH电极在线检测,pH精密试纸辅助矫正。
1.3.4.4 溶氧测定
梅特勒溶氧电极在线检测。
1.3.4.5 温度测定
温度电极在线检测。
1.3.4.6L-缬氨酸及L-丙氨酸测定
发酵液中L-缬氨酸与L-丙氨酸含量用高效液相色谱法分析测定[22-23]。采用Agilent C18(15 mm×4.6 mm,3.5 μm)色谱柱,衍生剂为2,4-二硝基氟苯,柱前衍生,有机相为50%乙腈溶液,无机相为4.1 g/L醋酸钠溶液,柱温33 ℃,流速1 mL/min,检测波长360 nm。
1.4 数据处理
糖酸转化率计算如下式所示:
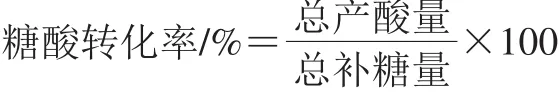
所有实验数据取3 次实验的平均值。单因素方差分析之后Dunnettt检验确定数据差异的显著性(P<0.05,差异显著)。
2 结果与分析
2.1 生物素添加量对菌体生长及L-缬氨酸产率的影响

图1 不同生物素添加量下发酵液的OD600 nmFig. 1 The absorbance of zymotic fluid under different contents of biotin
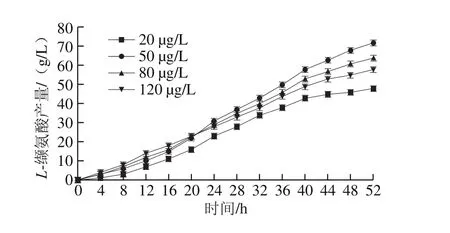
图2 不同生物素添加量下L-缬氨酸产量Fig. 2 Production of L-valine under different contents of biotin
经过14 h的种子培养及52 h的发酵培养,随生物素添加量的增加,菌液OD600nm分别达到了1.621、1.761、1.768和1.830(图1),L-缬氨酸的最终产量分别达到了48、72、64 g/L和58 g/L(图2)。可见生物素添加量对L-缬氨酸产量的影响显著:在发酵培养基中生物素添加量越高,菌体生长越快,最终菌体浓度越高;生物素添加量过高时,菌体生长迅速,发酵前期产酸速率高,中后期产酸速率下降,最终产量降低;生物素添加量为50 μg/L左右时,L-缬氨酸产量最高,菌体量生长适中。
2.2 生物素添加量对菌体耗糖速率及糖酸转化率的影响
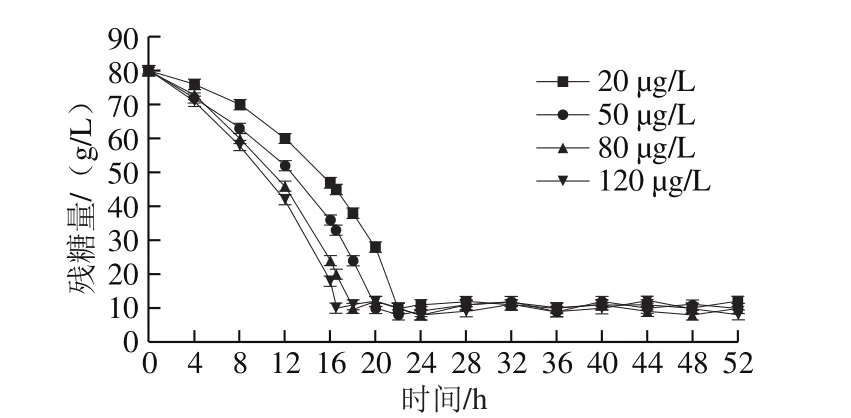
图3 不同生物素添加量下发酵液内的残糖Fig. 3 Residual glucose in fermentation liquor with different biotin additions

图4 不同生物素添加量下每升发酵液每4 h耗糖量Fig. 4 Glucose consumption of fermentation liquor every 4 hours with different biotin additions

表1 不同生物素添加量下发酵参数对比Table 1 Comparison of fermentation parameters with different amount of biotin addition
经测算耗糖量,在初糖质量浓度80 g/L的发酵中,随生物素添加量的增加,初糖质量浓度降至10 g/L水平所需发酵时间减少,依次为22、19、18、16.5 h(图3),可见菌体耗糖速率与生物素添加量呈正相关;如图4所示,根据每4 h所记录流加糖量,发酵进行至30 h左右时,耗糖进入高峰阶段,菌体生长速率趋于平缓,菌体消耗的葡萄糖更多的用于合成代谢产物,此时L-缬氨酸与L-丙氨酸皆处于快速生成阶段;发酵结束时,生物素添加量由低到高的批次糖酸转化率依次为24%、32%、27%和22%(表1、图5)。可见,控制生物素添加量可有效提高L-缬氨酸的生产效率,降低生产成本,提高发酵生产的效益。
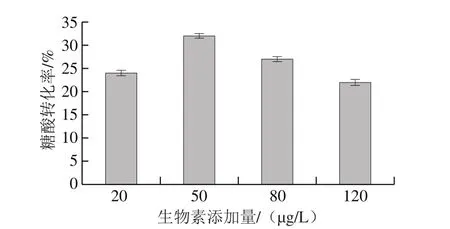
图5 不同生物素添加量下的糖酸转化率Fig. 5 Conversion rate of sugar and acid with different biotin additions
2.3 生物素添加量对副产物L-丙氨酸的影响
L-丙氨酸作为L-缬氨酸发酵的主要副产物,易溶于水,严重影响L-缬氨酸发酵的转化率以及下游提取效率,因此,有效控制发酵中L-丙氨酸产量是亟待解决的问题。如图6所示,发酵结束时,随生物素添加量的增加,L-丙氨酸产量分别为9、12、15、22 g/L。可见L-丙氨酸产量与生物素添加量呈正相关。
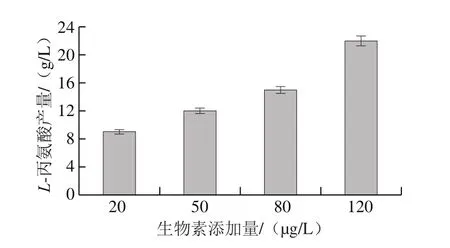
图6 不同生物素添加量下L-丙氨酸含量Fig. 6 Production of L-alanine with different biotin additions
2.4 在线膜偶联间歇透析发酵工艺

图7 50 μg/L生物素添加量下L-缬氨酸与L-丙氨酸的产量Fig. 7 Production of L-alanine and L-valine under 50 μg/L of biotin
选取生物素添加量50 μg/L的发酵批次作为标准,每间隔4 h取样离心,测定发酵液中L-丙氨酸含量与L-缬氨酸含量,结果如图7所示。在发酵前中期,菌体处于生产L-缬氨酸速率较高的阶段;发酵后期,L-缬氨酸产酸速率下降,L-丙氨酸产酸速率提升,因发酵液内L-缬氨酸产量过高而产生反馈抑制现象,菌体内代谢流量更多地流向L-丙氨酸方向,使得L-丙氨酸产量增多,降低了L-缬氨酸的转化效率。
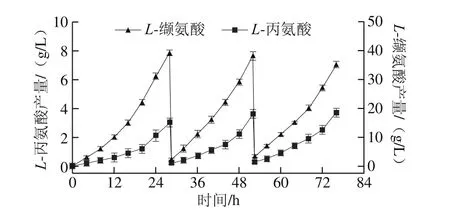
图8 膜偶联透析下发酵液内L-缬氨酸与L-丙氨酸产量Fig. 8 Production of L-alanine and L-valine under membrane coupled intermittent dialysis fermentation
如图8所示,采用在线膜偶联透析发酵工艺,在发酵进行至28 h时,罐内L-缬氨酸质量浓度累积至40 g/L,L-丙氨酸质量浓度累积超过了3 g/L,主产物受到抑制,副产物进入快速生成阶段,此时对发酵液进行在线膜偶联透析,分离出发酵液内较高质量浓度的L-缬氨酸和L-丙氨酸,截留罐内菌体,使其在新加入的透析培养基中迅速恢复活力并继续发酵产酸;透析之后,罐内L-缬氨酸质量浓度降至3 g/L左右,L-丙氨酸质量浓度降至0.3 g/L左右,继续发酵24 h左右,罐内L-缬氨酸质量浓度再次达到40 g/L,且L-丙氨酸也再次累积至3 g/L,此时对发酵液进行第2次透析,降低罐内主副产物的含量,使发酵延续下去,延长菌体产酸周期,并大幅提高单批次发酵总产酸量。通过膜偶联透析发酵,不仅解除了产物的反馈抑制,还有效降低了副产物质量浓度以及最终产量,为后期发酵下游提取提供了便利,增大了L-缬氨酸提取收率。如表2所示,透析前后发酵糖酸转化率由32%提高到34.5%,主产物产量增加,副产物产量降低,耗糖量也相应增加,罐内发酵液体积更接近初始装液量,稳定性增强。
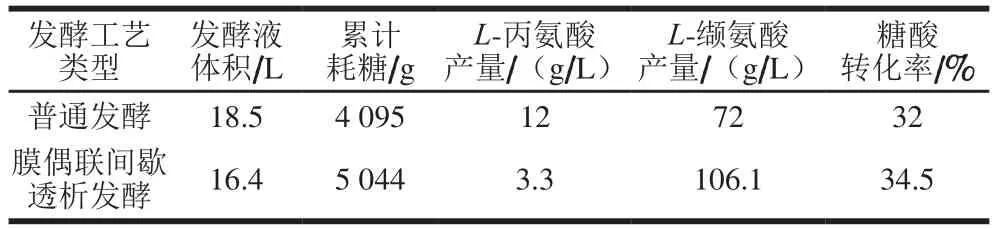
表2 不同发酵工艺类型基本参数对比Table 2 Comparison of fermentation parameters under different fermentation modes
3 讨 论
生物素对发酵生产L-缬氨酸产量影响是通过控制其细胞膜合成量以及细胞转型时期控制L-缬氨酸胞外含量,生物素小分子在参与羧化作用时,能够结合羧基,参与菌体内固定CO2的羧化反应;作为乙酰辅酶A羧基酶的成分在脂肪酸的合成中起重要作用,进而影响了磷脂的合成,最终决定细胞膜的合成量[24-27]。在菌体量少而生物素相对较多的发酵前期,对于发酵罐内的生产菌,生物素属于过量状态,此时,菌体在这种环境下大量增长,当菌体量增长到一定量时,罐内的生物素含量对于大量菌体处于亚适量的状态,在生物素不足的情况下,菌体生长速度减缓,细胞膜合成变弱,细菌进入转型阶段,新产生菌体的细胞膜因缺少生物素而生长不完全,封闭性减弱,通透性增强,截留能力减弱,胞内外物质交换能力增强,菌体内生成的大量L-缬氨酸分泌至胞外,解除了菌体内L-缬氨酸的反馈抑制作用,L-缬氨酸进入快速发酵合成时期。当生物素添加量过少时,菌体生长所必需的生物素量不足,导致菌体生长速度减缓,且转型期提前,转型之后的菌体产酸速率较高,但是生长缓慢,导致总菌体量过低,进而导致总产酸过低;当生物素添加量过多时,菌体生长增殖速度加快,转型期滞后,前期产酸低,且发酵中后期菌体转型不完全,从而造成中后期产酸速率减弱、L-缬氨酸总产量降低的结果。
杨毅等[28]探究了生物素与VB1的添加量在谷氨酸棒杆菌过量合成L-缬氨酸中对碳骨架代谢流分布的影响,尤其是对丙酮酸节点处的代谢流分布的影响,研究提出,谷氨酸棒杆菌在添加生物素时促进了丙酮酸的羧化,从而使丙酮酸更多地流入糖异生途径,减少L-缬氨酸的产量。本实验使用的菌株XV0505(Leu-+Ile-+2-TAr+α-ABr+SGr)在进行生物素不同梯度实验对比之后发现,增大生物素添加量后,菌体生物量的确有所增长,但是副产物L-丙氨酸含量增长更为明显,因此在利用谷氨酸棒杆菌XV0505(Leu-+Ile-+2-TAr+α-ABr+SGr)发酵生产L-缬氨酸时,造成L-缬氨酸产量下降的主要原因是丙酮酸节点流量过多地流向丙氨酸途径,从而减弱了L-缬氨酸途径,使产酸减少。因此,如果能够从代谢改造的途径对菌种XV0505(Leu-+Ile-+2-TAr+α-ABr+SGr)的丙氨酸合成途径进行干扰或者削弱,丙酮酸节点流向L-缬氨酸的途径势必有所增加,从而进一步提高L-缬氨酸产量,然而,代谢改造的途径周期漫长,且改造所得菌株生长产酸皆会受到不同程度的影响,短时间内无法获得合适的生产菌株解决发酵生产中副产物L-丙氨酸过高的问题,而采用在线膜偶联间歇透析发酵工艺能够直接有效地减少L-丙氨酸的生成,最终发酵液中L-丙氨酸质量浓度保持在3 g/L左右,相较之前的12 g/L降了75%左右,是行之有效的解决方式。
4 结 论
生物素的外源添加对于菌体细胞自身的生长与产酸必不可少,本研究通过对生物素添加量进行梯度控制,确定了谷氨酸棒杆菌发酵生产L-缬氨酸过程中最适的生物素添加量。实验表明,当生物素添加量为50 μg/L时,经过52 h的发酵,L-缬氨酸产量达到72 g/L,糖酸转化率达到32%;在线膜偶联间歇透析发酵对于发酵液中主要产物的反馈抑制解除以及副产物的去除具有非常明显的效果,较透析之前,透析后的L-缬氨酸总产量提高了47.4%,转化率提高了2.5%,同时副产物L-丙氨酸产量下降了75%。目前,膜偶联间歇透析发酵还存在一些有待改进的方面,例如每次从罐中透析出的体积控制精度较差,透析膜中的循环液体积有残留,如果能够对微滤膜进行一些改进,解决上述问题,可进一步提高生产效益。

