硫酸亚铁和硫酸锰对苍白杆菌产生物表面活性剂的影响
刘记成,司伟民,孙玉梅
(大连工业大学 生物工程学院,辽宁 大连 116034)
培养基中的Fe2+、Mn2+、Mg2+等微量金属离子是微生物在发酵过程中维持正常生长必不可少的营养因子,它们以辅基或辅酶的形式参与微生物体中某些酶的合成,对微生物新陈代谢起着重要的调节作用[1]。目前国内外对影响生物表面活性剂发酵的研究主要集中在芽孢杆菌属(Bacillussp.)、不动杆菌属(Acinetobactersp.)和假单胞菌属(Pseu domonas),对苍白杆菌(Ochrobactrumsp.)产生物表面活性剂的研究尚不深入。相关研究表明,5 mmol/L FeSO4和0.01 mmol/L MnSO4可分别将枯草芽孢杆菌的脂肽类生物表面活性剂提高9倍和8倍[2-3],0.04 mmol/L Mn2+可促进Bacillus subtilisATCC 22214大量生长,其糖脂类生物表面活性剂产量是不添加Mn2+产量的2倍[4]。不同金属之间还存在协同作用,MnSO4、MgSO4和FeSO4可共同作用提高枯草芽孢杆菌的脂肽类生物表面活性剂和铜绿假单胞菌的糖脂类生物表面活性剂产量,其效果优于单一金属离子[5-7]。
苍白杆菌(Ochrobactrum)可产脂肽类生物表面活性剂,具有低毒、无污染和界面活性高的特性,主要应用于石油开采、环境治理和化妆品等工业领域[8-9]。有研究表明,首次报道能产脂肽类生物表面活性剂的苍白杆菌是从油藏产出液中筛出的,产物中脂肪酸和氨基酸的组成与目前报道的枯草芽孢杆菌、地衣芽孢杆菌及短短芽孢杆菌产生的生物表面活性素组成相同[8]。苍白杆菌CN3产生的脂肽类生物表面活性剂表现出高的热稳定性和对极端盐度和pH的耐受性,发酵上清液对环己烷、正己烷和废机油的乳化活性高达65%~86%[10]。由苍白杆菌MTCC 5720产生的4-二甲基氨基苯甲醛可将水的表面张力由72 mN/m降低至35 mN/m,对十六烷、正己烷和甲苯等乳化活性良好[11]。
国内外目前关于Fe2+和Mn2+促产生物表面活性剂与相关酶的活性尚无关联研究,同时谷氨酰胺合成酶是无机氮同化过程中的关键酶,Mn2+为其辅因子[12],谷草转氨酶在三羧酸循环和糖异生代谢中起着重要作用,Fe2+对其有很好的激活作用[13],本研究通过向培养基中添加不同浓度的FeSO4和MnSO4并测定发酵过程中菌体生长和生物表面活性剂产量等指标,考察FeSO4和MnSO4对苍白杆菌发酵产生物表面活性剂的影响,并通过酶活性与生物表面活性剂生成的关联,判断Fe2+和Mn2+对生物表面活性剂合成的影响本质,以期为高产生物表面活性剂的发酵条件控制提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
苍白杆菌(Ochrobactrumsp.):由大连工业大学微生物资源与生物催化重点实验室分离,在-80℃条件下保存于20%甘油中。
1.1.2 化学试剂
蛋白胨、牛肉膏、酵母浸粉(均为生化试剂):北京奥博星生物技术责任有限公司;硝酸钠、磷酸二氢钾、柠檬酸三铁、硫酸亚铁、硫酸锰、苯酚、3,5-二硝基水杨酸、葡萄糖(均为分析纯):天津市天河化学试剂厂。
1.1.3 培养基
斜面培养基:牛肉膏5 g/L,蛋白胨10 g/L,氯化钠5 g/L,琼脂20 g/L;调pH 至7.0。
种子培养基:牛肉膏5 g/L,蛋白胨10 g/L,氯化钠5 g/L;调pH至7.0。
发酵培养基:蔗糖10 g/L,磷酸氢钾3.4 g/L,磷酸氢钠1.5 g/L,硝酸钠4 g/L,酵母浸粉0.2 g/L;调pH至7.0。
上述培养基均于115 ℃条件灭菌30 min。
1.2 仪器与设备
PHS-3C型精密pH计、722S型分光光度计:上海精密科学仪器有限公司;JZY-180界面张力仪:河北省承德市材料试验机厂;DNP电热恒温培养箱:上海金宏实验设备有限公司;BS-ZF振荡培养箱:金坛市杰瑞尔电器有限公司。
1.3 方法
1.3.1 菌种活化与培养
取一环于-80 ℃保存的Ochrobactrumsp.接种于斜面培养基,30 ℃培养48 h后,4 ℃保存备用;取一环保存的菌种接于新的斜面培养基上,在30 ℃培养48 h后,得活化菌种;取2环活化后的菌体接种于100 mL种子培养基中,在30 ℃、160 r/min摇床培养48 h,得种子液。
1.3.2 MnSO4和FeSO4对菌体产生物表面活性剂的影响
将MnSO4添加于发酵培养基中,使MnSO4终浓度分别为0.1 mmol/L、0.2 mmol/L、0.3 mmol/L、0.4 mmol/L。将FeSO4添加于发酵培养基中,使FeSO4终浓度分别为0.1 mmol/L、0.2 mmol/L、0.3 mmol/L、0.4 mmol/L;不添加MnSO4和FeSO4为空白对照组,以8%接种量将种子液接于上述培养基中,在30 ℃、160 r/min摇床培养7 d,按时取样并测量相关指标,研究MnSO4和FeSO4对生物表面活性剂合成的影响。
1.3.3 测定方法
菌体密度:采用比浊法[14]。以发酵上清液为空白,在波长600 nm处测定发酵液光密度OD600nm值。
糖含量:采用苯酚-硫酸法测定发酵液总糖含量[15]。采用3,5-二硝基水杨酸法测定发酵液还原糖含量[16]。
谷氨酰胺合成酶活性[17]:将细胞用10 mL提取缓冲液重悬破碎,于4 ℃、3 000 r/min离心5 min,取上清(粗酶液)。将反应液(1.6 mL)、粗酶液(0.7 mL)和三磷酸腺苷(adenosine triphosphate,ATP)溶液(0.7 mL)混匀,于30 ℃条件下水浴保温0.5h,加入显色剂1 mL,摇匀,静置5min;于4 ℃、2 000 r/min离心5 min,取上清测定波长540nm处的光密度值。谷氨酰胺合成酶活力的定义:在30 ℃条件下,上清液OD540nm值每小时增加0.01为一个酶活力单位(U/mg)。
谷草转氨酶活性[18]:将细胞用10 mL提取缓冲液重悬破碎,4 ℃条件下3 000 r/min离心5 min,取上清(粗酶液)。将反应液(0.5 mL)和粗酶液(0.1 mL)混匀,于30 ℃条件下水浴1 h;再加0.5 mL 2,4-二硝基苯肼,于30 ℃条件下水浴20 min。取出后再加5 mL 0.4 mol/L 氢氧化钠,反应10 min后测定波长500 nm处的光密度值。谷草转氨酶活力的定义:在30 ℃条件下,上清液OD500nm值每小时增加0.01为一个酶活力单位(U/mg)。
生物表面活性剂含量测定:采用亚甲基蓝法[19]。取2 mL样品于分液漏斗,滴加酚酞混匀;逐滴滴加1 mol/L氢氧化钠至溶液为桃红色,再滴加0.5 mol/L硫酸至刚好无色,最后加1 mL亚甲基蓝和4 mL二氯甲烷,静置分层后取有机相;将有机相和2 mL洗涤液混匀静置分层后取有机相,重复洗涤2次后,收集有机相测定光密度值。以OD652nm值为纵坐标(y),以十二烷基磺酸钠(sodium dodecyl sulfonate,SDS)标准品含量(μg/mL)为横坐标(x)制作标准曲线,线性回归方程为y=0.082 4x+0.003 2,R2=0.996 9。
2 结果与分析
2.1 MnSO4对菌体生长和生物表面活性剂产生的影响
不同MnSO4浓度条件下菌体的生长及代谢变化见图1。由图1(a)可知,菌体在对照组和添加0.1~0.4 mmol/L MnSO4发酵组分别在发酵2 d、4 d、6 d、6 d和7 d达最大生长。最大生长量依次为0.4 mmol/L>对照组>0.3 mmol/L>0.1 mmol/L和0.2 mmol/L,说明加入较高浓度MnSO4(0.4 mmol/L)会明显促进菌体平稳生长。这与朱玲燕等[20]对Bacillus subtilisBS-37进行MnSO4优化的结果一致。
由图1(b)和图1(c)可知,所有发酵组均在发酵1 d达最大pH,随后有不同幅度升降。在发酵前4 d,添加0.1 mmol/L和0.2 mmol/L MnSO4的发酵组pH变化幅度与对照组基本一致,随后比对照组变化平稳。添加0.3 mmol/L和0.4 mmol/L MnSO4的发酵组在整个发酵期间的pH变化幅度均高于对照组。可见,低浓度MnSO4有助于发酵液pH平稳变化。
由图1(d)可知,在发酵过程中,添加0.3 mmol/L MnSO4的发酵组耗糖速度低于其他发酵组。由图1(e)可知,添加0.4 mmol/L MnSO4的发酵组在发酵前4 d耗糖速度高于对照组,并在发酵4 d耗糖量与对照组持平,随后耗糖速度低于对照组。添加0.1 mmol/L和0.2 mmol/L MnSO4的发酵组在发酵前6 d耗糖速度高于对照组,随后对照组耗糖速度加快并在发酵终点耗糖量高于所有发酵组。可见,高浓度MnSO4会抑制菌体耗糖,低浓度MnSO4会促进菌体耗糖。
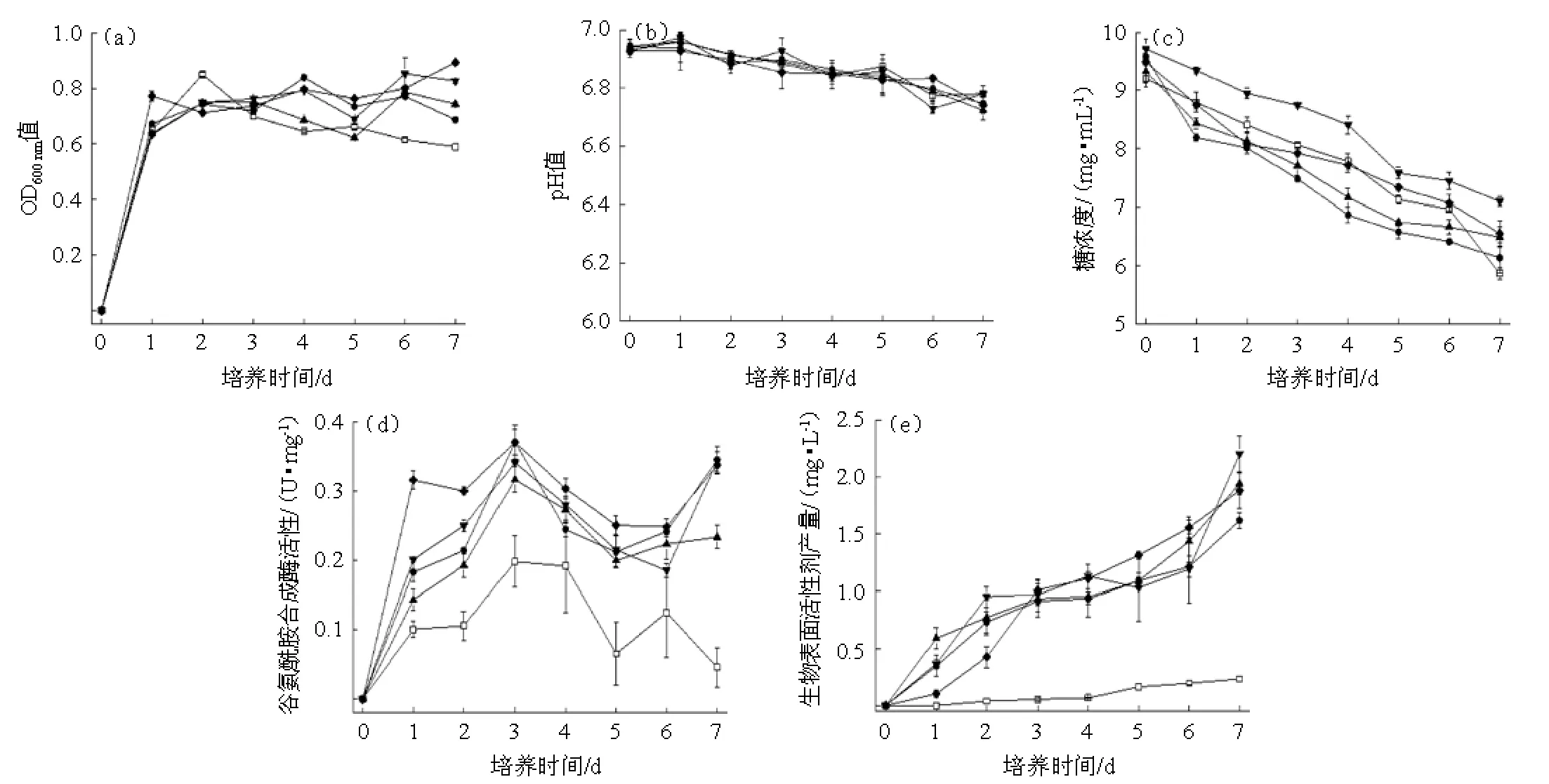
图1 在不同MnSO4浓度下发酵的菌体生长(a)、培养pH值(b)、糖浓度(c)、谷氨酰胺合成酶活(d)及生物表面活性剂含量(e)Fig.1 Cell growth (a),culture pH (b),sugar content (c),glutamine synthase activity (d) and biosurfactant content (e) under different concentrations of MnSO4during fermentation
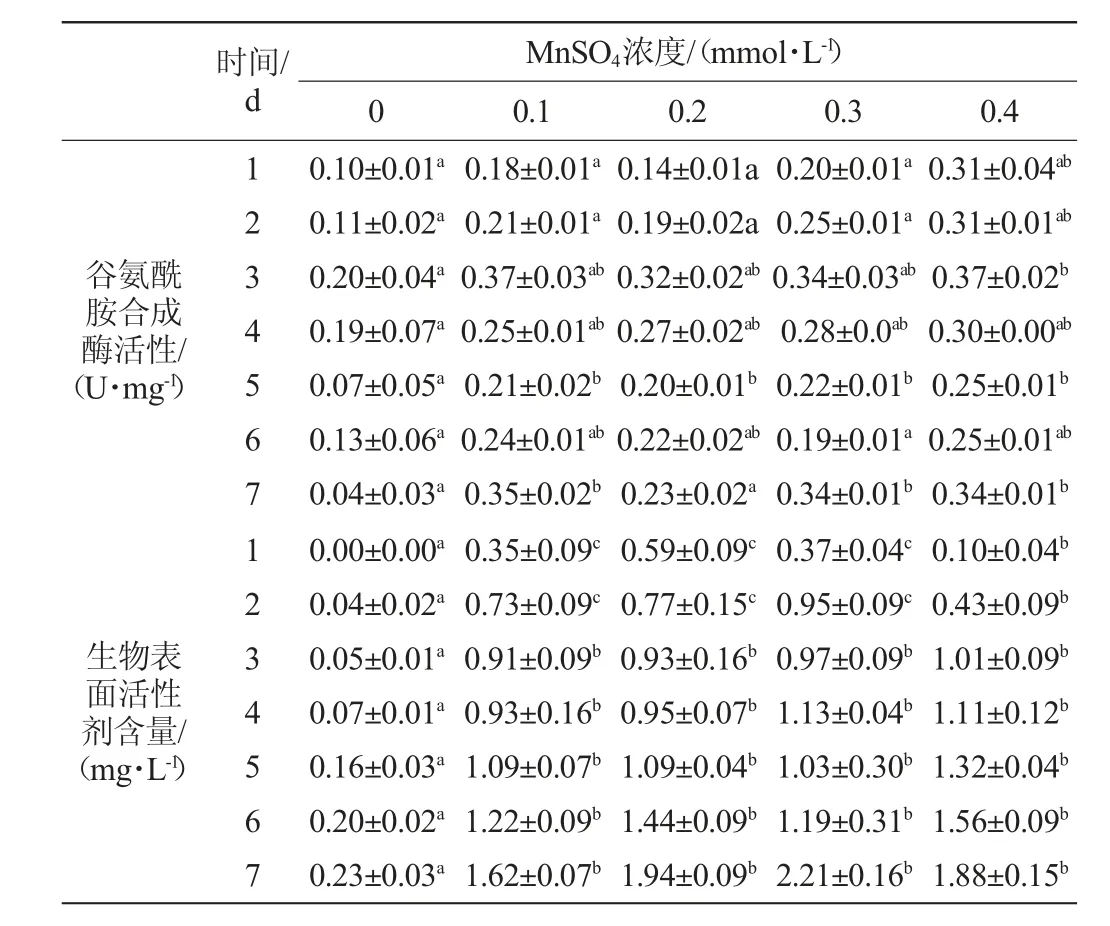
表1 不同浓度MnSO4对谷氨酰胺合成酶活性及生物表面活性剂产量的差异显著性分析Table 1 Significant analysis on the differences of glutamine synthase activity and biosurfactant yield at different MnSO4concentrations
由图1(d)、图1(e)和表1可知,加入MnSO4的发酵组酶活性比对照组高。其中添加0.4 mmol/L MnSO4的发酵组谷氨酰胺合成酶活性与对照组均有明显差异(P<0.05)。所有发酵组的生物表面活性剂产量均在发酵7 d达最大值,且加入MnSO4的发酵组生物表面活性剂增加量高于对照组。其中添加0.3 mmol/L MnSO4的发酵组在发酵结束时生物表面活性剂含量最大,但与添加其他浓度MnSO4的发酵组无明显差异(P>0.05)。生物表面活性剂的生成与谷氨酰胺合成酶活性变化一致,在发酵前3 d,加入MnSO4的发酵组酶活性快速升高,其生物表面活性剂含量增加较快;在发酵3~6 d,加入MnSO4的发酵组酶活性降低,其生物表面活性剂含量增长缓慢;在发酵6~7 d,加入0.1 mmol/L、0.3 mmol/L和0.4 mmol/L MnSO4的发酵组酶活性升高,而生物表面活性剂含量开始快速增加。可见,MnSO4可显著提高谷氨酰胺合成酶的活性并促进菌体发酵产生物表面活性剂(P<0.05)[10]。
综上所述,MnSO4有利于菌体生长,并且可以提高谷氨酰胺合成酶活性同时促进生物表面活性剂生成。高浓度MnSO4抑制菌体耗糖,而低浓度MnSO4促进菌体耗糖,其中添加0.3 mmol/L MnSO4以最低耗糖量达最大生物表面活性剂含量。因此,0.3 mmol/L MnSO4更适合生物表面活性剂的合成。
2.2 FeSO4对菌体生长和生物表面活性剂产生的影响
不同FeSO4浓度条件下菌体的生长及代谢变化见图2。
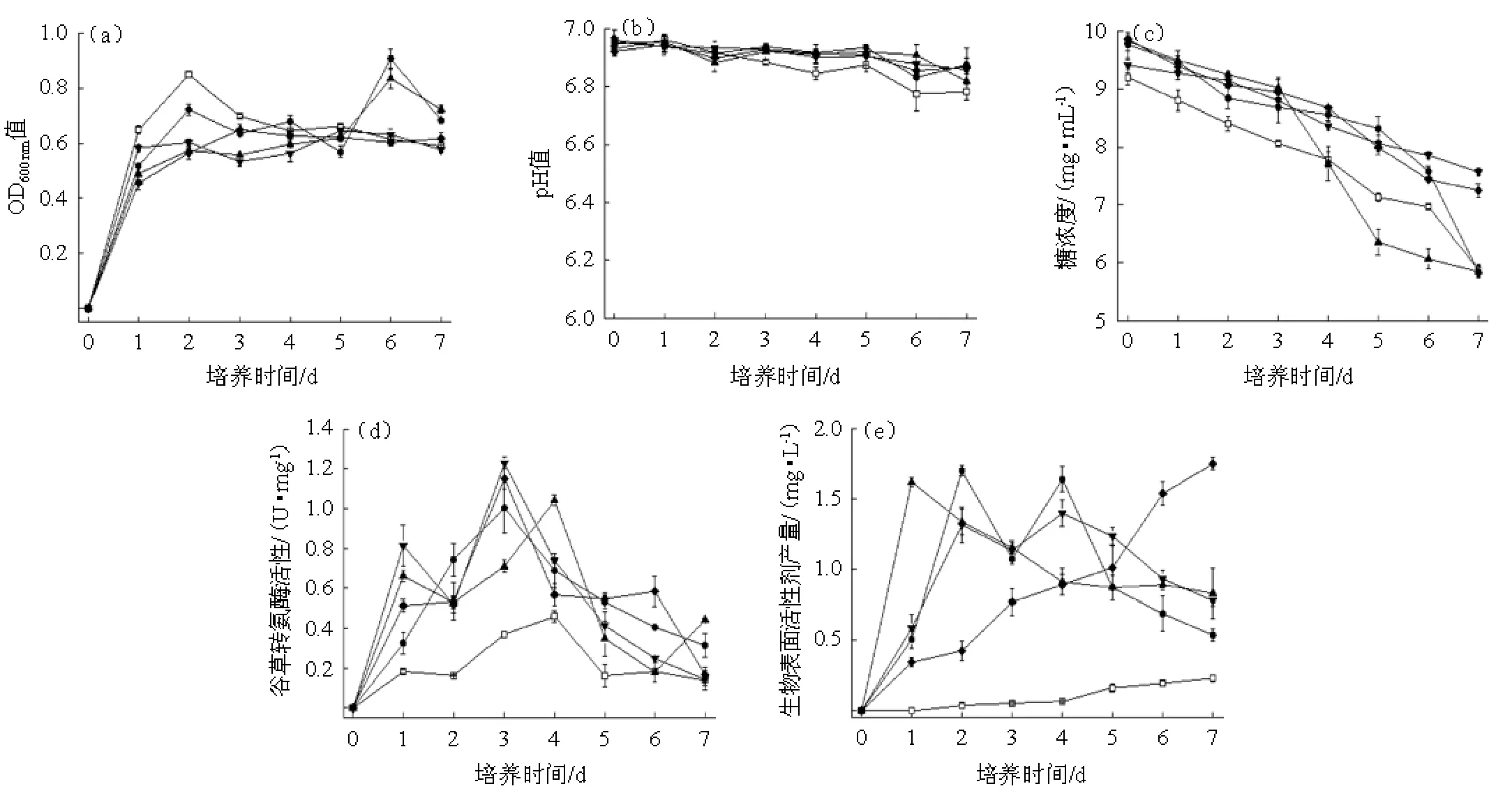
图2 在不同FeSO4浓度下发酵的菌体生长(a)、培养pH值(b)、糖浓度(c)、谷草转氨酶酶活(d)及生物表面活性剂含量(e)Fig.2 Cell growth (a),culture pH (b),sugar content (c),glutamic-oxaloacetic transaminase activity (d) and biological surfactant content (e) under different concentrations of FeSO4during fermentation
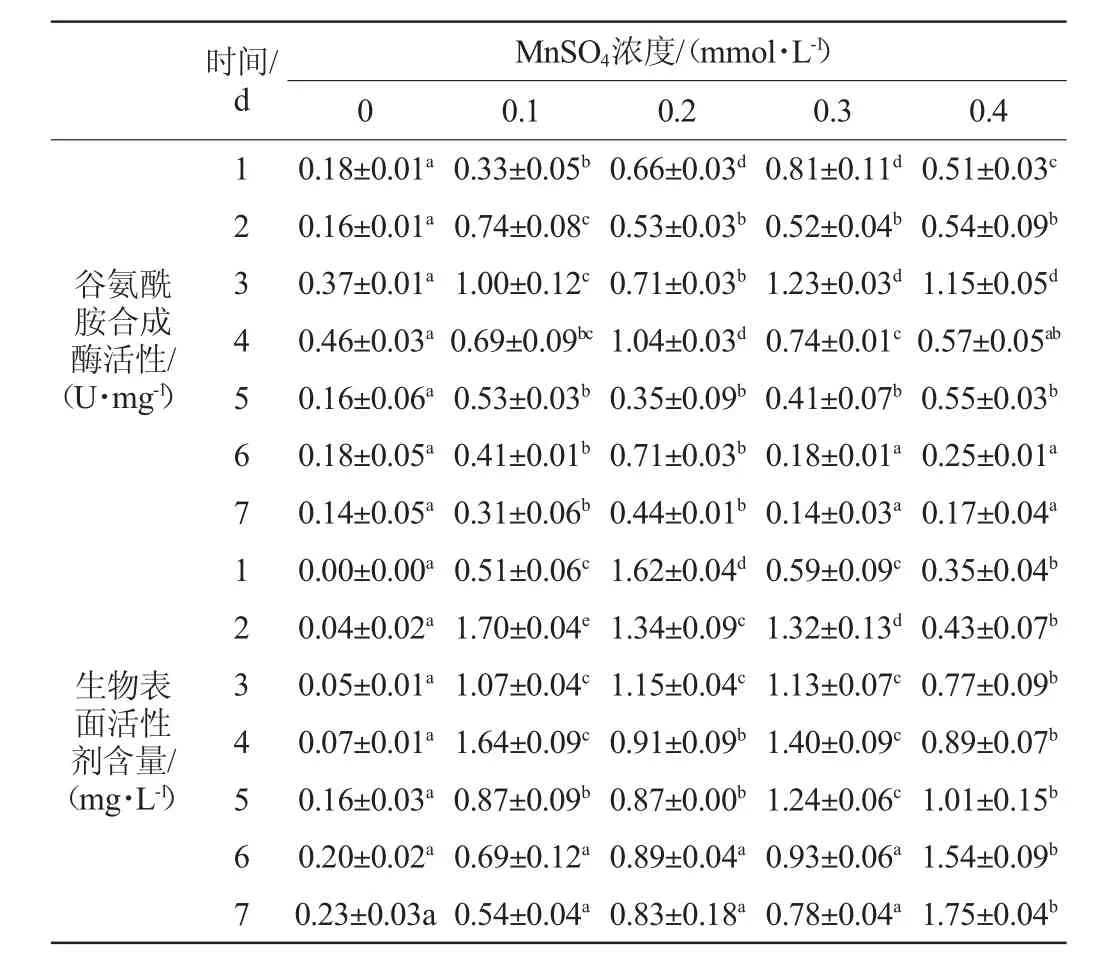
表2 不同浓度FeSO4对谷草转氨酶活性及生物表面活性剂产量的影响Table 2 Effects of different FeSO4concentrations on glutamicoxaloacetic transaminase activity and biosurfactant productivity
由图2(a)可知,菌体在对照组和添加0.1~0.4 mmol/L FeSO4发酵组分别在发酵2 d、6 d、6 d、5 d和3 d达最大生长,最大生长量依次为0.1 mmol/L>对照组>0.2 mmol/L>0.3 mmol/L>0.4 mmol/L,说明加入低剂量FeSO4会促进菌体快速大量生长,而高剂量FeSO4对菌体生长有抑制作用。添加0.3 mmol/L和0.4 mmol/L FeSO4的发酵组菌体生长平稳程度优于其他发酵组。可见,低浓度FeSO4有助于菌体大量生长,而高浓度FeSO4有助于菌体平稳生长。
由图2(b)可知,在发酵过程中添加0.1~0.4 mmol/L FeSO4的发酵组pH变化幅度小于对照组,其中添加0.3mmol/L和0.4 mmol/L FeSO4的发酵组pH变化更稳定。可见,FeSO4有助于稳定发酵液pH,且FeSO4浓度越高pH变化越稳定。这与WEI Y H等[21]用0~10 mmol/L FeSO4优化Bacillus subtilisATCC 21332时的现象一致。
由图2(c)可知,在发酵前3 d所有发酵组耗糖速度基本一致,添加FeSO4的发酵组还原糖浓度高于对照组。随后添加0.1 mmol/L和0.2 mmol/L FeSO4发酵组的耗糖速度快于对照组,并在发酵终点耗糖量基本一致。而添加0.3 mmol/L和0.4 mmol/L FeSO4发酵组的耗糖速度基本不变,在整个发酵过程中,还原糖浓度始终高于对照组。可见,添加0.1~0.4mmol/LFeSO4能抑制菌体耗糖,添加量越大,耗糖量越少。
由图2(d)和表2可知,在发酵过程中,所有发酵组的谷草转氨酶活性均有提高,其中加入FeSO4的发酵组高于对照组。添加0.1 mmol/L和0.2 mmol/L FeSO4的发酵组分别在发酵3 d和4 d达最大酶活,添加0.3 mmol/L和0.4 mmol/L FeSO4的发酵组在发酵3 d达最大酶活并高于加入0.1 mmol/L和0.2 mmol/L FeSO4的发酵组,并在发酵3 d和4 d不同浓度的酶活均有明显差异(P<0.05)。可见,添加FeSO4可提高谷草转氨酶的酶活。低浓度FeSO4有助于酶活平稳变化,但对酶活提升幅度较小;高浓度FeSO4可快速大幅度提高酶活,但酶活平稳程度较差。
由图2(e)和表3可知,加入FeSO4发酵组的生物表面活性剂含量比対照度高,添加0.1mmol/L、0.2mmol/L和0.3mmol/L FeSO4发酵组的生物表面活性剂含量分别在发酵2 d、1 d和4 d达到最高,随后有不同程度升降,降低的原因可能是生成的生物表面活性剂被菌体利用或分解。而添加0.4 mmol/L FeSO4发酵组的发酵全过程生物表面活性剂含量稳定增加,且在发酵终点高于其他发酵组,并有明显差异(P<0.05)。可见,添加0.1~0.4 mmol/L FeSO4可以促进菌体生成生物表面活性剂,随着FeSO4浓度升高,产物生成的稳定性提高,终产量增大,但生成速度降低。
综上所述,添加0.1~0.4 mmol/L FeSO4可以有效提高谷氨酰胺合成酶活性以及生物表面活性剂产量。且高浓度FeSO4的菌体生长、发酵液pH变化以及生物表面活性剂产量均较低浓度FeSO4发酵的效果平稳。其中加入0.4 mmol/L FeSO4可达最大生物表面活性含量。因此,0.4 mmol/L FeSO4更适用于生物表面活性剂的合成。
3 结论
添加不同浓度MnSO4(0.1~0.4 mmol/L)有助于提高谷氨酰胺合成酶活性和生物表面活性剂产量,添加0.3 mmol/L MnSO4比对照的耗糖量减少9.3%,菌体生长和发酵液pH变化较平稳,生物表面活性剂产量(2.21 mg/L)提高8.6倍。添加不同浓度的FeSO4(0.1~0.4 mmol/L)可提高谷草转氨酶活性和生物表面活性剂产量,添加0.4 mmol/L FeSO4比对照的耗糖量低,并在菌体生长和发酵液pH平稳变化的前提下生物表面活性剂积累快速且产量(1.75 mg/L)提高了7.5倍。本研究可为苍白杆菌发酵产生物表面活性剂的条件优化控制提供参考。

