灯盏花乙素磷脂复合物固体分散体的离体小肠吸收研究*
周威, 薛雨晨, 贺智勇, 肖婷, 姜丰, 周雪, 吴林菁, 沈祥春, 陶玲
(贵州医科大学 药用植物功效与利用国家重点实验室,贵州省天然药物资源高效利用工程中心,贵州省普通高等学校天然药物药理与成药性评价特色重点实验室,贵州医科大学-贵阳市联合重点实验室,天然药物资源优效利用重点实验室, 贵州医科大学 药学院, 贵州 贵阳 550025)
灯盏花乙素(scutellarin,DZ)又名野黄芩苷及5, 6, 4’-三羟基黄酮-7-O-葡萄糖醛酸苷,是从菊科植物飞蓬属短葶飞蓬(erigeronbreviscapusHand. -Mazz)的干燥全草灯盏细辛中提取分离得到的黄酮类化合物[1]。DZ具有散寒解表、舒筋活络、活血化瘀等作用,临床上主要用于治疗缺血性心脑血管疾病,如脑栓塞、心绞痛和心肌梗塞等[2-3]。但是DZ的水溶性和脂溶性均不佳,Beagle犬口服后的生物利用度仅为(0.40±0.19)%[4]。因此,DZ的理化性质和药动学性质严重限制了其普通片剂、颗粒剂等血管外给药剂型的吸收,注射剂、注射粉针剂又具有病人顺应性差的特性,使其临床疗效难以充分发挥[5]。磷脂复合物(phospholipid complex,PC)是指在非质子传递体系溶剂中,药物与磷脂以一定的配比关系结合而成的复合物[6-8],既可以增强水溶性药物的脂溶性,也可以增强脂溶性药物的水溶性,从而改善药物的膜渗透性,使药物在胃肠道中的吸收增加,提高其生物利用度和疗效。固体分散体(solid dispersion,SD)是指将药物高度分散于固体载体中形成的一种以固体形式存在的分散系统[9-10],如果药物以分子或者无定型状态高度分散于载体中可以提高药物的释放度,因此制备成固体分散体是提高药物溶出度最常用的方法之一[9-10]。聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)和聚乙二醇(polyethylene glycol,PEG)是常用的水溶性载体,被广泛用于制备固体分散体[5]。本课题组前期研究以复合率为指标,对DZ缓释微球制备工艺进行了优化[11];本次研究以DZ累积释放百分率为考察指标,通过单因素试验优选灯盏花乙素磷脂复合物固体分散体(solid dispersion of scutellarin phospholipid complex,DZ-PC-SD)处方和制备工艺,并进行小肠吸收研究,旨在为改善DZ口服制剂吸收提供参考。
1 材料与方法
1.1 实验动物、主要药品、试剂及仪器
1.1.1实验动物 SPF级SD大鼠24只,雌雄兼用,体质量(240±20)g,由贵州医科大学实验动物中心提供,合格证号SCXK(黔)2012-0001。实验动物饲养于实验室动物房,光照黑暗时间各为12 h,室温(25±5)℃。
1.1.2主要药品与试剂 DZ-PC和DZ-PC-SD系本实验室自制,DZ对照品(批号110842-201207, 中国食品药品检定研究院),DZ原料药(批号BN022201311251,纯度95%,上海一基生物科技有限公司)。注射用大豆磷脂(批号20140702,磷脂酰胆碱含量≥90%,上海太伟药业有限公司)。聚乙烯吡咯烷酮K17 (polyvinylpyrrolidone K17,PVPK17,批号20151106,密森科技有限公司),聚乙烯吡咯烷酮K30 (polyvinylpyrrolidone K30,PVPK30,批号20151123,密森科技有限公司),聚乙二醇6 000(批号Q/STXH 339-2011,分子质量6 000~9 000 Da, 西陇化工股份有限公司)。
1.1.3仪器 SHZ-88型水浴恒温振荡器(金坛医疗仪器厂),SQG-4型四腔器官浴槽系统(成都仪器厂),HH-601超级恒温水浴锅(金坛环宇科学仪器厂),08-2G型恒温磁力搅拌器(上海梅颖浦仪器仪表制造有限公司),AF2型吉印超静音增氧气泵(杭州吉印智能科技有限公司),UV-5800PC型紫外分光光度计(上海元析仪器有限公司)。
1.2 方法
1.2.1DZ含量测定方法的建立 精密吸取对照品储备液0.3、0.5、1.0、1.5、2.0及2.5 mL,置于25 mL量瓶中,加参考文献配制的Tyrode缓冲液[12-13],定容至刻度,配成系列浓度分别为2.4、4.0、8.0、12.0、16.0及20.0 mg/L的对照品试液。根据最大吸收波长考察结果,以Tyrode缓冲液作为空白试剂,于334 nm的波长处测定吸光度(A),绘制A-C标准曲线,考察精密度、稳定性及回收率。
1.2.2DZ-PC-SD制备 根据文献及本实验室前期实验考察结果[11,14-15],称取适量DZ、DZ-PC或DZ-PC-SD置入透析袋中,加0.01 mol/L (pH 6.8)的PBS溶液(含0.02%叠氮钠)1 mL;将透析袋放入含PBS溶液离心管中,在37 ℃恒温水浴振荡器中振摇(转速100 r/min),分别在5~240 min取出样品溶液,于334 nm处测定吸光度(A)。计算DZ累积释放百分率,绘制溶出度曲线, 依次考察DZ-PC与PVPK17、PVPK30、PEG6000载体材料及其投药比, 二氯甲烷-乙醇的不同配比、溶剂体积对DZ-PC-SD制备的影响。
1.2.3大鼠离体肠吸收试验 采用离体外翻肠囊法, 将SD大鼠随机分成 DZ组、DZ-PC组、DZ-PC-SD(PEG6000)组及DZ-PC-SD(PVPK17)组,每组6只。大鼠禁食12 h后断颈处死开腹,剪取大鼠十二指肠、空肠、回肠各肠段冲洗、翻转后的肠段结扎成小囊,在37 ℃四腔器官浴槽、供氧下依次考察DZ、DZ-PC、DZ-PC-SD(PEG6000)和DZ-PC-SD(PVPK17)的离体肠吸收情况。分别于15、30、45、60、90及120 min从肠囊内取样0.5 mL,同时补充等体积Tyrode缓冲液。置于5 mL量瓶中定容,续滤液在334 nm处测定A,计算DZ肠囊累积吸收量(Q)。将药物的累积吸收量Q对时间t作相关回归分析,求药物肠吸收速率常数(Ka), 根据决定系数(r2)判定曲线的拟合情况[11]。
1.3 统计学分析
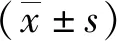
2 结果
2.1 DZ含量测定方法验证
2.1.1体外释放DZ含量测定方法验证 根据实验室前期研究结果[12],以PBS作为空白试剂,DZ在2.4~24.0 mg/L范围内线性关系良好,回归方程为A=0.053C-0.005 9,r=0.999 7。精密度RSD0.2%,稳定性RSD0.5%~1.3%,重复性RSD0.4%~0.9%,回收率99.6%~101.5%,RSD1.1%。
2.1.2离体肠吸收DZ含量测定方法验证 在2.4~20.0 mg/L范围内, 拟合得到DZ线性回归方程为A=0.045 1C+0.024 7(r=0.999 9)。12 mg/L的DZ对照品溶液,RSD为0.22%;16、12、8 mg/L的供试品Tyrode溶液日内RSD为1.85%,日间RSD为1.44%;用空白肠液分别配制16、12及8 mg/L的供试品溶液得到高、中及低3个浓度样品的回收率范围98.86%~100.65%,平均回收率99.58%,RSD为1.44 %。
2.2 DZ-PC-SD
2.2.1DZ-PC 基于实验考察前期数据,本次DZ-PC的最佳制备工艺确定为DZ ∶PC为1 ∶3,水浴温度为35 ℃,DZ投药量600 mg,反应时间2.5 h,制备多批DZ-PC制剂,平均复合率为(98.72±0.42)%,RSD< 5.0%。
2.2.2载体材料、溶剂种类和溶剂体积的影响 实验结果表明当DZ-PC ∶PVPK17 为1 ∶1时,DZ在240 min内的累积释放率接近100%;当DZ-PC ∶PEG6000为1 ∶2时,其累积释放率接近100% ;二氯甲烷 ∶乙醇为1 ∶0时,DZ在240 min内的累积释放百分率最大;当溶剂体积为10 mL、240 min时,其中 DZ累积释放百分率为100%。综上,选择旋转蒸发溶剂DZ-PC ∶PEG6000为1 ∶2时水浴温度40 ℃、二氯甲烷10 mL制备DZ-PC-SD。见图1、图2。
2.2.3验证试验 根据上述考察结果,确定DZ-PC-SD的最佳制备工艺是DZ-PC ∶PEG6000为1 ∶2,二氯甲烷为10 mL,旋转蒸发溶剂时水浴的温度40 ℃,按照最佳工艺制得的3批DZ-PC-SD(PEG6000), 它们在240 min时间内的平均累积释放率达到(99.35±1.14)%,RSD<5.0%。
2.3 大鼠离体肠吸收实验
随着药物在肠道内作用时间的持续(给药45 min之后), 十二指肠不断增加对DZ的吸收,成为各DZ制剂中DZ的主要吸收肠段,然后是回肠、空肠,见表1;DZ、DZ-PC、DZ-PC-SD(PEG6000)和DZ-PC-SD(PVPK17)在不同肠段的吸收均符合零级吸收动力学模型,r2介于0.906 2~0.995 1,不管是单一DZ成分,还是不同DZ制剂,DZ在十二指肠中的吸收都优先考虑零级吸收动力学模型(r20.980 4~0.995 1),其次为一级动力学模型,见表2;与DZ比较,DZ-PC、DZ-PC-SD(PEG6000)及DZ-PC-SD(PVPK17)在各个肠段的Ka差异均有高度统计学意义(P<0.01),可见DZ在不同肠段的总体吸收趋势为:十二指肠>空肠>回肠。其中以DZ-PC-SD(PEG6000)在十二指肠的吸收最强,Ka最高,与DZ比较,差异有统计学意义(P<0.01),见表3。
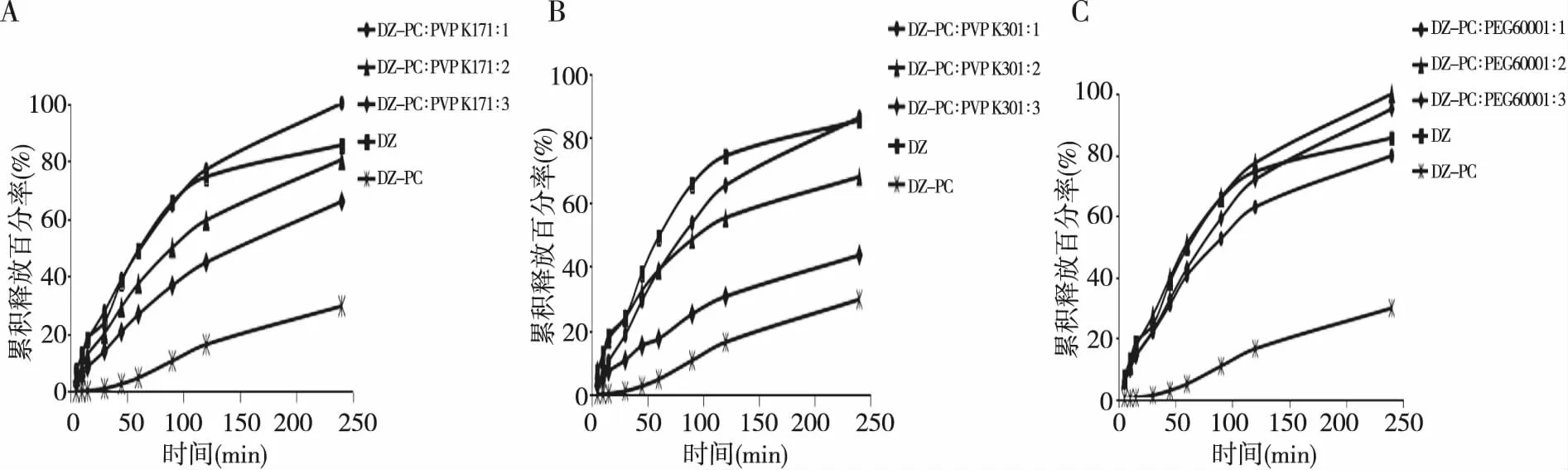
注:A为DZ-PC ∶PVPK17,B为DZ-PC ∶PVPK30,C为DZ-PC ∶PEG6000。图1 不同载体的DZ-PC-SD释放曲线Fig.1 DZ-PC-SD release curves of different carriers

注:A为溶剂种类,B为溶剂体积,C为水浴温度。图2 常规制备因素对DZ-PC-SD释放曲线的影响Fig.2 Effect of conventional preparation factors on DZ-PC-SD release curve

表1 DZ、DZ-PC、DZ-PC-SD(PEG6000)及DZ-PC-SD(PVPK17)在不同肠段的累积吸收量Tab.1 Cumulative absorption of DZ,DZ-PC,DZ-PC-SD(PEG6000) and DZ-PC-SD(PVPK17) in different intestinal segments

表2 DZ、DZ-PC、DZ-PC-SD(PEG6000)及DZ-PC-SD(PVPK17)在不同肠段累积吸收量的线性回归方程Tab.2 Linear regression equation of cumulative absorption DZ,DZ-PC,DZ-PC-SD(PEG6000) and DZ-PC-SD(PVPK17) in different intestinal segments
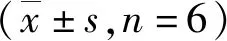
表3 DZ、DZ-PC、DZ-PC-SD(PEG6000)及DZ-PC-SD(PVPK17)在小肠的吸收速率常数Tab.3 DZ,DZ-PC,DZ-PC-SD(PEG6000) and DZ-PC-SD(PVPK17) absorption rate constant in the small intestine
注:(1)与DZ比较,P<0.01。
3 讨论
DZ水溶性差, 口服生物利用度低严重限制了其临床应用, 本研究基于磷脂复合物、固体分散体制剂的优点,尝试DZ-PC-SD的制备。以DZ体外累积释放百分率为指标,通过单因素试验优选了DZ-PC-SD的最佳处方和工艺,借用经典溶剂法制备DZ-PC-SD,着重考察了不同类型载体材料、溶剂和溶剂体积用量对DZ-PC-SD制备的影响[5]。本研究结果表明,水溶性载体材料PEG6000能够明显增加DZ-PC-SD的体外释放度, 随着该载体比例增加,DZ累积释放率先增大后减小,有理由推断是载体比例增加到一定程度以后,阻碍了DZ-PC-SD药物释放速率。本次实验发现,溶剂挥发水浴温度(30~58 ℃)对体外累积释放百分率的影响不大,建议选择旋转蒸发溶剂时水浴的温度为40 ℃为宜。在各蒸发时水浴温度下,240 min DZ累积释放率均接近100%。确定DZ-PC-SD(PEG6000)优于其他DZ-PC-SD制剂,该DZ-PC-SD(PEG6000)的最佳制备工艺是DZ-PC ∶PEG6000为1 ∶2,二氯甲烷为10 mL,240 min时间内的平均累积释放率达到(99.35±1.14)%,RSD< 5.0%。实验考察数据表明本次优化的DZ-PC-SD制备工艺稳定、重现性良好, 值得推广应用在灯盏花乙素现代制剂开发中。
围绕制备的的DZ-PC、DZ-PC-SD, 进一步开展药物肠吸收实验, 能够更加全面考察和评价不同DZ制剂。本次采用的离体外翻肠囊法是在体外培养小肠肠环技术和刷状缘膜囊技术的基础上发展而来的,将实验大鼠的小肠取出,将所需十二指肠、空肠和回肠肠段分割出来,外翻使肠黏膜向外,结扎一端形成肠囊状。根据囊内外被测物质的变化来反应肠道对物质吸收状况的一种生理学试验方法。该方法保留了肠囊组织的完整性,能避免肠道吸收或者水分对灌流液的影响,便于了解不同药物制剂在不同肠道吸收部位的吸收特征, 指导后续药物剂型的优化开发。本次大鼠小肠离体吸收实验结果显示,与原料药DZ相比,DZ-PC、DZ-PC-SD在各肠段的吸收差异有高度统计学意义(P<0.01),这可能与DZ-PC、DZ-PC-SD对DZ亲脂性的提高有关。PC与细胞膜结构相似,具有细胞亲和力,与药物结合后,能够增强DZ与肠壁细胞的亲和力,使DZ更易透过肠壁细胞膜,从而提高了DZ-PC、DZ-PC-SD制剂中DZ在各吸收部位的渗透能力,进而提高DZ的肠吸收速度[13,15-17]。
本次研究将DZ-PC进一步开发制备成DZ-PC-SD(PEG6000)后,该制剂在大鼠十二指肠的吸收速率常数Ka比DZ-PC更高,为后者的1.54倍,这可能是DZ-PC-SD可明显增加DZ-PC的分散,使DZ-PC-SD(PEG6000)制剂中DZ-PC在比表面积方面更大,使得其DZ吸收显著增多。肠吸收实验结果表明,本次研究成功制备了新型DZ-PC-SD(PEG6000)制剂,该制剂工艺简单、重复性好, 能够很好改善DZ自身水溶性差, 口服生物利用度低的不足[18]。本研究将磷脂复合物与固体分散体相结合对于改善亲水亲油均比较差的口服制剂吸收具有良好的借鉴意义。
与此同时, 本研究还建立了围绕DZ的DZ、DZ-PC和DZ-PC-SD制剂中DZ的一般含量测定方法,以及这类DZ药物制剂在离体肠吸收实验中含有DZ生物样品的DZ含量分析方法。对该两种光谱分析方法进行了方法学考察,分别是:(1)一般制剂的DZ体外含量测定方法的精密度和稳定性RSD<1.3%, 回收率99.6%~101.5%;(2)离体肠吸收生物样品DZ含量分析方法的精密度和稳定性RSD<1.85%, 回收率98.86%~100.65%。方法学考察数据表明这两种分析方法的精密度、稳定性、重复性、回收率均符合方法学考察要求, 该分析方法专属性较好、分析效率高、重复性好、结果准确, 适用于大批量DZ制剂与生物样品的高通量分析。
综上所述,本次研究采用溶剂法成功开展了DZ-PC-SD的制备研究,制备工艺简便、稳定、可靠,DZ-PC和DZ-PC-SD均能有效增加灯盏花乙素在离体肠道的吸收,以DZ-PC-SD(PEG6000)为最佳,证明了DZ-PC-SD制剂工艺的科学性和正确性[19-21];建立的一般体外DZ含量测定、肠吸收DZ生物样品中DZ浓度检测方法经济、省时、准确、实用,值得推广应用。

