人肠道来源大肠杆菌β-半乳糖苷酶基因突变株的构建*
洪伟,赵行行,吴昌学**,饶凤琴,程玉梅,张婷,齐晓岚,禹文峰,官志忠
(1.贵州医科大学 地方病与少数民族疾病教育部重点实验室&贵州省分子生物学重点实验室,贵州 贵阳 550004;2.贵州医科大学附院 ICU,贵州 贵阳 550004)
嗜热二型内含子是高温下(48~60 ℃)可在基因组中跳跃的可动基因元件[1]。嗜热二型内含子基因失活系统(Thermotargetron)由来源于Thermosynechococcuselongatus的TeI3c/4c嗜热二型内含子和内含子编码蛋白(intron-encoded protein, IEP)构成,IEP具有将RNA逆转录为DNA的逆转录酶活性[2-5]。TeI3c/4c二型内含子通过“归巢(Retrohoming)”效应靶向跳跃至基因组中“AAnnnnnnnnnnnnnA”位点(n为A、T、G及C任意碱基),“归巢”由TeI3c/4c嗜热二型内含子与IEP组成的核糖核蛋白复合体介导。在中温梭菌中,基于LactococcuslactisLl.LtrB内含子被开发为ClosTron基因失活工具,广泛应用于中温菌的基因失活[6-10]。与中温ClosTron系统使用IEP和LactococcuslactisLl.LtrB内含子共同识别靶DNA序列不同,TeI3c/4c二型内含子仅通过TeI3c/4c内含子RNA识别靶DNA序列,DNA解链依赖高温自发完成[1]。这一特点使得Thermotargetron在靶向短开放阅读框和非编码RNA时具有优势。更重要的是,在ClosTron系统中,由于Ll.LtrB二型内含子需要使用诱导型启动子控制其表达量,从而降低其脱靶的可能性[11-15]。然而,建立化学诱导表达系统(如乳糖诱导启动子和脱水四环素诱导启动子)本身对于某些中温微生物比较困难,且表达强度不易控制。相比化学诱导而言,物理诱导(如温度和光)更加简单和精确。Thermotargetron系统在中温环境中不具有“归巢”活性,随着温度的提高,“归巢”活性逐渐提高。因此,在可短暂耐高温的中温微生物中,Thermotargetron系统可通过精确控制在特定高温条件下的保温时间来控制Thermotargetron的基因打靶活力,从而提高打靶精确度。因此,本研究使用Thermotargetron系统构建人肠道来源(中温菌)大肠杆菌lacZ基因失活突变株,建立中温菌温度诱导型基因失活工具,报道如下。
1 材料与方法
1.1 菌株与其培养条件
菌株与质粒见表1及表2,基因失活实验在来源于白喉病人肠道的大肠杆菌(E.coli)HSM174(DE3)菌株中进行。New England BioLabs express (NEB express) 大肠杆菌感受态细胞用于基因克隆和载体构建,E.coli在Luria-Bertani(LB)培养基中培养,转化子筛选时加入氯霉素(Chl,6 mg/L)。大肠杆菌37 ℃有氧培养,液体培养时摇床转速200 r/min;筛选半乳糖苷酶(β-galactosidase,LacZ)突变株时,固体培养基(琼脂糖浓度1.5 %)中加入终浓度500 mmol/L 5-溴-4-氯-3-吲哚-β -半乳糖苷(X-gal)和异丙基-β-D-硫代半乳糖苷以建立蓝白斑筛选体系。
1.2 方法
1.2.1Thermotargetron靶位点寻找及突变引物设计 从National Center for Biotechnology Information(NCBI)数据库中获得E.coliHSM174(DE3)菌株LacZ基因序列。(1)在基因组寻找符合“AAnnnnnnnnnnnnnA”的序列,3’端A位点为TeI3c/4c二型内含子插入位点,定义为+1位,插入位点在基因中的位置(起始密码子ATG中的A为+1位,正义链为“s”,反义链为“a”);(2)插入位点下游1核苷酸(nt)位定义为+2,上游1 nt位定义为-1;(3)-1到-6位为IBS1(intron binding site);(4)-8到-13位为IBS2;(5)+1位为IBS3;(6)设计通用引物(TeI3cUNI),突变引物1(xxxxIBS12),突变引物2(xxxxEBS2s)、突变引物3(xxxxEBS1a)及突变野生型TeI3c/4c二型内含子IBS2和IBS1位点引物(PCR产物长357 bp),使其与寻找到的靶位点互补配对(即相互识别);与IBS1、IBS2及IBS3互补的识别序列分别为EBS1(exon binding site)、EBS2及EBS3。
1.2.2质粒构建 在基因打靶载体构建过程中,所有的PCR反应都使用高保真DNA聚合酶(Phanta HS Super-Fidelity DNA Polymerase,诺唯赞,南京,中国),所有的DNA片段连接均采用NEBuilder®HiFi DNA Assembly Master Mix (NEB)试剂盒进行[16],线性化质粒载体酶BsiWI-HF及SpeI-HF均采购于NEB,并按说明书进行酶切反应。pHK-TT1A质粒作为lacZ基因打靶载体的构建构建的“母版”[1],具体为BsiWI,SpeI双酶切、线性化pHK-TT1A质粒。突变引物1-通用引物扩增获得EBS1(Exon binding site)、EBS2突变的PCR片段1,突变引物2-突变引物3扩增获得IBS1(intron binding site)、IBS2突变的PCR片段2,重叠PCR连接PCR片段1和2,获得PCR片段3,PCR片段3与线性化的pHK-TT1A质粒重组为基因打靶质粒;基因打靶质粒经测序验证后,电转化E.coliHSM174(DE3)菌株。
1.2.3Thermotargetron失活lacZ基因 Thermotargetron打靶质粒电转化E.coliHSM174(DE3)菌株,转化物涂布于氯霉素抗性LB培养基中(LB-Chl),筛选具有氯霉素抗性的转化子(37 ℃),转化子接种到LB-Chl培养基中,200 r/min培养过夜;取50 μL过夜培养物转接至5 mL LB-Chl培养基中,37 ℃保温1 h;此后,培养物转接至48 ℃水浴中1 h诱导TeI3c/4c“归巢”活性。诱导培养物,梯度稀释后涂布于LB-Chl固体培养基上(1.5 %琼脂,含500 mmol/L X-gal),37 ℃过夜培养后,挑取白斑检测lacZ基因是否失活[1]。另外,热激1 h后的培养物也涂布在仅含有氯霉素不含有X-gal的平板上,随机挑取20个克隆,以计算基因失活效率,基因失活效率=(突变株数量/20×100%)。
1.2.4丢失打靶质粒 突变株连续在无抗生素的LB培养基中传代10次后,划线至LB固体培养基中分离单菌落。使用影印平板法,即用无菌牙签挑取单菌落点到LB-Chl抗性平板上,并同时点到无抗性LB平板上,两块平板置于37 ℃过夜培养后观察两块平板上的菌落形成情况。挑起在Chl抗性平板上不生长,在无抗性平板上生长的菌落,接种到5 mL液体LB培养基中培养,培养液加入15%终浓度的甘油-80 ℃保存。
2 结果
2.1 E. coli HSM174 lacZ 基因打靶位点设计
E.coliHSM174lacZ基因(ECHMS174_00351)全长3 075 bp,在lacZ基因中5′-AAcgccatcaaaaatA-3′(426a)、5′-AAcggaactggaaaaA-3′(1 879a)、5′-AAa-cggaactggaaaA-3′(1 880a)及5′-AAgcagaacaactttA-3′(1 155s)四个位点符合TeI3c/4c识别规律(图1A)。使用引物突变野生型TeI3c/4c IBS1、IBS2、EBS1及EBS2位点(图1B),构建针对lacZ基因426a,1 879a,1 880a和1 155s四个识别位点的打靶质粒pHK-TT1A-lacZ426a、pHK-TT1A-lacZ1879a、pHK-TT1A-lacZ1880a及pHK-TT1A-lacZ1155s(图1)。
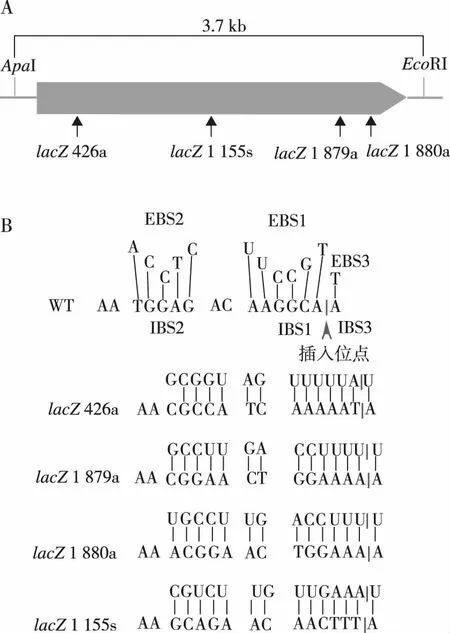
注:A为打靶位点在lacZ基因中的分布,B为打靶识别位点碱基组成特征。图1 lacZ的特征及打靶位点在lacZ中的分布Fig.1 The characteristics of lacZ and distribution of shooting sites in lacZ
2.2 E. coli HSM174 lacZ 基因敲除载体的构建
野生型TeI3c/4c的IBS1、IBS2、EBS1及EBS2位点的突变需要4条引物(图2A)。pHK-TT1A-lacZ426a载体的构建过程如下:首先,使用lacZ426aIBS12-Tel3cUNV引物突变野生型TeI3c/4c IBS1及IBS2位点(突变片段1),lacZ426aEBS2s-lacZ426aEBS1a引物突变野生型TeI3c/4c EBS1及EBS2位点(突变片段2),获得2段携带突变位点PCR产物(图2B);以突变片段1和突变片段2作为模板,lacZ426aIBS12-lacZ426aEBS1a为引物,重叠PCR连接2段突变片段,获得完整的靶位点识别序列。靶位点识别序列长357 bp(图2C),两端携带SpeI,BsiWI酶切位点,与被相同限制性内切酶线性化的pHK-TT1A载体重组连接,获得pHK-TT1A-lacZ426a打靶载体(图2D)。pHK-TT1A-lacZ1879a,pHK-TT1A-lacZ1880a和pHK-TT1A-lacZ1155s载体使用相同方法构建(表1~表3)。
2.3 lacZ基因敲突变株鉴定
pHK-TT1A-lacZ426a、pHK-TT1A-lacZ1879a、pHK-TT1A-lacZ1880a及pHK-TT1A-lacZ1155s载体转化E.coliHSM174感受态细胞,转化效率=104CFU/μg DNA。转化子在LB-Chl的平板上(添加X-gal)形成白色和蓝色的克隆(图3A, 图3B)。使用lacZ基因外侧引物(DPlacZ-F/R)检测白色克隆,突变株因TeI3c/4c插入,PCR检测产物分子量比野生型大(WT=3176 bp vs mutant=3 976 bp,图3C),白色克隆lacZ失活率为100%(图3C)。为了计算突变效率,转化子被涂布在LB-Chl平板上,随机挑选20个转化子克隆(培养基中不加入X-gal)检测lacZ基因是否插入失活。结果显示pHK-TT1A-lacZ426a、pHK-TT1A-lacZ1879a、pHK-TT1A-lacZ1880a及pHK-TT1A-lacZ1155s打靶载体的基因失活效率分别为60%、75%、60%和75%(表4)。

注:A为野生型TeI3c/4c所需IBS1、IBS2、EBS1及EBS2位点的突变需要4条引物位置示意图,B为含突变片段1及突变片段2携带的突变位点的PCR产物,C为重叠PCR连接突变片段1及突变片段2后获得的完整靶位点识别序列,D为获得的pHK-TT1A-lacZ426a打靶载体示意图。图2 E. coli HSM174 lacZ 基因敲除载体的构建Fig.2 Construction of E. coli HSM174 lacZ knockout vecto

表1 菌株序列(特征)及来源Tab.1 Strain sequence (characteristics) and its origin

表2 质粒序列(特征)及来源Tab.2 Plasmid sequence (characteristics) and its origin

表3 引物序列(特征)及来源Tab.3 Sequence (characteristics) and Source of primers
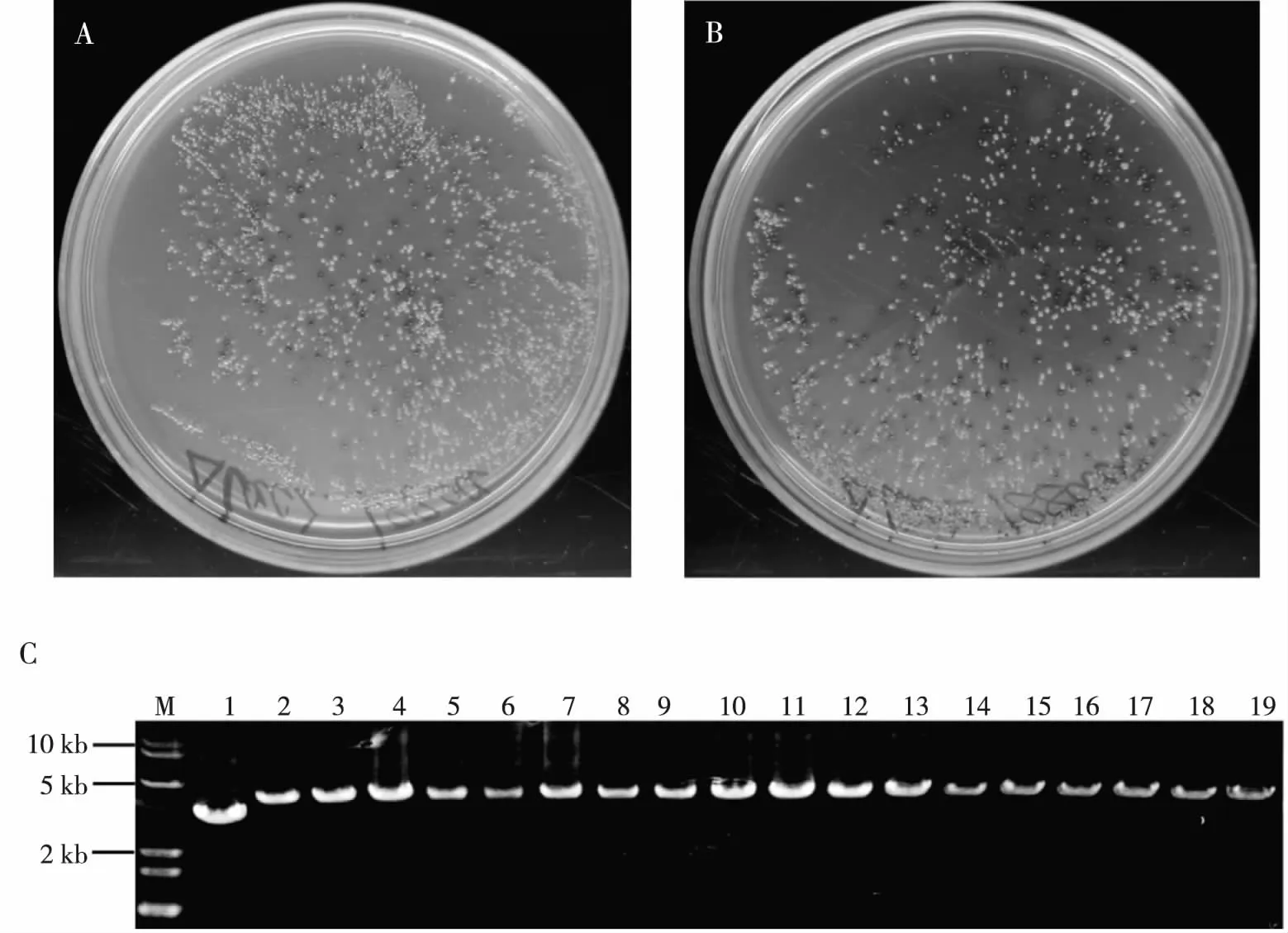
注:A、B为转化子在LB-Chl的平板上(添加X-gal)形成的白色及蓝色的克隆(菌落),C为白色克隆中突变株因TeI3c/4c插入片段的PCR检测结果。图3 蓝白斑及PCR筛选lacZ基因突变株Fig.3 Screening of lacZ Gene Mutants by Blue and White spot and PCR
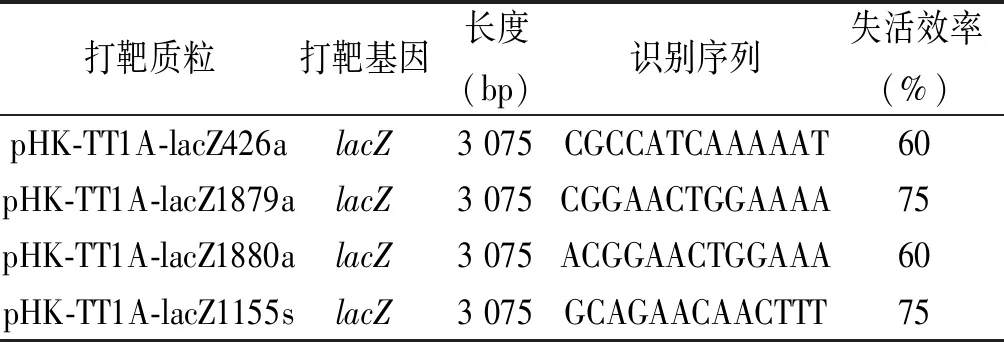
表4 Thermotargetron失活lacZ基因Tab.4 Thermoargtron-inactivated lacZ gene
3 讨论
基于L1.LtrB的ClosTron是在中温革兰氏阳性和阴性微生物中广泛使用的基因失活工具[17],这些微生物包括E.coli,Salmonellatyphimurium,Shigellaflexneri[8],Lactococcuslactis[18],Clostridiumspp[19],Staphylococcusaureus[20]Pseudomonasspp和Agrobacteriumtumefaciens[20],Bacillusanthracis[21]和Listeriamonocytogenes[22]等。基于TeI3c/4c的Thermotargetron系统是ClosTron系统的很好补充,解决了ClosTron不能在嗜热微生物中应用的缺陷[1]。不仅如此,对于诱导表达系统不完善,且可以短暂耐受高温的中温微生物,Thermotargetron具有独特的优势:(1)可以使用温度作为诱导条件,比化学诱导(如乳糖诱导启动子,脱水四环素诱导启动子)更加精确;(2)具有更低的脱靶可能性。本研究,使用人肠道来源的革兰阴性E.coliHSM174作为中温模式菌株,lacZ基因(易筛选)作为靶基因,使用Thermotargetron系统实现多位点(测试了4个位点)的高效的基因失活(失活效率60%~75%)。
常规商业化的大肠杆菌感受态细胞(如DH5α,BL21)其基因组中的lacZ基因α片段都已经被敲除,从而实现和载体上的lacZα片段实现互补[1]。本研究选用人肠道来源的E.coliHSM174菌株具有完整的lacZ基因,因此可以将X-gal转化为蓝色的产物。当TeI3c/4c二型内含子跳跃至lacZ基因内部的打靶位点,由于TeI3c/4c RNA内部具有很多终止密码子和颈环结构,故能终止lacZ基因转录产物翻译为蛋白质[1, 23],实现lacZ基因的失活。失活后的lacZ不能产生β-半乳糖苷酶,丧失将X-gal转化为蓝色产物的能力,故在平板上形成白斑。当挑取白斑检测突变时,实际上已经经历了一次突变株筛选,故突变率高达100%。然而,为了计算Thermotargetron针对lacZ基因的实际突变率,本研究重新将转化子涂布在不含有X-gal的LB平板,随机挑取20个克隆,计算得出实际基因失活效率为60%~75%。
应用Thermotargetron失活中温微生物基因,需要宿主细胞经历5~60 min不等的热激步骤(48 ℃),以诱导TeI3c/4c的归巢活性,从而达到失活基因的目的[24]。在热激过程中,微生物体内的应激反应系统会短暂激活[25],以应对条件变化。这种应激反应往往是可逆的[26]。在突变株的后续处理中,突变株在无抗性的LB培养基中37 ℃连续转接10次,lacZ426a、lacZ1879a、lacZ1880a及lacZ1155s的质粒丢失效率分别是50%、65%、40%及100%。此步骤有2个目的:(1)丢失突变株中的Thermotargetron打靶质粒;(2)使得突变株从热应激状态恢复为正常状态。
终上所述,本研究实现了Thermotargetron失活E.coliHSM174lacZ基因,验证了Thermotargetron在中温菌中的应用潜力,为中温微生物基因编辑提供了新的思路。

