异甘草素聚乳酸纳米粒的制备及在大鼠体内药动学*
高青,马记平
(郑州澍青医学高等专科学校基础医学部,郑州 450064)
异甘草素(isoliquiritigenin)是从中药材甘草中提取、分离得到的一种异黄酮类化合物,在肉豆蔻、板蓝根、红血藤等植物中也广泛存在。具有抗肿瘤、抗氧化、抗心律失常、抗炎、解痉等多种药理活性[1-2]。但异甘草素水溶性较差,影响了在医药领域的应用。 因此非常有必要采用制剂新技术对其进行研究,开发出活性更强、毒副作用更小的异甘草素新型制剂。目前已有脂质体、微乳等制剂的研究[3-5]。
纳米给药系统是指采用高分子材料作为载体,通过一定的制剂技术而制备成粒径在10~1000 nm之间的微粒[6]。可增加药物的溶解度及稳定性,促进体内药物吸收,实现被动靶向等。聚乳酸(polylactic acid,PLA)作为可生物降解的一种高分子材料,体内最终代谢为水和二氧化碳,被誉为“绿色材料”,已被美国食品药品管理局(FDA)批准用于医用材料和各种药物制剂的制备。王学清等[7]以上市产品新山地明(Neoral®)为参比制剂,对环孢素聚乳酸纳米粒在大鼠体内生物利用度进行了研究,结果发现两者生物利用度相似,但环孢素聚乳酸纳米粒采用了生物降解材料,与Neoral®比较避免了表面活性剂Gremophor RH40带来的毒性与变态反应。另外,根据不同药物不同的理化性质和药理作用,可通过调整聚乳酸相对分子质量的大小进而达到控制纳米粒释药速率的目的。邢洁等[8]采用分子质量相对较小的聚乳酸制备的冬凌草甲素聚乳酸纳米粒,体外释放速率明显加快,有助于快速达到较高的血药浓度,迅速发挥镇痛药效。戴东波等[9]采用分子质量相对较高的聚乳酸制备的盐酸阿霉素聚乳酸纳米粒,体外缓释特征非常明显,48 h内累积释放度为55.8%,体内药动学研究结果显示纳米粒在体内消除显著减缓,体内循环时间显著延长。本研究以聚乳酸为纳米载体,制备异甘草素聚乳酸纳米粒(isoliquiritigenin-loaded polylactic acid nanopartic-les),对粒径分布、Zeta电位、体外释药等进行研究。与异甘草素混悬液对比,研究异甘草素聚乳酸纳米粒体内药动学行为。为异甘草素研究、开发提供新的研究策略,也为其他难溶性中药活性成分提供参考[10]。
1 仪器、试药与动物
1.1实验仪器 高效液相色谱仪(安捷伦仪器公司,型号:Agilent 1260,二极管阵列检测器);电子天平(赛多利斯精密仪器北京有限公司,型号:SQP,感量:0.1 mg);涡旋混合器(其林贝尔仪器制造有限公司,型号:VORTEX-5);超声仪(宁波新知科仪器研究所,型号:JY92-II);粒度分析仪(马尔文科学仪器有限公司,型号:Master sizer 2000);氮气吹扫仪(杭州市奥威仪器有限公司,型号:MD202-3);高速台式冷冻离心机(北京时代北利离心机有限公司,型号:GTR22-1)。
1.2试药 异甘草素对照品(天津一方科技有限公司,批号:20160824,含量:98.8%);聚乳酸(山东岱罡科技有限公司,批号:2017021522,相对分子质量3000);poloxamer 188(F68,德国巴斯夫有限公司,批号:T20151205);甲醇(色谱级),其他试剂均为分析纯。
1.3实验动物 清洁级SD大鼠,雌雄兼用,体质量(300±20)g,购自河南省动物实验中心,实验动物生产许可证号:SCXK(豫)2016-0001。所有大鼠饲养在清洁级实验环境,温度20~24 ℃,湿度40%~55%。
2 方法与结果
2.1异甘草素含量测定色谱条件 色谱柱:Hypersil ODS C18(200 mm×4.6 mm,5 μm);流动相:甲醇-0.5%甲酸溶液(44:56);波长:372 nm;体积流量:1.0 mL·min-1;柱温:30 ℃;进样量:20 μL。
2.2异甘草素聚乳酸纳米粒包封率和载药量 取异甘草素聚乳酸纳米粒混悬液1.0 mL,18 000 r·min-1(r=15 cm)离心60 min后,小心吸取上清液液测定游离的异甘草素含量(W游离)。另取异甘草素聚乳酸纳米粒混悬液1.0 mL,加入甲醇超声破乳后,测定异甘草素总含量(W总)。计算异甘草素聚乳酸纳米粒包封率和载药量。
包封率(%)=(W总-W游离)/W总×100%;载药量(%)=(W总-W游离)/W总质量×100%。
其中W总为聚乳酸纳米粒中异甘草素总量;W游离为聚乳酸纳米粒混悬液游离异甘草素量;W总质量为聚乳酸纳米粒的总质量。
2.3异甘草素聚乳酸纳米粒制备工艺优化
2.3.1异甘草素聚乳酸纳米粒的制备工艺 精密称取异甘草素40 mg和适量聚乳酸溶于30 mL丙酮溶液中(经重蒸处理),搅拌、溶解后缓慢加入到一定体积、适量浓度的poloxamer 188乙醇-水相中。滴加完毕后,于冰浴中超声15 min。减压旋转蒸发除有机溶剂,浓缩。微孔滤膜滤过,即得异甘草素聚乳酸纳米粒。
2.3.2正交实验优化制备工艺 结合前期异甘草素聚乳酸纳米粒单因素实验考察情况,以包封率为考察指标,选择处方中聚乳酸载体用量(A,mg),表面活性剂poloxamer 188浓度(B,%),乙醇-水体积(C,mL),乙醇-水比例(D)4个因素为主要影响因素,每个因素设置3个考察水平,采用L9(34) 正交实验进一步优化异甘草素聚乳酸纳米粒的处方,因素水平和实验设计见表1。
表1 正交实验设计与结果
Tab.1Designandresultsoforthogonaltest
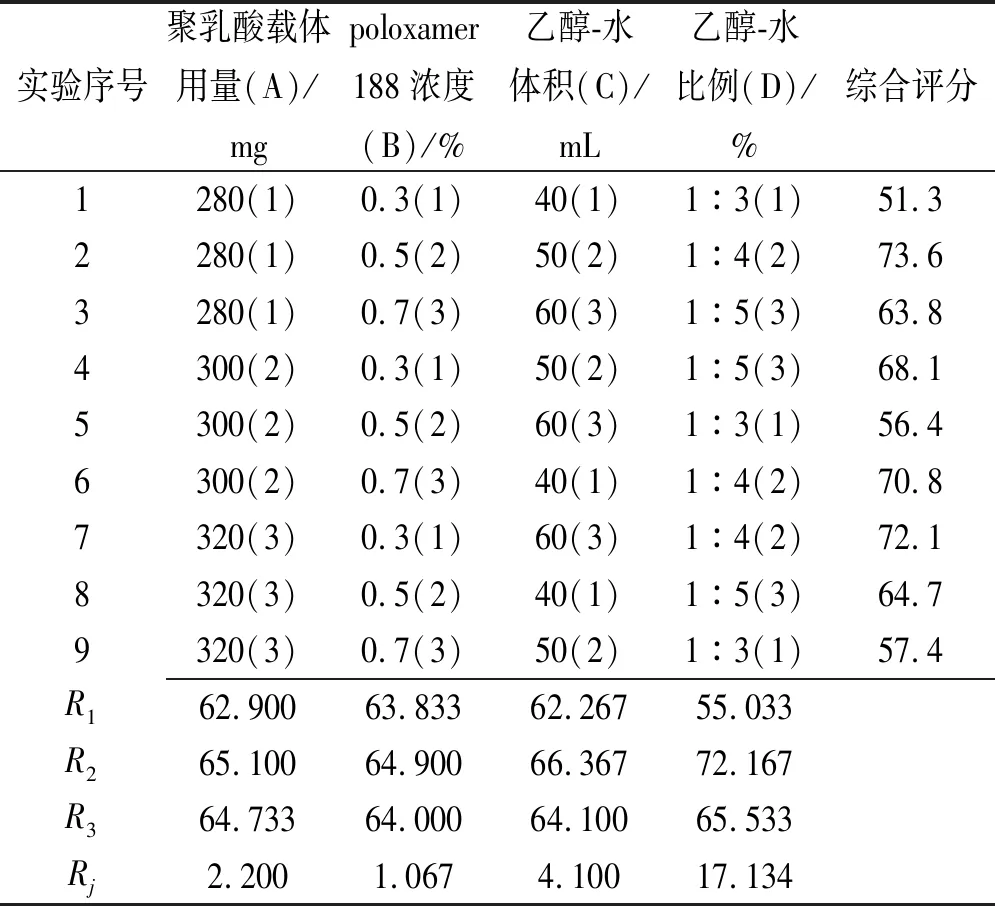
实验序号聚乳酸载体用量(A)/mgpoloxamer 188浓度(B)/%乙醇-水体积(C)/mL乙醇-水比例(D)/%综合评分1280(1)0.3(1)40(1)13(1)51.32280(1)0.5(2)50(2)14(2)73.63280(1)0.7(3)60(3)15(3)63.84300(2)0.3(1)50(2)15(3)68.15300(2)0.5(2)60(3)13(1)56.46300(2)0.7(3)40(1)14(2)70.87320(3)0.3(1)60(3)14(2)72.18320(3)0.5(2)40(1)15(3)64.79320(3)0.7(3)50(2)13(1)57.4R162.90063.83362.26755.033R265.10064.90066.36772.167R364.73364.00064.10065.533Rj2.2001.0674.10017.134
根据表1中极差Rj值,各因素对异甘草素聚乳酸纳米粒包封率影响大小顺序为D>C>A>B。根据Rn(n为1,2或3),最佳组合为A2B2C2D2,即聚乳酸用量为300 mg,poloxamer 188浓度为0.5%,乙醇-水体积为50 mL,乙醇-水比例为1:4。根据方差分析结果(表2),因素D即乙醇-水比例差异有统计学意义(P<0.01)。按照优化后的处方工艺制备3批异甘草素聚乳酸纳米粒,结果显示,包封率为(74.94±1.18)%。
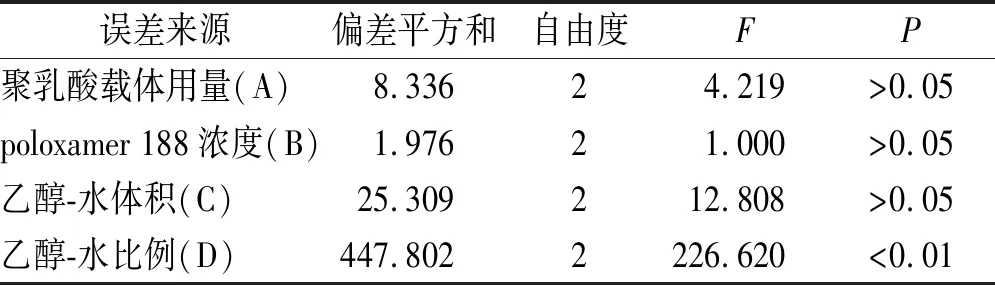
表2 方差分析结果
F0.05(2,2)=19.00;F0.01(2,2)=99.0。
2.4异甘草素聚乳酸纳米粒基本性质
2.4.1载药量、粒径分布及Zeta电位 按照“2.2”项下测定方法,测得异甘草素聚乳酸纳米粒载药量为(8.45±0.66)%。取异甘草素聚乳酸纳米粒混悬液,纯化水稀释,置于比色池中。测定聚乳酸纳米粒粒径和Zeta电位(图1,2)。测定结果显示,异甘草素聚乳酸纳米粒平均粒径为(190.22±3.09) nm,多分散性指数(polydispersity index,PDI)为0.149±0.039;Zeta电位为(-12.5±0.27) mV。
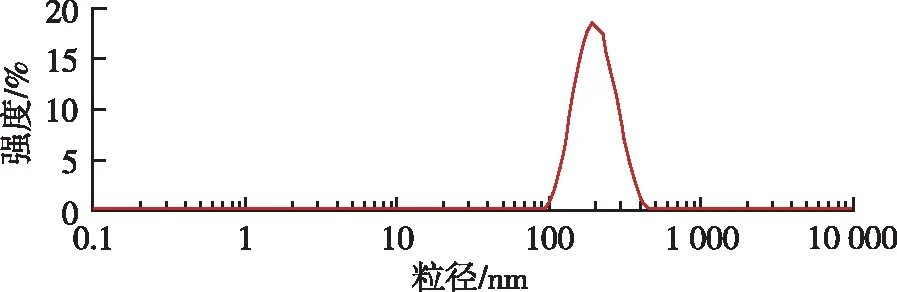
图1 异甘草素聚乳酸纳米粒的粒径分布
Fig.1Particlesizedistributionofisoliquiritigenin-loadedpolylacticacidnanoparticles
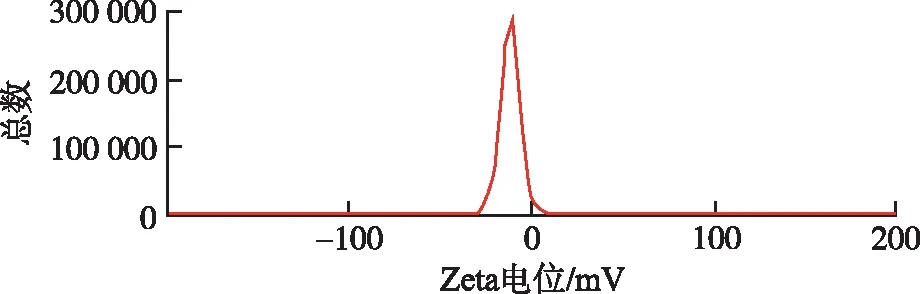
图2 异甘草素聚乳酸纳米粒的Zeta电位
Fig.2Zetapotentialofisoliquiritigenin-loadedpolylacticacidnanoparticles
2.4.2异甘草素聚乳酸纳米粒体外释药行为 取异甘草素原料药混悬液及其聚乳酸纳米粒混悬液2 mL,异甘草素含有量均为2 mg,置于经处理好的透析袋中,两端扎紧。避光操作,以 2.0%十二烷基硫酸钠溶液150 mL为溶出介质,转速设置为100 r·min-1,温度为(37±1)℃。分别在0,0.25,0.5,1,2,3,4,6,8,12,24,36和48 h取外液2.0 mL,及时补充2.0 mL的空白释放介质。测定各时间点的药物含量,并计算各时间点的累积释放度,绘制体外溶出曲线(图3)。由结果可知,将异甘草素制备成聚乳酸纳米粒后,体外释药具有明显的缓释释药特征。
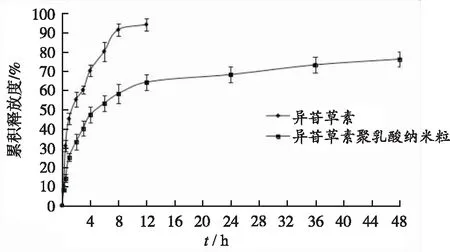
图3 异甘草素及其聚乳酸纳米粒的体外释放曲线(n=3)
Fig.3Invitroreleaseprofilesofisoliquiritigeninanditspolylacticacidnanoparticles(n=3)
2.4.3释药模型拟合 对异甘草素聚乳酸纳米粒体外释药分别采用零级、一级、Higuchi及Weibull模型进行拟合,研究发现(表3),制备的异甘草素聚乳酸纳米粒体外释药模型符合Weibull模型:LnLn[1/(1-Mt/M∞)]=0.519 4Lnt-1.391 9(r=0.972 8)。
表3 药物释放模型和相关系数
Tab.3Drugreleasemodelandcorrelationcoefficient

模型拟合方程R2零级模型Mt/M∞=0.021 1t+0.208 40.731 7一级模型Ln[1/(1-Mt/M∞)]=-0.049 8 t-0.251 10.914 6Higuchi模型Mt/M∞=0.139 9 t1/2+0.098 90.941 6Weibull模型LnLn[1/(1-Mt/M∞)]= 0.519 4Lnt-1.39190.972 8
Mt为t时间累积释放度;M∞为∞时累积释放度;Mt/M∞为t时间累积释放百分率;t为时间。
Mtis accumulative release at time t;M∞is accumulative release at time ∞;Mt/M∞is accumulative release percentage at timet;tis time.
2.5药动学研究
2.5.1血浆样品的处理 精密量取血浆样品100 μL和内标溶液50 μL置于具塞尖底离心管中,加入甲醇1.5 mL,以沉淀蛋白,涡旋混合4 min,8000 r·min-1离心15 min(r=7.7 cm)。转移上清液,40 ℃氮气吹干有机溶剂。残留物加入100 μL流动相复溶,8000 r·min-1离心10 min(r=7.7 cm),后进高效液相色谱仪测定药物含量[11-12]。
2.5.2对照品溶液的配制及标准曲线的绘制 配制浓度为10 μg·mL-1异甘草素对照品溶液,进一步稀释、配制浓度分别为50.0,100.0,250.0,500.0和1000.0 ng·mL-1的系列异甘草素的血浆样品。另精密配制浓度为200 ng·mL-1苯甲酸钠内标溶液。以异甘草素和苯甲酸钠峰面积比(Y)与异甘草素浓度(X)进行线性回归,得出线性回归方程为Y=0.060 7X+0.021 4(r=0.999 3)。由相关系数r可知,在50.0~1000.0 ng·mL-1浓度范围内线性关系良好。
2.5.3方法学验证 以异甘草素的低(50.0 ng·mL-1)、中(500.0 ng·mL-1)、高(1000.0 ng·mL-1)浓度考察日内精密度RSD值。结果显示RSD值分别为7.28%,4.36%和5.11%(n=3)。考察5 d的日间精密度,3种浓度RSD值分别为10.53%,6.80%和7.74%(n=3)。取大鼠空白血浆100 μL,分别配制低、中、高浓度的异甘草素血浆溶液,按“2.4.1”项下方法进行处理。由回归曲线求出测定浓度,与实际浓度比较。结果显示3种浓度的回收率分别为89.61%,93.57%和92.94%(n=3)。其中,3种浓度的RSD值<7.11%。任取一份血浆样品,置于-20 ℃冰箱中于5 d内反复融冻,高效液相色谱(HPLC)测定血药浓度变化,结果显示,血药浓度的变化差异无统计学意义(P>0.05)。因此,血浆样品5 d内反复融冻时稳定性较好。
2.5.4给药方案及样品采集 取SD大鼠随机分为2组,每组6只。实验室适应2 d,禁食,自由饮水。按60 mg·kg-1灌胃异甘草素原料药混悬液和异甘草素聚乳酸纳米粒混悬液。分别于0,0.5,0.75,1,1.5,2,3,4,6,8,10和12 h各时间点眼眶采血约0.3 mL,置于肝素化处理后的离心管中。以转速为3500 r·min-1离心2 min。分取上层血浆,于-20 ℃冰箱冷冻保存,测定前复溶[10-11]。
2.5.5药动学曲线及主要参数 分别测定异甘草素及其聚乳酸纳米粒血浆样品血药浓度,绘制药动学曲线。达峰浓度(Cmax)和达峰时间(tmax)采用实测值,药物浓度-时间曲线下面积(AUC)采用梯形法计算。药动学曲线结果见图4及表4。异甘草素聚乳酸纳米粒tmax提前,但差异无统计学意义(P>0.05);Cmax由(436.86±90.46) ng·mL-1显著提高至(750.55±109.36) ng·mL-1;t1/2由(2.34±0.55) h延长至(3.81±0.72) h,表明聚乳酸纳米粒显著提高了药物在体内循环时间;AUC0-t由(1449.13±233.41) ng·mL-1·h极显著提高至(2463.88±408.17) ng·mL-1·h,口服吸收生物利用度提高至170.02%。
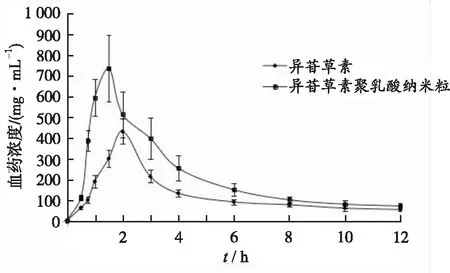
图4 异甘草素及其聚乳酸纳米粒的平均药物浓度-时间曲线(n=6)
Fig.4Meanplasmaconcentration-timecurvesofisoliquiritigeninanditspolylacticacidnanoparticles(n=6)
3 讨论
异甘草素聚乳酸纳米粒系采用改良的自乳化溶剂扩散法进行制备,推测形成纳米粒的过程为:在搅拌的条件下,将溶有异甘草素和载体的油相加入到含乳化剂的水相中,水溶性溶剂自发扩散,大大降低了两相之间的表面张力,同时产生界面骚动,最终形成纳米级别的乳滴。随着有机溶剂的不断挥发,纳米级别乳滴从水相中逐渐析出。由于异甘草素分子结构中有3个羟基与苯环直接相连,具有较强的极性,容易与聚乳酸分子结构中羰基形成氢键[13-14],增强了两者的亲和力,乳滴固化后成为聚乳酸纳米粒。可以看出,载体和药物能否从水相中同步析出,是影响包封率的影响因素之一。由于载体聚乳酸在乙醇不溶,而在丙酮溶解度较好。在丙酮体积不变的情况下,通过调整乙醇有机溶剂的比例,进而使载体和药物能近乎同步从水相中析出形成纳米粒。这也解释了正交实验考察结果中乙醇-水比例对异甘草素聚乳酸纳米粒包封率具有极显著性差异的原因。刘月新等[15]制备的吡喹酮聚乳酸纳米粒包封率仅为46.74%,这可能与有机溶剂(丙酮/乙醇)比例不合适有关。因此,除了药物/载体比、油相/水相体积比、表面活性剂浓度等因素会影响聚乳酸纳米粒包封率外[15-16],有机溶剂的比例也是需要重点考察的因素之一。本研究对高包封率的聚乳酸纳米粒的研究有一定的借鉴意义[17]。
表4 异甘草素及其聚乳酸纳米粒的主要药动学参数
Tab.4Mainpharmacokineticparametersofisoliquiritigeninanditspolylacticacidnanoparticles
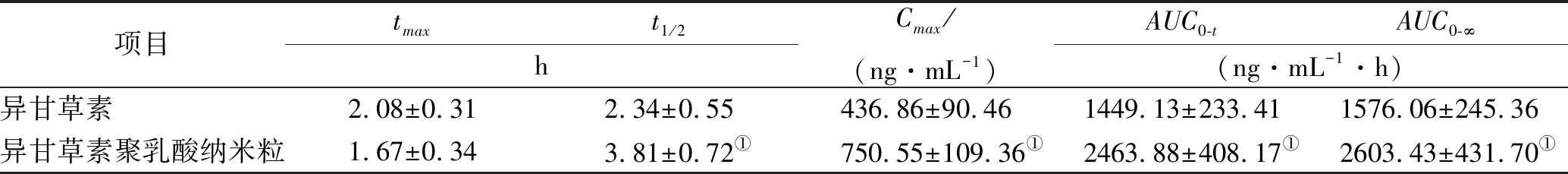
项目tmaxt1/2hCmax/(ng·mL-1)AUC0-tAUC0-∞(ng·mL-1·h)异甘草素2.08±0.312.34±0.55436.86±90.461449.13±233.411576.06±245.36异甘草素聚乳酸纳米粒1.67±0.343.81±0.72①750.55±109.36①2463.88±408.17①2603.43±431.70①
①与异甘草素原料药比较,t=0.000 439,0.000 812,0.001 547,0.004 284,P<0.01。
①Compared with crude isoliquiritigenin,t=0.000 439,0.000 812,0.001 547,0.004 284,P<0.01.
制备的异甘草素聚乳酸纳米粒粒径分布均匀,体外释药模型符合Weibull模型。体内药动学显示,聚乳酸纳米粒使异甘草素的Cmax显著提高;AUC0-t显著提高,口服吸收生物利用度明显提高,为异甘草素的药理活性提高奠定基础。本研究成功制备了粒径较小、包封率较高、带负电荷性质的聚乳酸纳米粒,为进一步研究异甘草素聚乳酸纳米粒结构修饰[18-20],提高肿瘤靶向效果等奠定了实验基础[21]。

