重症患者碳青霉烯类药物血药浓度监测分析
徐银丽,郭晓芳,江翊国,梁 培
(1.南京医科大学附属苏州科技城医院药学部,江苏 苏州 215153;2.南京鼓楼医院重症医学科,江苏 南京 210008;3.南京鼓楼医院药学部,江苏 南京 210008)
碳青霉烯类抗菌药物是非典型β-内酰胺类抗菌药物,通过与青霉素结合蛋白(penicillin-binding protein,PBP)紧密结合,阻碍细胞壁的合成,使细菌迅速肿胀、溶解发挥作用,是时间依赖性抗菌药物,主要经肾排泄,常用于耐药阴性菌感染的治疗[1-2]。不同的碳青霉烯类药物抗菌谱、抗菌活性、PK/PD均存在一定差异,不同病理生理状态也会影响其药代动力学。本研究目的为监测重症患者使用常规剂量碳青霉烯类药物时,血药谷浓度是否能达到目标范围,为重症患者个体化用药提供数据基础,优化给药方案,提高治疗的有效性和安全性[3]。
1 材料和方法
1.1 研究对象
采用回顾性研究方法,收集2017年1月至2018年12月某三甲医院ICU收治的使用碳青霉烯类药物并监测血药浓度的重症患者信息,共计122例患者,排除以下患者:(1)年龄< 16岁;(2)碳青霉烯类药物过敏史;(3)用药时间< 48 h;(4)仅监测40%给药间隔(40%T)血药浓度而未监测血药谷浓度;(5)检验结果缺失。最终入组85例,比阿培南组17人、亚胺培南组50人、美罗培南组18人。
1.2 治疗
药物信息如下:注射用比阿培南(商品名称:天册,0.3 g)、注射用亚胺培南西司他丁钠(商品名称:泰能,0.5 g∶0.5 g)、注射用美罗培南(商品名称:美平,0.5 g)。静脉滴注给药,比阿培南组剂量0.3 g,q 12 h ~ 0.6 g,q 8 h不等,5人行连续肾脏替代疗法(continuous renal replacement therapy,CRRT)治疗;亚胺培南组剂量0.5 g,q 12 h ~ 1 g,q 8 h不等,19人行CRRT治疗;美罗培南组剂量0.5 g,q 12 h ~ 1 g, q 8 h不等,10人行CRRT治疗。病程中动态监测肾功能,根据肌酐清除率、CRRT治疗情况,个体化计算初始剂量并及时调整[4]。CRRT模式除2例连续静静脉血液透析滤过(continuous veno-venous hemodia fi ltration,CVVHDF)以外,其他均为连续静脉血液滤过(continuous veno-venous hemo filtration,CVVH),血液流速180 ~ 250 mL·min-1,置换液流速1000 ~ 3000 mL·h-1。
1.3 数据采集
收集患者年龄、性别、身高、体重、APACHE Ⅱ评分、SOFA评分、主要感染诊断、肝酶、血肌酐、白蛋白、给药剂量及血药谷浓度等数据。
1.4 血药浓度测定
1.4.1 样本采集 由护士在第4次给药开始前在患者静脉抽取2 mL静脉血标本测定血药谷浓度(CRRT患者于非泵入侧静脉抽取)。
1.4.2 血药浓度测定 采用高效液相色谱法,仪器:Agilent 1200型高效液相色谱仪,Agilent 1200色谱工作站(Agilent公司)。血浆前处理:亚胺培南及比阿培南取血后30 min内、美罗培南取血后1 h内,3000 r·min-1离心5 min,取上清液300 μL,加入100 μL稳定剂,旋涡混匀,-80 ℃冻存待测。检验方法参照该院及外院相关研究,由血药浓度监测实验室进行方法学检查[5-7]。
1.5 评价指标
碳青霉烯类药物为时间依赖性药物,评价其抗菌效果的主要参数是血药浓度维持在细菌最低抑菌浓度(minimum inhibitory concentration,MIC)以上的时间。疗效最大化一般需要40%T > MIC,重症患者或耐药菌感染将100%T > MIC甚至100%T > 4MIC设置为目标靶值时可获得更好的杀菌效应[8]。
1.6 统计学处理
2 结果
2.1 一般资料
单因素方差分析结果显示患者年龄、性别、身高、体重、APACHE Ⅱ评分、SOFA评分均无显著性差异(P > 0.05)。主要感染诊断有:脓毒血症(23人次)、重症肺炎(18人次)、腹腔或肠道感染(16人次)、血流感染(13人次)、颅内感染(8人次)、重症胰腺炎(5人次)、复杂皮肤及软组织感染(烧伤)(3人次)、肝脓肿(2人次)等,同一患者可能存在多部位感染。APACHE Ⅱ评分:急性生理与慢性健康评分。SOFA评分:全身性感染相关性器官功能衰竭评分。详见表1。
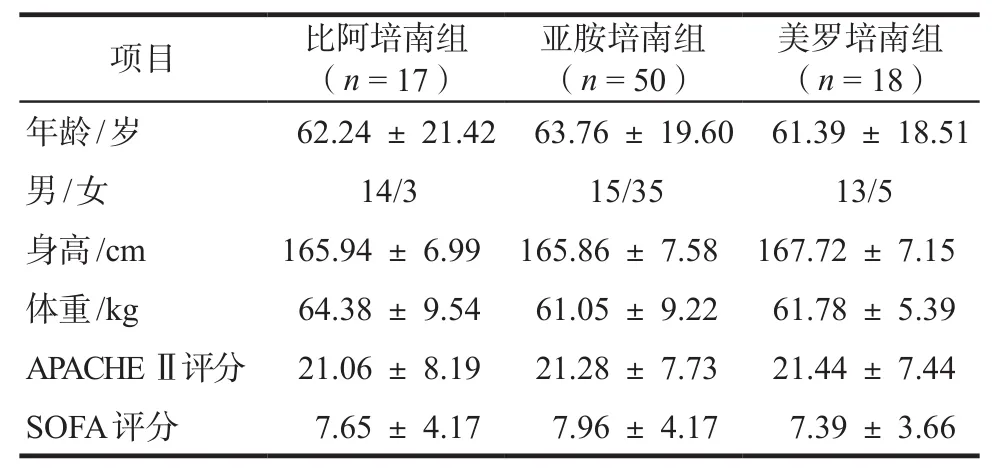
表1 患者一般资料Tab 1 General information of patients
2.2 血药谷浓度
各组血药谷浓度结果见表2。各组数据符合正态分布,进行单因素方差分析,美罗培南组血药谷浓度高于亚胺培南组和比阿培南组,差异有统计学意义(P = 0),后两组间差异无统计学意义。亚胺培南组和美罗培南组各有3例患者,因检出耐药菌(MIC ≥ 16 μg·mL-1),延长滴注时间至3 h,此类患者血药谷浓度高于各组血药谷浓度均值。
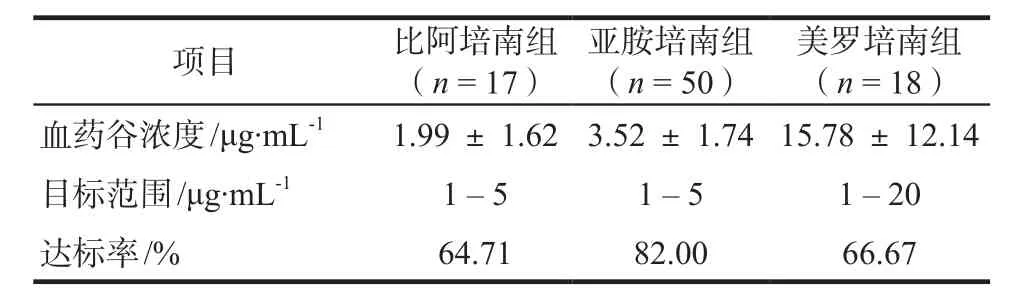
表2 各组血药谷浓度测定结果Tab 2 Results of serum trough concentrations of each group
2.3 CRRT对血药谷浓度的影响
根据患者肾功能及CRRT条件,个体化调整给药剂量。各组CRRT与非CRRT血药谷浓度分别进行单因素方差分析,结果见表3,差异均无统计学意义(P= 0.71、0.76、0.96)。在及时个体化调整剂量的情况下,CRRT未对碳青霉烯类血药谷浓度产生显著影响。
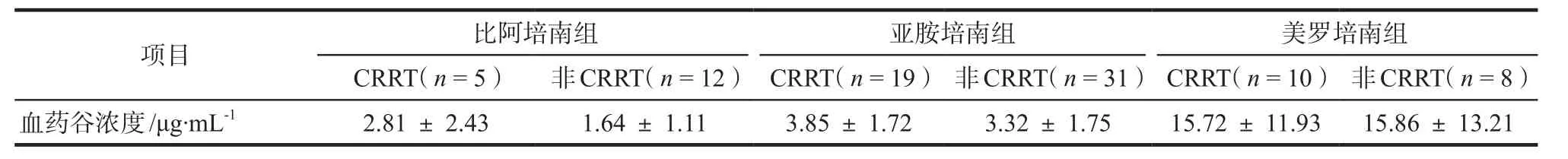
表3 CRRT治疗对碳青霉烯类血药谷浓度的影响Tab 3 In fl uence of CRRT on serum trough concentration of carbapenems
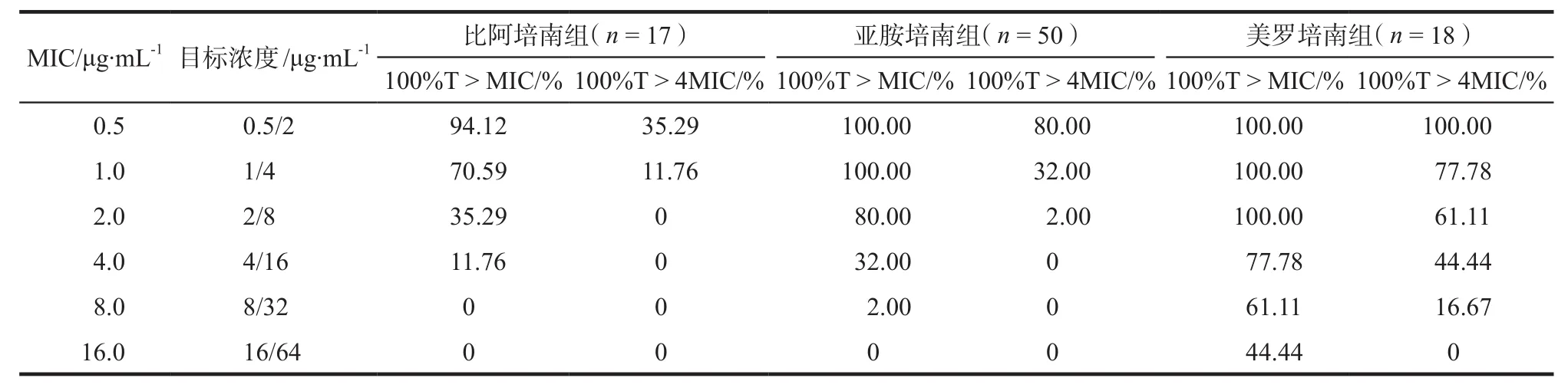
表4 各组PK/PD达标率比较Tab 4 Comparison of PK/PD compliance rate of each group
2.4 PK/PD达标率
不同MIC值时的PK/PD达标率见表4,各组微生物检出结果见表5,美罗培南组有较高的PK/PD达标率。
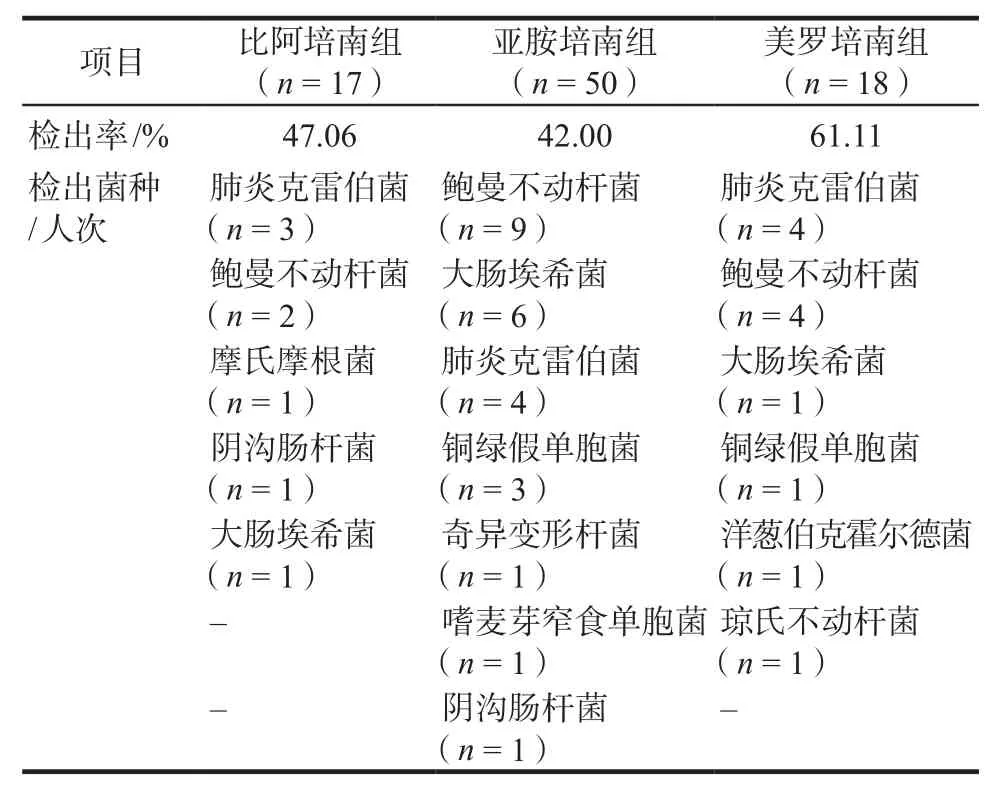
表5 各组微生物检出结果Tab 5 Etiological results of each group
2.5 碳青霉烯类药物对肝肾功能的影响
各组间用药后肝肾功能指标见表6。各组间用药后各指标比较,差异均无统计学意义(P > 0.05),未出现因药物性肝肾功能损害而停药的患者。
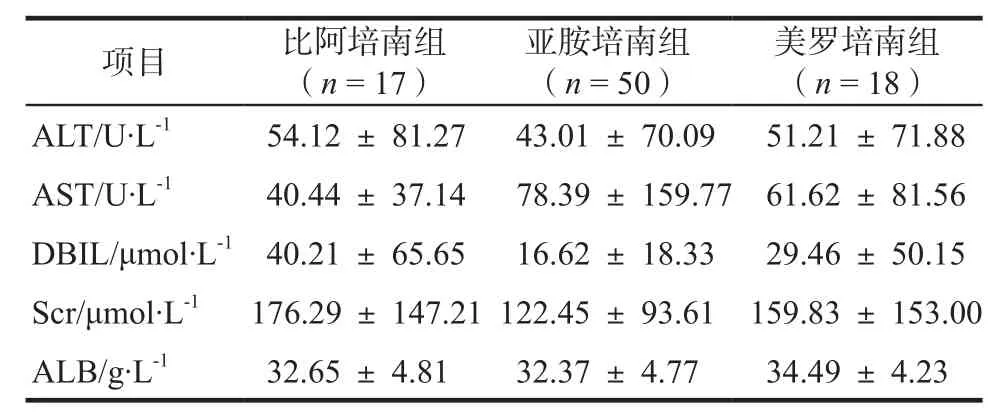
表6 各组用药后肝肾功能比较Tab 6 Comparison of liver and kidney function after administration of each group
2.6 转归
比阿培南组3人死亡,14人好转。亚胺培南组10人死亡,40人好转。美罗培南组6人死亡,12人好转。无患者出现恶心、呕吐、肾功能损伤等不良反应。亚胺培南组有1人出现中性粒细胞减少,3人出现抽搐,其血药谷浓度分别为:3.87 μg·mL-1、5.33 μg·mL-1、6.25 μg·mL-1、7.25 μg·mL-1,2人直接停药,2人改用美罗培南。比阿培南组、亚胺培南组、美罗培南组血药谷浓度数据经验证均符合正态分布(Kolmogorov-Smirnov结果P = 0.056、0.062、0.191),分别进行线性回归分析,线性回归相关系数分别为R = 0.848、0.289、0.531,R2= 0.719、0.083、0.282,比阿培南组线性相关程度最强,详见表7。预测变量中仅比阿培南组Scr水平与血药谷浓度呈显著相关性(P = 0.003)。
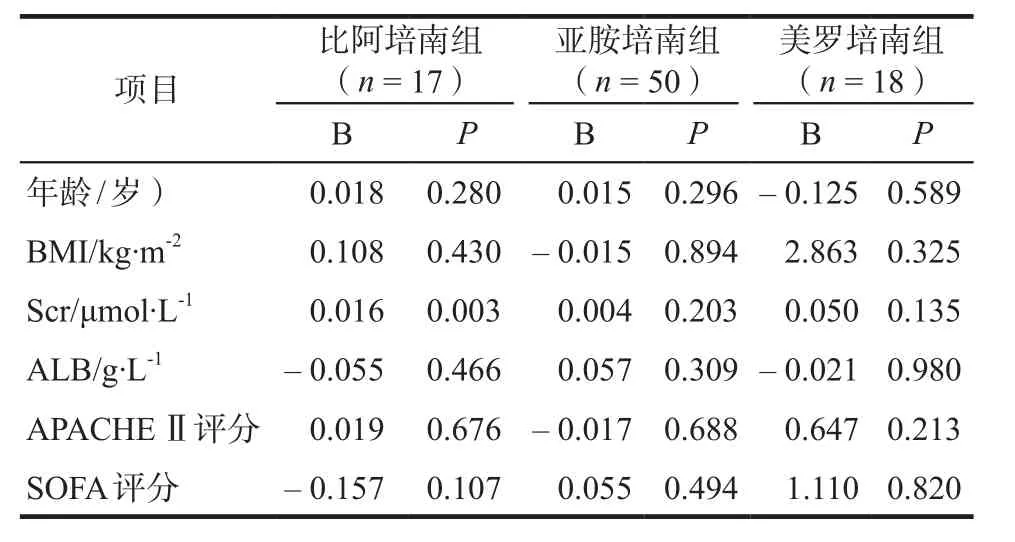
表7 血清药物谷浓度的线性回归分析Tab 7 Linear regression analysis of serum trough concentration
3 讨论
3.1 重症患者的特殊病理生理状态
重症感染患者通常存在器官功能障碍、心排量高、休克等特殊病理生理状况,可引起抗菌药物药代动力学参数改变,抗菌药物的合理应用可直接影响患者预后。重症感染患者以脓毒症居多,高剂量可确保更高的AUC和T > MIC,使患者获益更多[3,9]。对于器官功能损害的患者,为避免药物蓄积加重器官功能损害,也需调整剂量。通过TDM可帮助调整给药剂量、频次、输注时长,优化给药方案[10-11]。
3.2 基于TDM的碳青霉烯类给药方案优化
本研究中的药敏试验仅做对亚胺培南的MIC值,检出菌中44.17%为敏感菌(MIC ≤ 1 μg·mL-1),这要求碳青霉烯类药物血药谷浓度维持在较高水平,才能达到较好的治疗效果。通常有效血药浓度范围可将MIC敏感值(1 μg·mL-1)作为下限,当碳青霉烯类药物血药浓度达到MIC的4 - 5倍时,杀菌效果趋于饱和,增加剂量并不增加疗效,假设MIC = 1 μg·mL-1,通常可将5 μg·mL-1设为上限。亚胺培南致癫痫发生率高于美罗培南,小鼠亚胺培南血药浓度2 μg·mL-1左右即可引起癫痫,人体研究极少[12-13];比阿培南上市时间短,研究数据稀缺,无明确的致毒性血药浓度数据;美罗培南与脑神经细胞γ-氨基丁酸受体亲和力较弱,神经系统损害较少,治疗窗较宽,有研究表明美罗培南50%致肾毒性和癫痫的血药浓度分别为44.45 μg·mL-1和64.2 μg·mL-1[14]。本研究所在医疗机构将比阿培南、亚胺培南目标浓度范围定为1 - 5 μg·mL-1,美罗培南定为1 - 20 μg·mL-1。此目标范围尚不是金标准,各医疗、监测机构并不统一,仍在不断完善中,并不是判断有效性和安全性的唯一标准。本研究中比阿培南组和美罗培南组均未出现不良反应,亚胺培南组4人出现不良反应,其中2人改用美罗培南后未出现不良反应。综合考虑,在MIC相同的情况下,对于肾功能不全易造成药物蓄积或颅内感染者,美罗培南的有效性和安全性可能更好。
目前,临床使用比阿培南的常规剂量是0.3 g,q 12 h或q 8 h,但已有研究指出常规剂量并不能达到较好的临床疗效及细菌清除率,日本传染病协会/日本化疗学会(JAID/JSC)发布的呼吸道传染病治疗指南(2016)指出,对于治疗产ESBL的克雷伯菌,比阿培南的推荐剂量可达到0.3 - 0.6 g,q 8 h - q 6 h。本研究中比阿培南血药谷浓度PK/PD达标率低,与剂量较低密切相关。碳青霉烯类均为亲水性抗菌药物,主要经肾排泄,血流动力学不稳定者,液体复苏或使用血管活性药物、CRRT等器官支持治疗均可加快液体代谢,导致血药浓度下降[15]。监测血药谷浓度可验证其是否在目标范围内,并通过及时调整剂量提高治疗的有效性与安全性。
3.3 研究局限性
因本研究中患者病理生理状态多样,血流动力学状态个体差异大,样本量少,结果存在一定局限性。线性回归分析发现仅比阿培南组Scr水平与血药谷浓度呈显著相关性(P = 0.003)。亚胺培南和美罗培南组血药谷浓度与各预测变量无显著相关性,但Scr的P值最小,提示肾功能可能是一项重要因素,扩大样本量是深入研究的前提。
综上,根据药物品种、特殊的病理生理状态、血药谷浓度等可制定碳青霉烯类药物的个体化给药方案。美罗培南血药谷浓度及PK/PD达标率均高于比阿培南和亚胺培南,对于肾功能损伤或颅内感染等特殊患者可能具有更好的疗效和安全性。

