对放线菌Sy11有诱导作用的致病疫霉信号分子研究
郝志伟,蒋继志,吴路芳,张红霞,张荷花
(河北大学 生命科学学院,河北 保定 071002)
致病疫霉(Phytophthorainfestans)属于藻界、卵菌门、卵菌纲(Oomycetes)、霜霉目(Eronosporales)、腐霉科(Pythiace)、疫霉属(Phytophthora)[1],主要侵染番茄和马铃薯,它所引起的马铃薯晚疫病已成为世界第一大作物病害,全世界每年由该病造成的损失为60亿~70亿美元[2].由于生物防治具有环保和高效的巨大潜力已受到越来越多学者的关注.当前,针对致病疫霉及其所引起的马铃薯晚疫病已有许多报道,主要集中在拮抗菌菌株筛选[3]、鉴定[4]、抑菌活性测定[5]、抑菌物质分离纯化[6]、离体组织和盆栽植株防病效果检测[7]等方面,但对拮抗菌与致病疫霉之间的关系,尤其拮抗菌抑制致病疫霉的机理研究得还不多.本研究室前期也筛选获得了多株对致病疫霉有显著抑制作用的拮抗菌株[8],其中放线菌Sy11菌株是本研究室刘月等[8]从种植番茄的土壤中筛选出的74株放线菌中的1株,经鉴定为细黄链霉菌(Streptomycesmicroflavus).对致病疫霉菌丝生长的抑制率为86.47%,但其无菌体发酵液无抑菌作用,且发现Sy11只有与致病疫霉共培养在黑麦培养基上才有抑菌作用,经初步检测Sy11并非通过挥发性物质抑制致病疫霉生长,而Sy11与致病疫霉对峙培养后两菌落之间的无菌体琼脂块对致病疫霉菌丝生长的抑制率可达79.38%,在黑麦培养基上单独培养Sy11后其菌落外围的无菌体琼脂块并无抑菌作用;推测Sy11在与致病疫霉共培养过程中,对致病疫霉有感应现象,可能是致病疫霉刺激或诱导了Sy11菌株,使其产生了抑菌物质[8].当前,关于微生物群体感应系统的研究在细菌及真菌方面已有一些报道[9],在卵菌方面研究主要集中在致病菌与其寄主植物方面[10],而有关放线菌感应致病疫霉方面的研究国内外均未见报道.本研究室王游游等[11]和王雪宁等[12]都证实了刘月等[8]的推测,明确了Sy11对致病疫霉确有感应现象,即致病疫霉诱导了Sy11的抑菌作用,并发现只有活的致病疫霉菌体才能诱导Sy11的抑菌作用,死亡致病疫霉菌体(经体积分数75%乙醇浸泡处理)无诱导作用,并明确了共培养过程中致病疫霉能分泌诱导Sy11抑菌作用的信号分子,且20 ℃共培养5 d后信号分子的诱导活性最高,且该信号分子易溶于甲醇,Sy11受甲醇萃取液诱导后对致病疫霉的抑制率为68.4%.但致病疫霉在哪种培养方式(致病疫霉单独培养或与Sy11共培养)下产生的信号分子对Sy11抑菌作用的诱导活性更强,该信号分子属于哪种物质等均不清楚.本研究拟进一步明确致病疫霉的培养方式与其信号分子产生以及诱导活性强弱之间的关系,并初步明确信号分子的物质类别及萃取条件等,为信号分子的进一步分离、纯化和利用奠定基础,同时也为揭示致病疫霉与Sy11之间的相互关系和Sy11抑制致病疫霉的机理提供实验依据.
1 材料与方法
1.1 供试菌株与培养基
致病疫霉[Phytophthorainfestans(Montagne) de Bary]W101采自黑龙江克山农场,细黄链霉菌(Streptomycesmicroflavus)Sy11筛选自番茄田土壤中,均由河北大学分子免疫实验室分离、纯化、鉴定和保存.所用培养基为黑麦固体培养基(Rye)、黑麦液体培养基(RL)和高氏1号培养基(GS),RL制作方法与黑麦固体培养基一致,配方中不加入琼脂粉.
1.2 致病疫霉单独培养产生诱导Sy11信号分子检测
1.2.1 致病疫霉固体培养
在Rye表面铺设与培养皿同等大小的玻璃纸(经过高压蒸汽灭菌),在玻璃纸上接种经Rye活化培养的致病疫霉菌饼(Φ=10 mm),20 ℃黑暗培养7 d后,揭开玻璃纸打取无菌体琼脂块Ⅰ(Φ=10 mm),与经GS活化培养的Sy11菌饼(Φ=10 mm)对峙培养5 d后,从两菌落之间的正中位置打取无菌体琼脂块Ⅱ(Φ=10 mm),再次与致病疫霉对峙培养10 d,十字交叉法测量菌落直径,评价无菌体琼脂块Ⅱ对致病疫霉菌丝生长的影响,以空白Rye琼脂块作为对照,每次重复3个平皿,实验重复3次.
1.2.2 致病疫霉液体培养
参考王游游等[11]的方法以RL制备致病疫霉无菌体发酵液,然后在Rye中央接种Sy11菌饼(Φ=10 mm),在其两侧20 mm处打孔(Φ=10 mm),加入200 μL致病疫霉无菌体发酵液,培养5 d后从Sy11菌落与致病疫霉发酵液之间的正中位置打取无菌体琼脂块(Φ=10 mm),与致病疫霉对峙培养10 d后观察结果,十字交叉法测量菌落直径,每次重复3个平皿,实验重复3次,以等体积未培养致病疫霉的RL作对照.
抑菌率=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)×100%
1.3 致病疫霉单独培养以及与Sy11共培养诱导Sy11抑菌作用强弱比较
参考王雪宁等[12]的方法对致病疫霉与Sy11进行共培养,包括对峙培养和混合培养,对峙培养7 d后打取两菌落之间的无菌体琼脂块,再与致病疫霉对峙培养10 d,观察统计抑菌作用;液体培养致病疫霉5 d后加入Sy11菌体再培养7 d,离心并过滤除去致病疫霉和Sy11菌体,取滤液与致病疫霉对峙培养7 d,观察统计抑菌作用;致病疫霉单独固体培养和单独液体培养以及诱导效果的检测方法同1.2.
1.4 致病疫霉单独液体培养后无菌体发酵液中信号分子分析
1.4.1 糖类物质诱导活性检测
采用醇沉糖法[13]得到多糖类物质,将致病疫霉无菌体发酵液用3倍体积的无水乙醇沉淀,4 ℃静置24 h后离心(10 000 r/min,20 min)得到沉淀与上清液,上清液旋蒸除去乙醇后用去离子水定容到原体积;沉淀用1/4体积的石油醚溶解后反复脱脂4次,减压除去石油醚后用20 mL去离子水溶解(50~60 ℃),按Sevage法去除蛋白类物质,最终得多糖粗提液.上清液及多糖粗提液对Sy11抑菌作用的诱导按1.2.2的方法进行.
1.4.2 蛋白质类物质诱导活性检测
根据文献[13]的方法利用硫酸铵沉淀法从致病疫霉无菌体发酵液中得到蛋白质类物质,取20 mL致病疫霉无菌体发酵液,以质量分数80%硫酸铵沉淀[13],离心得到上清液;沉淀经无菌水溶解、透析除杂后,即得蛋白质类溶液.另外,由于硫酸铵沉淀所得到的不全是蛋白质,因此又采用Sevage法[13]得到除去致病疫霉无菌体发酵液中蛋白质后的非蛋白类物质,将1/4体积的Sevage试剂(氯仿与正丁醇体积比为5∶1)加入20 mL致病疫霉无菌体发酵液中,震荡、离心后除去变性蛋白,重复操作至水相与有机相溶液界面无凝胶絮状物产生;收集水相部分,有机相部分旋蒸除去有机试剂,用等体积去离子水定容得到有机相溶液.以上硫酸铵沉淀后得到的上清液和蛋白类溶液及Sevage法得到的水相和有机相溶液对Sy11抑菌作用的诱导按照上述1.2.2的方法进行.
1.4.3 脂类物质诱导活性检测
参考Folch法[14]用氯仿-甲醇溶液(2∶1,体积比)萃取致病疫霉无菌体发酵液中的脂类物质,在20 mL致病疫霉无菌体发酵液中缓慢加入氯仿-甲醇溶液(10∶3,体积比),边加边搅拌,常温下静置1 h,待溶液有机相、沉淀、水相分开后,有机相经旋蒸除去有机试剂,去离子水定容到原体积即得脂类物质粗提液;水溶液用去离子水定容到原体积.水溶液及脂类粗提液对Sy11抑菌作用的诱导按照1.2.2的方法进行.
1.5 几种有机试剂对致病疫霉脂类信号分子萃取效果比较
参考文献[15]的方法,采用石油醚、乙酸乙酯、95%(体积分数)乙醇3种不同极性的有机试剂对致病疫霉无菌体发酵液中的脂类信号分子物质进行萃取,分别得到不同试剂的萃取液及其萃余液,萃取液及其萃余液对Sy11的诱导按照1.2.2的方法进行.
1.6 数据处理
实验数据均采用2016版Excel进行编辑处理,采用SPSS统计分析软件进行方差分析.
2 结果与分析
2.1 致病疫霉单独培养过程中产生诱导Sy11的信号分子验证
利用玻璃纸平板法在Rye上单独培养致病疫霉后(图1a),用玻璃纸下的琼脂块Ⅰ(图1b)诱导Sy11菌株(图1c),再取经过琼脂块Ⅰ诱导后的Sy11菌落与琼脂块Ⅰ之间的琼脂块Ⅱ与致病疫霉对峙培养,发现Sy11经诱导后的无菌体琼脂块(琼脂块Ⅱ)对致病疫霉菌丝生长有显著的抑制作用,菌落直径为29.5 mm(图1d),对照(图1e,未培养致病疫霉的空白琼脂块)菌落直径为80 mm,两者之间达到极显著差异(P<0.01).表明致病疫霉在固体Rye上单独培养可产生诱导Sy11抑菌作用的信号分子,并能分泌到培养基中,且诱导活性很强.

a.单独培养致病疫霉;b.琼脂块Ⅰ;c.琼脂块Ⅰ诱导Sy11菌株;d.琼脂块Ⅱ与致病疫霉;e.空白琼脂块与致病疫霉.
为了明确致病疫霉经液体培养后是否也产生诱导Sy11抑菌作用的信号分子,检测了致病疫霉经RL单独培养的无菌体发酵液对Sy11抑菌作用的诱导.结果显示,无菌体发酵液与Sy11对峙培养(图2a)后两者之间的无菌体琼脂块(图2b)对致病疫霉菌丝生长具有明显的抑制作用:菌落直径为30.5 mm(图2c),对照(图2d,未培养致病疫霉的RL)菌落直径为82 mm,两者之间达到极显著差异(P<0.01)).说明致病疫霉经液体培养也可产生诱导Sy11产生抑菌物质的信号分子.
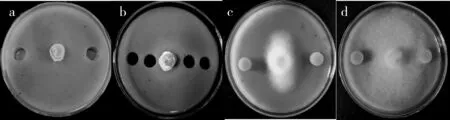
a.致病疫霉无菌体发酵液诱导Sy11; b.诱导后取无菌体琼脂块; c.无菌体琼脂块与致病疫霉; d.空白RL对照.
2.2 致病疫霉单独培养以及与Sy11共培养对Sy11诱导活性比较
实验进一步比较了致病疫霉单独培养(单独固体培养和单独液体培养)以及与Sy11共培养(对峙培养和混合培养)在诱导Sy11抑菌作用方面的差异,结果如图3所示.由图3可以看出,在4种不同培养方式中,对峙培养后致病疫霉对Sy11抑菌作用的诱导活性最强,其无菌体琼脂块对致病疫霉菌丝体生长的抑制率为80.28%,其次是混合培养(抑菌率为76.15%),而单独固体培养下致病疫霉的诱导活性最弱(抑菌率为72.55%).可见致病疫霉与Sy11共培养比其单独培养对Sy11的诱导活性强.但统计分析表明,4种培养方式下致病疫霉对Sy11抑菌作用的诱导活性并无显著性差异.由于致病疫霉单独液体培养方式比其他3种培养方式更便于分析无菌体发酵液中的信号分子,因此,后续实验选用致病疫霉单独液体培养方式.
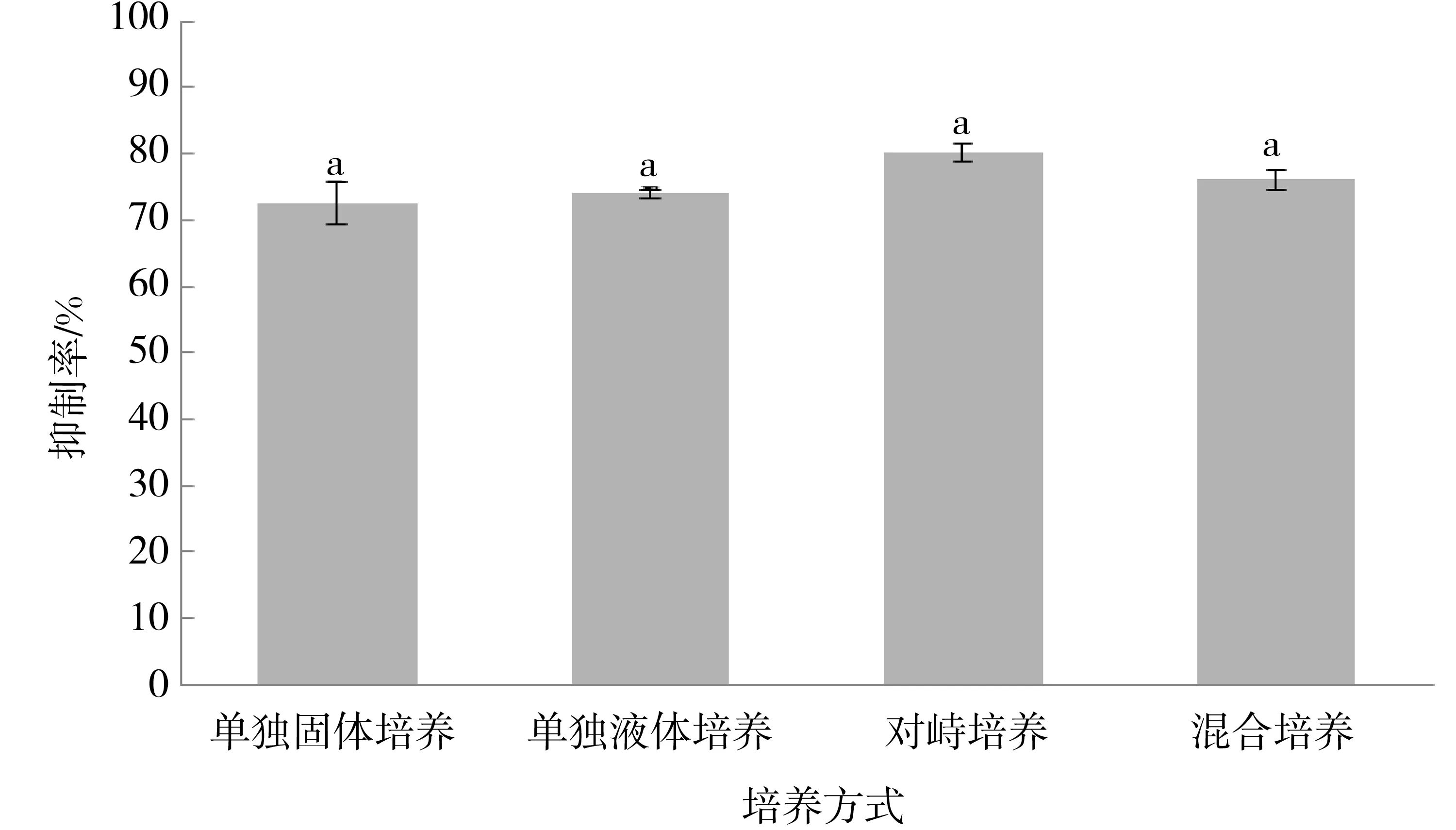
小写字母表示不同培养方式下抑菌效果差异
2.3 致病疫霉单独液体培养后产生的信号分子的诱导作用
2.3.1 多糖类物质的诱导作用
单独培养的致病疫霉无菌体发酵液经过滤除菌、乙醇沉淀、石油醚除脂、Sevage法去蛋白质后得到的多糖粗提液以及乙醇沉淀后的上清液,分别对Sy11诱导培养5 d后,打取两者之间的无菌体琼脂块再与致病疫霉对峙培养,结果显示,空白对照(图4a)和RL对照(图4b)的菌落直径均为85 mm,多糖粗提液诱导Sy11后的无菌体琼脂块对致病疫霉的抑制作用较弱,菌落直径为61.5 mm(图4c),而乙醇沉淀后的上清液诱导Sy11后的无菌体琼脂块则表现出很强的抑菌作用,菌落直径为26.8 mm(图4d);2种处理与对照之间均达到显著性差异(P<0.05),2种处理之间也达到了显著性差异(P<0.05).说明致病疫霉产生的信号分子主要存在于乙醇沉淀后的上清液中,不属于多糖类物质或与多糖类物质关系不大,也说明乙醇不易获得该信号分子.

a.空白对照;b.RL对照;c.多糖粗提液;d.乙醇沉淀后的上清液.
2.3.2 蛋白类物质的诱导作用
以质量分数80%硫酸铵对致病疫霉无菌体发酵液进行沉淀,得到的沉淀与上清液分别对Sy11诱导培养5 d后,再取两者之间的无菌体琼脂块与致病疫霉对峙培养.发现空白对照(图5a)和RL对照(图5b)的菌落直径均为85 mm,硫酸铵处理后的沉淀诱导Sy11后的无菌体琼脂块对致病疫霉的抑制作用较弱,菌落直径为60 mm(图5c),而上清液诱导Sy11后的无菌体琼脂块则有很强的抑菌作用,菌落直径为33 mm(图5d),2种处理之间达到显著性差异(P<0.05),表明致病疫霉产生的信号分子主要存在于硫酸铵沉淀后的上清液中,不属于蛋白质类物质或与蛋白质类物质关系不大,也说明用硫酸铵不易获得该信号分子;为进一步验证硫酸铵沉淀后的蛋白质类物质是否有诱导作用,以Sevage试剂处理致病疫霉无菌体发酵液,使其中的蛋白质类物质变性或降解,得到的上清液(水相)与变性成分(有机相)分别对Sy11诱导培养5 d后,再取两者之间的无菌体琼脂块与致病疫霉对峙培养,发现上清液诱导Sy11后的无菌体琼脂块对致病疫霉有显著的抑菌作用,菌落直径为32 mm,而变性成分(有机相)诱导Sy11后的无菌体琼脂块对致病疫霉的抑制作用很弱,菌落直径为59.2 mm,两者之间也达到显著性差异(P<0.05).表明致病疫霉产生的信号分子主要存在于Sevage试剂处理后的上清液(水相)中,不属于蛋白质类物质或与蛋白类物质无关.
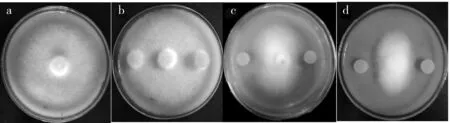
a.空白对照;b.RL对照;c.蛋白质类物质;d.上清液.
2.3.3 脂类物质的诱导作用
利用氯仿-甲醇(2∶1,体积比)溶液对致病疫霉无菌体发酵液进行萃取后,得到氯仿层脂类粗提液和水溶液,分别对Sy11诱导培养5 d后,取两者之间的无菌体琼脂块再与致病疫霉对峙培养,结果显示,空白对照(图6a)和RL对照(图6b)的菌落直径均为85 mm,脂类粗提液诱导Sy11后的无菌体琼脂块对致病疫霉菌丝生长的抑制作用很强,菌落直径为32.8 mm(图6c),远优于水溶液诱导后的抑菌作用,菌落直径为56 mm(图6d),两者之间达到显著性差异(P<0.05).说明致病疫霉产生的信号分子属于氯仿-甲醇萃取的脂类物质,或以脂质类物质为主.
2.4 有机试剂对致病疫霉无菌体发酵液中信号分子萃取效果比较
在上述已初步明确致病疫霉产生的能诱导Sy11抑菌作用的信号分子基本属于脂类物质或以脂类物质为主的基础上,进一步选择常用提取脂类物质的95%(体积分数)乙醇、乙酸乙酯和石油醚进行萃取,得到了3种溶剂的萃取液和萃余液,分别对Sy11诱导培养5 d后,取两者之间的无菌体琼脂块与致病疫霉对峙培养.结果发现,95%(体积分数)乙醇和乙酸乙酯萃取液诱导Sy11后的无菌体琼脂块均对致病疫霉菌丝生长有明显抑制作用,菌落直径分别为46 mm(图7Aa)和35 mm(图7Ab),但石油醚萃取液诱导Sy11后的无菌体琼脂块无明显抑制作用(图7Ac),对照组菌落直径为84 mm(图7Ad),乙醇和乙酸乙酯萃取液与对照之间均达到极显著差异(P<0.01);另外,3种试剂的萃余液分别诱导Sy11后的无菌体琼脂块对致病疫霉菌丝生长也均有一定的抑制作用,菌落直径分别为48.67、52.67和47.33 mm(图7Ba-c),与对照组(菌落直径为84 mm,图7Bd)相比均达到显著性差异(P<0.05),其中在体积分数95%乙醇和石油醚的萃余液中仍然含有较多信号分子,而在乙酸乙酯萃余液中的信号分子相对较少,说明乙酸乙酯的萃取效果较其他2种试剂更加明显.
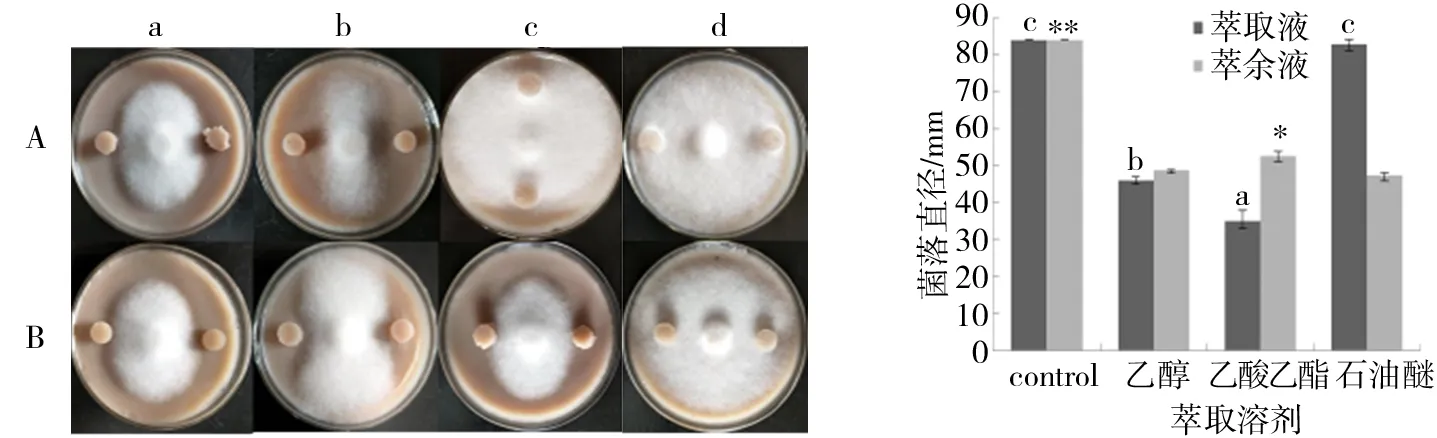
左图,A.萃取液;B.萃余液;a.乙醇;b.乙酸乙酯;c.石油醚;d.Control. 右图,小写字母表示不同试剂萃取液抑菌效果差异;*表示不同试剂萃余液的抑菌效果差异显著(P<0.05),**表示不同试剂萃余液的抑菌效果差异极显著(P<0.01).
3 讨论
群体感应(quorum-sensing,QS),也称为群感效应或群体效应,是微生物通过向外分泌并感应小分子物质来控制整个细菌群体行为活动的一种信号交流机制[9].目前对于微生物群体感应现象的研究主要集中在细菌群体之间,细菌的信号分子已发现4类:1)脂肪类衍生物,主要由革兰氏阴性细菌产生,多为N-酰化高丝氨酸内酯( AHLs) ;2)氨基酸和短肽类(AIP),主要是革兰氏阳性细菌产生;3)呋喃硼酸二酯(AI-2),部分革兰氏阴性和阳性细菌都可以产生,主要是不同种间细胞交流的通用信号分子;4)二酮哌嗪类(DKPs);最近研究发现,有些细菌可利用2种甚至3种不同信号分子调节自身群体行为[9].相比细菌来说,真菌间感应信号现象的研究相对较少,但也已发现了一些感应信号分子,主要有白念珠菌的金合欢醇(famesol)、酪氨醇(tyrosol)、酿酒酵母的苯基乙醇(phenylethylalcohol)和色氨酸(tryptophol)以及α-交配因子(α-factor)等[9].有关卵菌群体感应现象的研究主要集中在致病菌与宿主植物之间,对卵菌致病疫霉效应分子的研究,主要集中在致病疫霉与马铃薯的相互作用模式中[16-17],致病疫霉在侵染马铃薯的过程中,通常采用一种迷惑战术,即先产生一种效应分子RXLR(例如IPI-O1)去诱发马铃薯等多种植物产生过敏性反应(hypersensitive reaction, HR),促使植物局部细胞迅速死亡,限制病菌进一步扩展以保护整体植株;但当植物通过消耗体内与抗病相关的许多能量与物质完成HR这一过程后,致病疫霉则会产生其他的效应分子RXLR(例如PITG、PexRD 或Avar3a编码的产物)来干扰或消弱植物的免疫抗病反应,并诱发植物接受致病疫霉的侵染.但对于不同微生物群体之间,例如细菌与真菌之间、放线菌与真菌之间、放线菌与卵菌之间的感应现象,尤其是植物病原菌与其拮抗菌之间感应现象的研究均未见报道[18].
王游游等[11]已明确放线菌Sy11在与致病疫霉对峙培养过程中,对致病疫霉确有感应现象,即致病疫霉刺激或诱导了Sy11菌株,且只有活的致病疫霉菌体才有诱导作用,死亡的菌体无诱导作用,利用甲醇较易萃取得到致病疫霉产生的诱导Sy11的信号分子物质,甲醇萃取物诱导Sy11后对致病疫霉菌丝生长的抑制率为68.4%.本实验在此基础上明确了致病疫霉单独培养时也会产生这种信号分子,单独固体培养与单独液体培养后产生的信号分子对Sy11的诱导没有显著差异,并发现致病疫霉与Sy11共培养(对峙培养和混合培养)后产生的信号分子对Sy11抑菌作用的诱导活性高于单独培养,但彼此之间并无显著性差异;另外,本实验对致病疫霉产生的信号分子的物质类别进行了初步分析,发现该信号分子不属于蛋白质类或多糖类物质,属于脂类物质或至少以脂类物质为主,用石油醚不能萃取得到该物质,95%乙醇也只能萃取得到其中的一部分,而乙酸乙酯的萃取效果相对较好,萃取液诱导Sy11后的无菌体琼脂块对致病疫霉菌丝生长的抑制率为67.57%,说明乙酸乙酯也比较适合从致病疫霉无菌体发酵液中萃取信号分子,这与本实验室前期王游游等[11]报道的利用甲醇萃取的结果较好不一致,可能是所用试剂种类以及具体的萃取过程不同所致.以上实验结果进一步完善了对致病疫霉诱导Sy11抑菌作用的认识,同时也为后续对信号分子的分离纯化及理化性质研究提供了依据.

