长链非编码RNA HOTTIP对肺腺癌A549细胞侵袭转移能力及上皮间质转化的影响
金文静,杨华,王林宣,李珊珊,顾文超
上海健康医学院附属浦东新区人民医院,上海201200
肺癌是人类最常见的恶性肿瘤之一,我国年新发病例占全球一半以上[1]。目前临床肺癌治疗以手术和放化疗为主,但效果并不理想[2]。随着生物靶向药物的应用,患者的生存率明显提高,但药物种类的有限性及特定人群的局限性,均需要寻找更多、靶点人群更普遍的治疗药物。肺癌的转移复发是患者死亡的主要原因,而肿瘤转移与上皮间充质转化(EMT)的关系密切。长链非编码RNA(lncRNA)是一大类长度大于200 nt的功能性RNA,其虽无编码蛋白的功能,但能在表观遗传调控、染色质修饰、转录及转录后调控等多个方面调控基因的表达,从而影响肿瘤的增殖、凋亡、侵袭及转移等[3]。HOXA末端转录本反义RNA(HOTTIP)是近年来新发现的一种lncRNA,其与肝癌、食管癌、胃癌等消化系统肿瘤的发生密切相关,被认为是一种癌基因[4]。目前,研究发现HOTTIP在肺癌组织中高表达,但其在肺癌侵袭转移中的作用及可能的机制,尚不清楚。2018年2~8月,我们以肺腺癌A549细胞为研究对象,观察了HOTTIP对A549细胞侵袭转移能力及EMT的影响。
1 材料与方法
1.1 主要材料 肺腺癌细胞株A549购自中科院上海生命科学研究院生物化学与细胞生物学研究所细胞库;RPMI1640培养基、DMEM培养基、10%胎牛血清、100 mg/mL青霉素以及链霉素购自Sigma生物有限公司;携带HOTTIP-shRNA、HOTTIP 全长序列的慢病毒以及空白慢病毒由上海伯豪生物科技有限公司构建并验证;RIPA细胞裂解液购自北京索莱宝科技有限公司,基质胶购自Thermo公司,Transwell小室购自Corning公司;小鼠抗人Vimentin、GAPDH 单克隆抗体及兔抗人E-cadherin单克隆抗体购自Santa Cruz公司;HRP标记的山羊抗小鼠及山羊抗兔二抗购自Proteintech公司。
1.2 实验方法
1.2.1 细胞培养与病毒感染 将A549细胞接种于含10%胎牛血清、100 mg/mL青霉素/链霉素的RPMI1640培养基,置于37 ℃、5% CO2的常规细胞培养箱中培养。待细胞生长融合度达80%左右时,用0.25%胰酶消化细胞,并进行传代。取处于对数生长期的细胞,将其接种于无血清培养基中培养。培养4 h 后,将细胞分为HOTTIP-shRNA组、HOTTIP组和空载对照组。HOTTIP-shRNA组加入携带HOTTIP-shRNA的慢病毒(100 MOI),HOTTIP组加入携带HOTTIP全长序列的慢病毒(100 MOI),空载对照组加入空白慢病毒(100 MOI);共同孵育12 h后,加入嘌呤霉素继续培养2周。
1.2.2 细胞侵袭能力观察 采用Transwell实验。收集各组感染后的细胞,用0.25%胰酶消化后制成细胞密度5×105/mL的单细胞悬液。将Transwell小室提前5 min用磷酸缓冲液湿润。在上室加入100 μL细胞悬液,下室加入含10%胎牛血清的DMEM培养基。将Transwell小室放置于37 ℃ 5% CO2细胞培养箱中培养。12 h后取出并置于显微镜下,观察到下室细胞明显增多后终止实验。用磷酸缓冲液冲洗后,以中性甲醛固定,进行苏木素染色。显微镜下随机选取5个视野,计算穿膜细胞数,取其平均值。
1.2.3 细胞迁移能力观察 采用细胞划痕实验。收集各组感染后的细胞,用0.25%胰酶消化后制成细胞密度为5×105/mL的单细胞悬液。以1×105/孔将细胞均匀地铺于6孔培养皿中,置于37 ℃ 5% CO2细胞培养箱中培养。待细胞呈贴壁生长后6 h,每孔用10 μL移液枪的枪头划2条平行直线。用磷酸缓冲液冲洗3次,加入无血清培养基继续培养24 h。分别于划痕后0、24 h,在显微镜下观察划痕的宽度变化,用Image J软件测量细胞的迁移距离,计算细胞迁移率。细胞迁移率=(24 h划痕宽度-0 h划痕宽度)/0 h划痕宽度×100%。
1.2.4 细胞中EMT相关蛋白检测 采用Western blotting法。收集各组感染后的细胞,加入RIPA细胞裂解液裂解。用蛋白质提取试剂盒提取各组细胞总蛋白,以BCA法检测蛋白质浓度;取蛋白样品50 μg,于95 ℃水浴中加热变性。转移至SDS-PAGE 胶中,按照说明书进行电泳;湿转法将电泳产物转移至PVDF膜,用5% BSA封闭2 h。分别加入小鼠抗人Vimentin、GAPDH单克隆抗体和兔抗人E-cadherin单克隆抗体一抗,室温孵育过夜;用TBST洗3次,每次5 min;加入HRP标记的山羊抗小鼠及山羊抗兔二抗,室温孵育2 h;用TBST洗3次,每次5 min;用ECL化学发光显影,定影后用Image J软件分析条带光密度。以GAPDH作为内参,计算EMT相关蛋白与内参光密度比值表示其相对表达量。
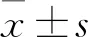
2 结果
2.1 HOTTIP对肺腺癌A549细胞侵袭能力的影响 HOTTIP-shRNA组、HOTTIP组、空载对照组穿膜细胞的数量分别为(12.85±3.25)、(305.65±53.45)、(45.25±10.75)个,HOTTIP-shRNA组穿膜细胞数量低于空载对照组,而HOTTIP组穿膜细胞数量均高于HOTTIP-shRNA组和空载对照组(P均<0.05)。
2.2 HOTTIP对肺腺癌A549细胞迁移能力的影响 HOTTIP-shRNA组、HOTTIP组、空载对照组细胞迁移率为35.62%±10.45%、13.84%±4.12%、64.52%±14.24%,HOTTIP-shRNA组细胞迁移率低于空载对照组,而HOTTIP 组细胞迁移率均高于HOTTIP-shRNA组和空载对照组(P均<0.05)。
2.3 HOTTIP 对肺腺癌A549细胞EMT蛋白表达的影响 与空载对照组比较,HOTTIP-shRNA组细胞Vimentin表达减少、E-cadherin表达增加(P均<0.05);与HOTTIP-shRNA组和空载对照组比较,HOTTIP 组细胞Vimentin表达增加、E-cadherin表达减少(P均<0.05)。见表1。

表1 各组细胞Vimentin、E-cadherin表达比较
注:与空载对照组比较,*P<0.05;与HOTTIP-shRNA组比较,#P<0.05。
3 讨论
肺癌主要病理类型包括腺癌和鳞状细胞癌,其中腺癌约占肺癌的40%。肺腺癌以女性发病率较高,主要治疗手段是手术和放化疗,但患者病死率仍较高。表皮生长因子受体(EGFR)抑制剂是近年来新开发的一类生物靶向药物,主要包括吉非替尼、厄洛替尼、埃克替尼等。因亚洲不吸烟女性人群的EGFR突变率较欧美高,该类靶向药物在亚洲肺腺癌患者所取得的疗效高于西方人群。但随着应用的增加,耐药问题逐渐凸显,复发和转移患者增加,且其对EGFR非突变患者几乎无效。因此,仍需继续探讨肺腺癌的发病机制,寻找新的治疗靶点,以提高患者的临床疗效。
研究表明,肿瘤的复发与转移与肿瘤细胞的侵袭、迁移能力增强显著相关,而EMT在其中起关键性作用。生理状态下,EMT对于胚胎发育、组织发生等起重要作用;而如果肿瘤细胞发生EMT,细胞极性就会降低,细胞间的黏附蛋白大量丢失而细胞间质大量增加。由于肿瘤细胞的黏附力下降,且与周围的细胞接触减少,其运动和迁移能力增强,从而促进了肿瘤的侵袭、转移。E-cadherin是一种上皮细胞标志蛋白,其对维持细胞间的紧密连接具有重要作用,可阻止细胞的运动和迁移;研究发现,敲除E-cadherin表达的转基因小鼠,可诱导EMT发生导致肿瘤转移[5]。相反,Vimentin是一种间质细胞标志蛋白,其对维持细胞骨架的完整性具有重要作用。大量研究发现,肿瘤发生EMT时,细胞中Vimentin表达增高,细胞的运动迁移能力增强[6]。
HOX基因是同源异型盒家族的一员,可分为HOXA、HOXB、HOXC、HOXD基因簇。该基因所表达的蛋白通过其序列特异性与相关的DNA结合,从而调控胚胎发育和细胞生长、分化[7]。HOTTIP定位于染色体7p15.2上,全长3 764 nt,是一种新发现的lncRNA[8]。因其定位于HOXA 染色体的5′端,沉默HOTTIP会抑制位于HOXA 5′端基因的表达而得名。HOTTIP的抑制效应与距离有关,对距其最近的HOXA13、HOXA11基因抑制效应最强,其次是HOXA10、HOXA9、HOXA7基因[9];在肿瘤细胞中也基本遵循这一规律,如肝癌、胃癌及胰腺癌等[5,10],但也有少量不同的报道[11],这种差异可能与肿瘤的组织类型选取、实验条件不同等有关。Li等[12]发现,敲除胰腺癌细胞HOTTIP基因,可以抑制EMT,进而减弱肿瘤细胞的侵袭能力。在动物实验中,抑制裸鼠体内HOTTIP基因表达,能够减缓结直肠癌的生长速度,该作用可能与沉默HOTTIP后p21基因表达上调进而抑制肿瘤细胞增殖有关[13]。由此可见,HOTTIP具有促癌基因的特性。
在非小细胞肺癌(NSCLC)组织和不同肺癌细胞株中,均发现HOTTIP表达升高,而HOTTIP高表达患者的淋巴结转移数目多、TNM分期高且预后较差。采用RNA干扰技术降表达NSCLC细胞中的HOTTIP,可抑制肿瘤细胞增殖并减缓小鼠腹腔移植瘤的生长速度,认为该作用是通过调控Bax/Bcl2这一细胞凋亡的分子开关实现的[14]。另有研究发现,沉默HOTTIP 基因能够下调其靶向基因HOXA13表达,从而参与肺癌的发生发展[15]。杨莉等[16]研究发现,在肺癌组织和细胞中HOTTIP表达增高,且与肿瘤大小、淋巴结转移和TNM分期呈正相关;体外细胞学分析显示,促HOTTIP表达可促进肺癌细胞95-D、A549增殖,而降表达后则能诱导肺癌细胞凋亡。这与周发忱等[14]的研究结论相一致。然而,以上研究均未观察HOTTIP对肺癌细胞侵袭及转移的影响。本研究以肺腺癌A549细胞为研究对象,通过感染携带HOTTIP-shRNA、HOTTIP全长序列的慢病毒及空白慢病毒;结果显示,HOTTIP-shRNA组穿膜细胞的数量、细胞迁移率低于空载对照组,而HOTTIP组穿膜细胞的数量、细胞迁移率多于空载对照组和HOTTIP-shRNA组,差异均有统计学意义。Western blotting实验显示,HOTTIP-shRNA组细胞Vimentin表达较空载对照组减少、E-cadherin表达较空载对照组增加,差异有统计学意义;HOTTIP组Vimentin表达较空载对照组增加、E-cadherin表达较空载对照组减少。因此,HOTTIP可增强肺腺癌A549细胞侵袭转移能力,可能与其调控Vimentin、E-cadherin蛋白表达,从而促进EMT形成有关。可见,HOTTIP可作为肺腺癌靶向治疗的新靶点,为提高患者的治疗效果提供了新的研究方向。

