海带多糖L01对脂多糖作用下人脑微血管内皮细胞一氧化氮释放水平的影响及机制
王靳琎,魏英,钱航,黄慧敏,余飞,陈琴华,3,谢露
1 广西医科大学,南宁530021;2 湖北医药学院附属东风医院;3 武当特色中药研究湖北省重点实验室
脑微血管内皮细胞(BMEC)是构成血脑屏障(BBB)的重要细胞,因细胞间的紧密连接和有限的囊泡转运通量,使BBB可以阻止多种有害物质由血液进入脑循环,从而保持脑组织内环境的基本稳定[1~3]。BBB的破坏是创伤或炎症后的一个突出特征,其发生发展与血管渗透性改变有关[4,5]。一氧化氮(NO)是调节BBB通透性的重要介质,参与化脓性脑膜炎相关的急性病理生理过程[6]。前期研究发现,在慢性炎症大鼠模型中,海带多糖L01有保护外周血管内皮细胞的作用,但其对脑血管内皮炎症损伤的抵抗少有研究。2017年8月~2018年10月,我们观察了海带多糖L01对脂多糖(LPS)作用下人脑微血管内皮细胞(HBMEC)NO释放水平的影响,并通过检测内皮型一氧化氮合酶(eNOS)、诱导型一氧化氮合酶(iNOS)表达探讨其影响的机制,旨在研究其对炎症刺激下脑血管内皮细胞的保护作用。
1 材料与方法
1.1 材料 细胞系:HBMEC购于Sciencell公司,复苏后于37 ℃、5% CO2培养箱中静置培养,传至3~4代。药品与试剂:海带多糖由本课题组自行提取,其糖含量占71.0%、硫酸根含量为83.28 mg/g;无菌生盐水稀释后备用;DMEM培养基、胰蛋白酶购自德国Gibco公司;胎牛血清购自杭州四季青公司;大肠杆菌LPS(血清型O55:B5)购自美国Sigma公司;TRIzol Reagent购自美国Life Technologies公司;逆转录试剂盒购自美国Thermo公司;NO检测试剂盒、RIPA裂解液购自碧云天生物公司;HRP标记羊抗兔二抗购自博士德公司;PCR引物由上海生工生物工程公司合成。主要仪器:外排式生物安全柜(安泰空气技术有限公司);实时荧光定量PCR仪(杭州博日科技有限公司);CO2培养箱(美国耐普克公司);超高速低温离心机(德国艾本德公司)。
1.2 方法
1.2.1 细胞培养与分组处理 取第3代HBMEC,用10%胎牛血清培养液制成1×105/mL细胞悬液;以1×105/孔接种24孔培养板,于37 ℃、5% CO2培养箱中培养24 h。待细胞基本融合处于对数生长期时,将其随机分为6组。空白对照组不处理,LPS组加入40 μg/mL LPS,L01对照组加入100 μg/mL L01,L01低、中、高剂量组分别加入40 μg/mL LPS+1、10、100 μg/mL L01,共同孵育48 h。
1.2.2 细胞NO检测 收集各组细胞培养液,采用ELISA法检测NO,按照试剂盒说明书操作。
1.2.3 细胞eNOS、iNOS mRNA检测 采用实时荧光定量PCR法。收集各组细胞,用TRIzol法提取细胞总RNA,按照逆转录试剂盒操作步骤合成cDNA。采用实时荧光定量PCR技术检测各组细胞中eNOS、iNOS mRNA的表达。引物序列:eNOS上游为5′-CCTGACAACCCCAAGACCTAC-3′、下游为5′-TAACATCGCCGCAGACAAAC-3′,长度为112 bp;iNOS上游为5′-CGTGTTTCACCAGGAGATG-3′、下游为5′-CAGCATACAGGCAAAGAGC-3′,长度为163 bp;β-actin上游为5′-ATCTGGCACCACACCTTC-3′、下游为5′-AGCCAGGTCCAGACGCA-3′,长度为291 bp;反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃,30 s,40个循环;72 ℃ 5 min。以β-actin为内参基因,以2-ΔΔCt法表示eNOS、iNOS mRNA相对表达量。ΔΔCt =(Ct目的基因-Ct内参基因)实验组-(Ct目的基因-Ct内参基因)对照组。
1.2.4 细胞eNOS、iNOS蛋白检测 采用Western blotting法。取各组细胞,吸弃上清;PBS洗净后,加入RIPA裂解液(1% PMSF),置于冰上裂解至少30 min;4 ℃下以12 000 r/min离心10 min,取上清,用BCA试剂盒测定蛋白浓度。取总量为20 μg的蛋白样品,加入样品缓冲液,沸水浴10 min;进行SDS-PAGE分离,转膜。用含5%脱脂牛奶的TBST封闭后,分别加入一抗(GAPDH、p-eNOS、t-eNOS为1∶1 000,iNOS为1∶500),4 ℃孵育过夜;用TBST洗膜后加入第二抗体(1∶50 000),37 ℃孵育2 h;用TBST洗膜后进行ECL显色,用BandScan软件分析胶片灰度值。以目的蛋白与内参GAPDH条带灰度比值作为目的蛋白相对表达量,以p-eNOS与t-eNOS比值作为p-eNOS相对表达量。
2 结果
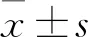
2.1 各组NO释放水平比较 LPS组NO为(18.802±1.495)μmol/L,高于空白对照组的(12.506±0.609)μmol/L(P<0.01);L01低、中、高剂量组NO分别为(14.662±0.487)、(14.144±0.334)、(14.078±0.523)μmol/L,均低于LPS组(P均<0.01);L01对照组NO为(13.277±0.487)μmol/L,与空白对照组间差异无统计学意义。
2.2 各组eNOS、iNOS mRNA表达比较 与空白对照组比较,LPS组eNOS mRNA表达降低而iNOS mRNA表达增加(P均<0.01);与LPS组比较,L01中、高剂量组eNOS mRNA表达增加而高剂量组iNOS mRNA表达降低(P均<0.01)。见表1。

表1 各组eNOS、iNOS mRNA表达比较
注:与空白对照组比较,*P<0.01;与LPS组比较,#P<0.01。
2.3 各组eNOS、iNOS蛋白表达比较 与空白对照组比较,LPS组eNOS和p-eNOS蛋白表达降低而iNOS蛋白表达增加(P均<0.01);与LPS组比较,L01高剂量组eNOS蛋白和中、高剂量组p-eNOS蛋白表达增加,中、高剂量组iNOS蛋白表达降低(P均<0.01)。见表2。

表2 各组eNOS、iNOS蛋白表达比较
注:与空白对照组比较,*P<0.01;与LPS组比较,#P<0.01。
3 讨论
LPS是内毒素的主要成分,由其介导的病理与生理变化在慢性炎症的发生、发展过程中起至关重要的作用。LPS能够诱导粒细胞、肠上皮细胞以及血管内皮细胞分泌炎性细胞因子,从而促进炎症的发展[7]。
BMEC是组成BBB的主要成分,可维持脑组织内部环境的稳定,内皮功能障碍是缺血性脑血管损伤发病的早期事件。在生理状态下,血管内皮细胞维持NO的释放,在脑血流调节和脑血管保护中起重要作用。越来越多的证据表明,NO是脑血管通透性的重要调节因子[8]。此外,在细菌性脑膜炎的动物模型以及患者中,均观察到NO生成增加[9]。本研究采用LPS刺激HBMEC后可引起上清液NO水平增高,而加入不同剂量海带多糖L01共孵育的细胞上清液NO水平降低,提示海带多糖L01对NO的释放具有调控作用。
研究发现,神经型NOS和eNOS均可在成人大脑中表达;iNOS在静息细胞中并不表达,但在LPS、细菌和促炎细胞因子刺激下而迅速被激活[10]。一经诱导,iNOS合成的NO是eNOS催化所产生NO的100~1 000倍甚至更多,并且持续时间更长。在动物模型中,如沙门菌病、利什曼病和结核病的感染部位均发现iNOS表达增多[11]。在本研究中,加入LPS刺激后,可观察到eNOS mRNA表达下降、iNOS mRNA表达上升,而海带多糖L01可拮抗这种变化。同时,我们采用Western blotting法测定eNOS及iNOS蛋白,与空白对照组比较,LPS组eNOS蛋白表达下降、iNOS蛋白表达升高;与LPS组比较,海带多糖L01组可升高eNOS蛋白表达、降低iNOS蛋白表达。
eNOS的活性调节是相当复杂的过程,包括了转录、翻译以及翻译后修饰。在生理刺激和病理情况下,翻译后修饰会动态调控酶的活性[12,13],而最主要的翻译后修饰过程是蛋白激酶介导的磷酸化和去磷酸化[14]。磷酸化作为一种翻译后修饰,通过激酶向eNOS中添加一个磷酸盐基团,从而调节酶的活性。eNOS可以在丝氨酸、苏氨酸和酪氨酸残基上磷酸化或去磷酸化,显示了磷酸化在调节eNOS活性中的作用。不同的磷酸化位点会产生不同甚至相反的调节效果,目前有许多公认的磷酸化位点,但最主要的磷酸化位点包括还原酶结构域中丝氨酸残基(人丝氨酸-1177、牛丝氨酸-1179)和钙调素结合结构域内的苏氨酸残基(人苏氨酸-495、牛苏氨酸-497)[15]。丝氨酸-1177(Ser1177)的磷酸化激活了eNOS活性,而苏氨酸-495(Thr495)的磷酸化则会抑制酶活性。换而言之,Ser1177是eNOS的正性磷酸化调节位点,而Thr495则是eNOS的负性磷酸化调节位点。Heiss等[16]发现,在未经任何刺激的内皮细胞中,Ser1177位点处于去磷酸化状态;当受到刺激(如剪切应力、雌激素等)时,该位点则会迅速磷酸化,使eNOS羧基末端结构发生改变,从而提高eNOS的活性。本研究测定的是eNOS磷酸化位点Ser1177的蛋白表达水平,与对照组比较,LPS组Ser1177蛋白表达量下降,也进一步验证了LPS组eNOS蛋白活性下降的结果;与LPS组比较,海带多糖L01组Ser1177蛋白表达量有所升高,该结果与测定的eNOS蛋白活性相一致。
在炎症反应中,NO生成可能降低也可能升高,因不同细胞和不同的炎症强度而不同。如以eNOS表达和活化受损为主,则NO生成减少;如以iNOS表达和活性强化为主,则NO生成增多。因此,NO过度产生既是炎症反应的结果,也是炎症损害的因素。过量NO促进组织氧自由基生成,继而引起细胞死亡。本研究显示,海带多糖L01有效地逆转了LPS对HBMEC eNOS表达和活化的抑制及对iNOS表达的促进影响,使NO生成减少。因此,我们认为海带多糖L01能够维护BBB稳态,有利于提高脑组织抵抗炎症损伤的能力。

