丹参酮IIA对动脉粥样硬化C57小鼠血脂水平的影响观察
罗炬辉 陈友权 何德全 龙信聪
1.广州市白云区第二人民医院重症医学科,广东广州 510450;2.广州医科大学附属第三医院心内科,广东广州 510150;3.广州市白云区第二人民医院内科,广东广州 510450
动脉粥样硬化是动脉血管发生炎症后出现的一种疾病,近年来临床上较为常见,动脉粥样硬化会发生血管内皮障碍、炎症因子激活后一系列炎症反应、血脂脂质混乱,形成血栓等[1],是很多心脑血管疾病的基础疾病,如缺血性脑卒中、冠心病、心力衰竭等一系列疾病。丹参酮IIA是一种近年来较为热点的丹参酮型的二萜类化合物,是丹参中较为重要的脂溶成分[2],主要提取于丹参,有研究显示丹参酮IIA,具有优越的生理活性,在抗炎及抑菌、清除自由基、抗氧化方面保护肝脏,并具有改善功能、抗癌、改善血液循环等功效,其对心脑血管的作用为目前临床研究热点[3-4]。因此,本研究就丹参酮IIA 对动脉粥样硬化C57小鼠血脂水平影响进行探究,如下。
1 材料与方法
1.1 实验动物
雄性C57大鼠30只,体重180~220g,无任何头部颈部淤血等外伤。购于中国科学院上海斯莱克实验动物有限公司,动物许可证号:XYZW(粤)2017-2021。大鼠分笼饲养、自由摄食饮水。实验研究时间为2019年4~10月,实验均经我院医学伦理委员会审核通过,本实验过程严格按照国际疼痛研究协会(IASP)关于进行动物疼痛实验的纲要实施完成[5]。采用随机数字表法将大鼠分3组,每组10只。
1.2 药品、试剂及仪器
丹参酮IIA(上海上药第一生化,批号:1903104),ELISA试剂盒(美国BOSTER公司,货号:EK0411、A00101、EK0527),逆转录试剂盒购自(Promega公司,货号:A5001),TB GreenTMPremix ExTaq Ⅱ试剂盒购自(TakaRa公司,货号:RR820AA),PVDF膜(Millipore公司,货号:IPVH00010),免疫组化试剂盒(北京中衫金桥,货号:SPN-9001)。
1.3 实验分组
对照组:正常喂养,不进行动脉粥样硬化造模、不给予丹参酮IIA;模型组:进行动脉粥样硬化造模但不给予丹参酮IIA;丹参酮组:进行动脉粥样硬化造模并给予丹参酮IIA。于造模后第7天,对照组正常喂养8周;模型组:腹腔注射生理盐水,15mg/kg,1次/d,共8周;丹参酮组给予丹参酮IIA,腹腔注射 15mg/kg,1次/d,共8周。所有小鼠喂养8周后处死取材。
1.4 大鼠动脉粥样硬化模型的制作[6]
对敲除apoE-/-(载脂蛋白E基因)的20只小鼠注射低剂量(2×10PFU)d的感染MCMV(低剂量巨细胞病毒),在慢性潜伏感染阶段,MCMV感染可以明显加重Apoe(载脂蛋白E)基因缺陷小鼠主动脉粥样硬化病变,并使重度动脉粥样硬化病变提前出现。随机分为模型组与丹参酮组,各10只。造模第7天随机抽取模型组与丹参酮组大鼠,于眼眦取血后检测血脂水平以判断造模成功。
1.5 测定指标
比较8周后,三组炎症因子水平包含巨噬细胞包含白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)、肿瘤坏死因子(TNF-α)、CD3,成熟T淋巴细胞表面标志(T细胞)含量、血脂水平包含高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、三酰甘油(TG)、血清总胆固醇(TC)。
1.6 统计学方法
研究数据采用 SPSS22.0统计学软件进行分析,多组间及同组不同时间点的计量资料用()表示,采用方差分析,两两比较采用SNK-q进行检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 三组患者炎症因子水平比较
与对照组比较,丹参酮组、模型组的炎症因子TNF-α、IL-1β、IL-6 水平均明显升高,差异有统计学意义(P<0.05),见表1。
表1 三组患者炎症因子水平比较(±s,pg/mL)

表1 三组患者炎症因子水平比较(±s,pg/mL)
注:与对照组比较,*P<0.001
组别 IL-6 IL-1β TNF-α丹参酮组 45.46±8.18* 19.27±2.35* 23.74±6.73*模型组 185.74±54.56* 33.21±12.20* 39.63±15.72*对照组 23.45±15.23 13.65±2.65 7.26±1.54 F 35.490 9.426 13.331 P<0.001 <0.05 <0.05
2.2 三组患者巨噬细胞、T 细胞细胞含量比较
入组第1天三组的巨噬细胞、T细胞比较,差异无统计学意义(P>0.05);造模8周后,与对照组比较,丹参酮组、模型组的巨噬细胞百分比均减少,差异有统计学意义(P<0.05);造模8周后,与对照组比较,丹参酮组、模型组的CD3细胞百分比均减少,差异有统计学意义(P<0.05),见表2。
2.3 三组患者血脂水平比较
入组第1天三组的HDL-C、LDL-C、TG、TC上的差异无统计学意义(P>0.05);造模1周后,与对照组比较,丹参酮组、模型组的HDL-C水平降低,LDL-C、TG、TC升高,差异有统计学意义(P<0.05);造模8周后,对照组与丹参酮组的HDL-C水平较模型组均高于模型组,LDL-C、TG、TC水平均低于模型组,差异有统计学意义(P<0.05),见表3。
3 讨论
建立动脉粥样硬化的动物模型中,大鼠具有可同时检测多种指标、价格低廉、血量丰富、免疫系统完善等优点,C57小鼠在引发诱导性肥胖、2型糖尿病及粥样动脉硬化等有明显优势,因此本研究就用C57大鼠建立动脉粥样硬化模型[7-8],研究丹参酮IIA对动脉粥样硬化血脂水平的影响观察。有研究显示,当血脂含量过高时,血脂依附于血管后会在血管壁形成脂质条纹,沉积过多后造成血管堵塞或血管狭窄[9]。一般情况下LDL会进入系膜区后,由系膜细胞或吞噬细胞通过其表面受体进行清除,但如果沉积程度超过LDL的清除能力,就会造成脂蛋白沉积发生,加重动脉粥样硬化的病变程度[10]。
表2 三组患者巨噬细胞、T细胞细胞含量比较(±s,%)
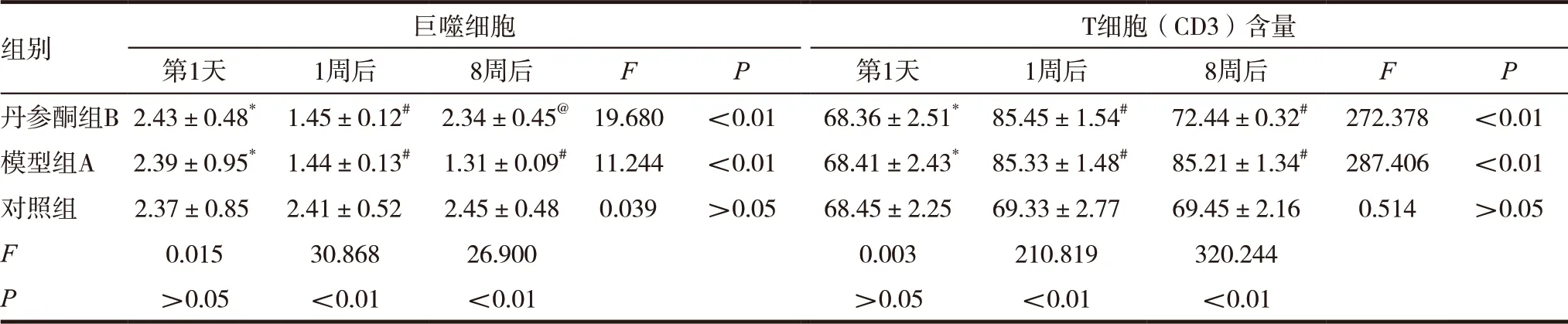
表2 三组患者巨噬细胞、T细胞细胞含量比较(±s,%)
注:与对照组比较,*P>0.05,#P<0.001,@P>0.05
组别 巨噬细胞 T细胞(CD3)含量第1天 1周后 8周后 F P 第1天 1周后 8周后 F P丹参酮组B2.43±0.48* 1.45±0.12# 2.34±0.45@ 19.680 <0.01 68.36±2.51* 85.45±1.54# 72.44±0.32# 272.378 <0.01模型组A 2.39±0.95* 1.44±0.13# 1.31±0.09# 11.244 <0.01 68.41±2.43* 85.33±1.48# 85.21±1.34# 287.406 <0.01对照组 2.37±0.85 2.41±0.52 2.45±0.48 0.039 >0.05 68.45±2.25 69.33±2.77 69.45±2.16 0.514 >0.05 F 0.015 30.868 26.900 0.003 210.819 320.244 P>0.05 <0.01 <0.01 >0.05 <0.01 <0.01
表3 三组患者血脂水平比较 (±s)
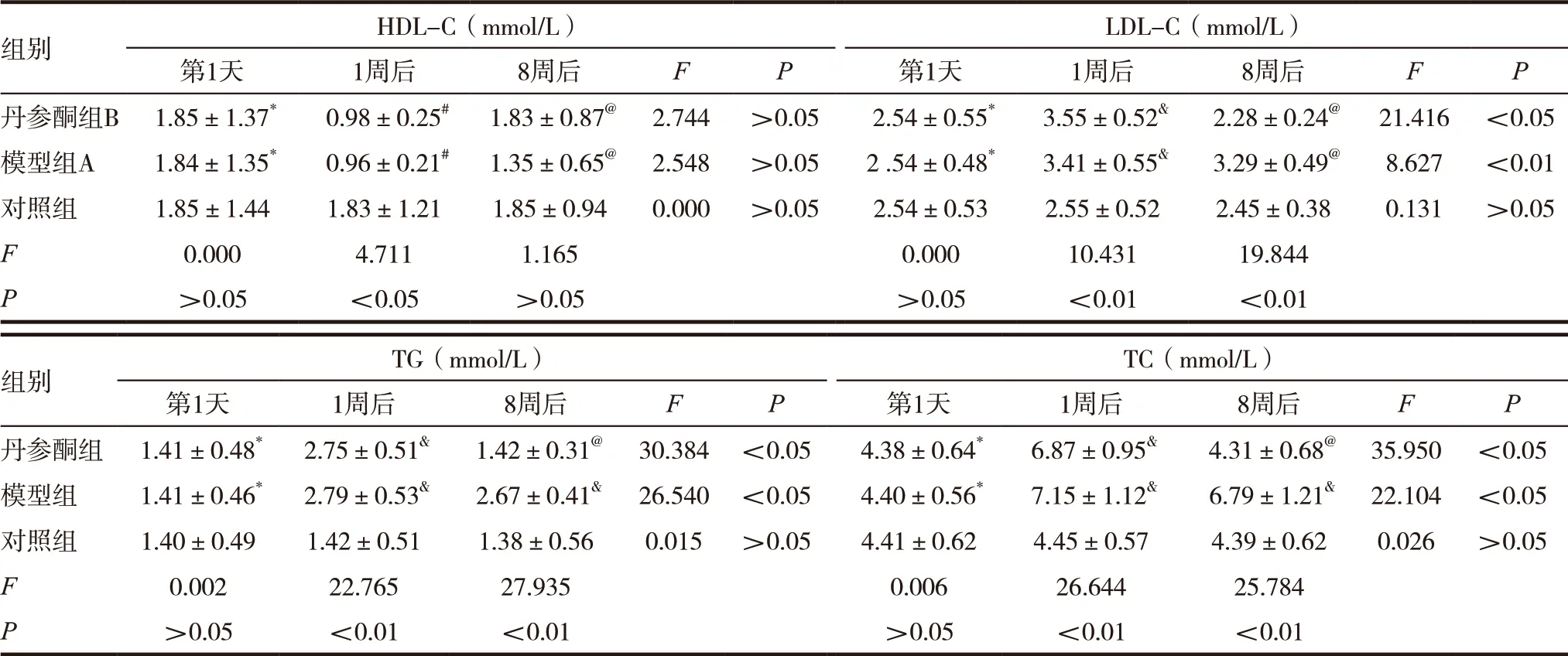
表3 三组患者血脂水平比较 (±s)
注:与对照组比较,*P>0.05,#P<0.05,@P>0.05,&P<0.01
组别 HDL-C(mmol/L) LDL-C(mmol/L)第1天 1周后 8周后 F P 第1天 1周后 8周后 F P丹参酮组B 1.85±1.37* 0.98±0.25# 1.83±0.87@ 2.744 >0.05 2.54±0.55* 3.55±0.52& 2.28±0.24@ 21.416 <0.05模型组A 1.84±1.35* 0.96±0.21# 1.35±0.65@ 2.548 >0.05 2 .54±0.48* 3.41±0.55& 3.29±0.49@ 8.627 <0.01对照组 1.85±1.44 1.83±1.21 1.85±0.94 0.000 >0.05 2.54±0.53 2.55±0.52 2.45±0.38 0.131 >0.05 F 0.000 4.711 1.165 0.000 10.431 19.844 P>0.05 <0.05 >0.05 >0.05 <0.01 <0.01组别 TG(mmol/L) TC(mmol/L)第1天 1周后 8周后 F P 第1天 1周后 8周后 F P丹参酮组 1.41±0.48* 2.75±0.51& 1.42±0.31@ 30.384 <0.05 4.38±0.64* 6.87±0.95& 4.31±0.68@ 35.950 <0.05模型组 1.41±0.46* 2.79±0.53& 2.67±0.41& 26.540 <0.05 4.40±0.56* 7.15±1.12& 6.79±1.21& 22.104 <0.05对照组 1.40±0.49 1.42±0.51 1.38±0.56 0.015 >0.05 4.41±0.62 4.45±0.57 4.39±0.62 0.026 >0.05 F 0.002 22.765 27.935 0.006 26.644 25.784 P>0.05 <0.01 <0.01 >0.05 <0.01 <0.01
本研究显示,造模后的小鼠出现炎症因子水平升高、巨噬细胞、CD3细胞百分比均减少等情况,给予丹参酮IIA 8周后的小鼠炎症因子水平较注射生理盐水的小鼠,炎症因子水平恢复至与对照组持平的水平,原因可能为动脉粥样硬化是一种慢性炎症性疾病,炎症因子、黏附分子等表达增加,驱使炎症细胞向动脉内膜迁移,加速动脉粥样硬化的发生及发展,并且炎症细胞和血管内皮细胞的黏附是炎症反应发生关键步骤之一[11-12]。增多的黏附分子募集更多炎症细胞向动脉内膜迁移后加速血管内皮的损伤,被认为是动脉粥样硬化形成的始动环节[13-14]。而研究结果显示丹参酮 IIA 能减少血管中炎症因子的表达,从而减少炎症细胞及黏附分子的表达及迁移,以降低动脉粥样硬化进行与发展。本研究结果还显示,使用丹参酮IIA 的小鼠的HDL-C高于注射生理盐水的小鼠,LDL-C、TC、TG水平低于注射生理盐水的小鼠,原因为LDL为人体内胆固醇运输的主要载体,血管中的TC 和LDL升高,人体内皮细胞受到刺激后,产生大量的自由基后LDL就会被氧化产生脂蛋白(Ox-LDL),Ox-LDL的不断增加则会使血管内皮受到损伤,使炎症反应就一步加重,丹参酮IIA在被吸收后减少血管中Ox-LDL的生成,因此LDL-C、TC、TG水平均呈下降,对血管内皮起到一定的保护作用,加之对炎症细胞等细胞因子的调节,对粥样动脉硬化的炎症反应起到一定抑制作用[15]。因此随着炎症因子被抑制,体细胞产生的淋巴因子也降低趋势,随之巨噬细胞恢复正常水平。
综上所述,丹参酮IIA可以保护动脉内皮功能,降低动脉粥样硬化小鼠的炎症反应,恢复免疫系统的同时改善血脂水平。

