铝胁迫造成橡胶苗死亡的机制研究
张婷婷 刘子凡 安锋 谢贵水

摘 要:铝毒是酸性土壤中抑制植物生长和产量的主要因子,但其对橡胶幼苗生长的影响研究甚少。本研究设置50、100、200 mmol/L 3种Al3+处理浓度,采用水培试验研究了铝胁迫下橡胶幼苗叶片叶绿素含量、叶片相对含水量、根系活力、根系导水率、H2O2和O2?含量变化。结果表明:叶片SPAD值、叶片相对含水量、根系活力、根系导水率随胁迫时间的延长而逐渐降低,H2O2和O2?含量则逐渐增加,且浓度越高对各个指标的影响越显著。铝毒害可造成根系活性氧(H2O2和O2?)的累积,进而造成根系活力和导水率下降,叶片SPAD值和相对含水量下降,最终导致橡胶幼苗死亡。
关键词:铝毒;橡胶苗;SPAD值;根系活力;根系导水率;活性氧
中图分类号:S718.43 文献标识码:A
Abstract: Aluminum toxicity is a main factor that inhibits plant growth and productivity in acid soils, leaf relative water content, root activity, root hydraulic conductivity, H2O2, and O2? content were studied by hydroponic experiments. The results showed that the leaf SPAD value, leaf relative water content, root activity and root hydraulic conductivity gradually decreased with the prolonged stress time, and the contents of H2O2 and O2? gradually increased, the higher the concentration, the more significant impact of each index. Taking together, the results showed that aluminum could cause the accumulation of active oxygen species (H2O2 and O2?) in the rubber tree root system, which in turn led to a decreased in root activity and water hydraulic conductivity, resulting in a decrease in leaf SPAD value and relative water content, and eventually the death of rubber tree saplings.
Keywords: aluminum toxicity; rubber tree saplings; SPAD value; root activity; root hydraulic conductivity; active oxygen species
DOI: 10.3969/j.issn.1000-2561.2020.12.010
铝(Al)在地壳中含量极为丰富,自然情况下生物可利用性不高[1]。但在酸性环境下(pH<5.0),土壤中难溶的铝转变为游离的铝离子对植物生长造成损害,截至目前,我国酸性土壤的面积约占全国可耕土壤面积的21%[2]。铝毒成为抑制作物生长的主要因素[3-4]。前人已有研究表明,铝胁迫对桉树(Eucalyptus robusta)[5]、茶树(Camellia sinensis)[6-7]、玉米(Zea mays)[8]、水稻(Oryza sativa)[9]、大豆(Glycine max)[10]、大麦(Hordeum vulgare L)[11]、马尾松(Pinus massoniana)[12]等作物生长有抑制作用。铝毒害最先作用于与其直接接触的植物根系[13-14],最明显的特征是:根尖膨大、根系伸长受阻、根系活力及根系导水率降低[15-16]。而叶绿素在植物光合作用中充当着相当重要的角色,光合作用的强弱直接取决于叶绿素含量的高低[17]。由于植物体内叶绿素对铝胁迫的敏感性[18],植物受铝毒的损害程度常可通过植物体内的叶绿素含量反映[19]。有研究发现,铝毒害可以降低叶片叶绿素含量、抑制植物光合作用,进而对植物的生长产生影响[20],但只有超过相应的阈值才会抑制植物的生长[21]。
橡胶树(Hevea brasiliensis)原产于巴西亚马逊河流域[22],是目前唯一大面积商业化种植生产天然橡胶的树种,在中国主要种植于南方的云南、广东以及海南[23],该区土壤环境多为酸性,因此橡胶树在其生长过程中难以避免地出现铝毒害的现象,张晗等[24]、安锋等[25]通过盆栽试验研究了铝胁迫对橡胶幼苗叶绿素荧光、膜脂过氧化、丙二醛、过氧化物酶等相关生理指标的影响,发现200~400 mmol/L高浓度铝胁迫处理会导致橡胶苗抗氧化防御系统被破坏,显著降低了活性氧清除相关酶的活性以及叶绿素含量和荧光特性;橡胶苗细胞质膜透性、MDA、叶片游离脯氨酸和可溶性糖含量显著提高,并在处理3~5 d后死亡,推测铝胁迫下活性氧的积累可能造成橡胶苗活性氧清除系统破坏、根系导水率下降、叶片干枯进而造成橡胶幼苗死亡,但并未对铝胁迫下橡胶幼苗根系活性、根系导水率以及活性氧(H2O2和O2?)含量进行直接测定。为此,本研究设置不同浓度铝胁迫,测定了铝胁迫下橡胶幼苗叶片相对含水量、根系活性、根系导水率和根系活性氧(H2O2和O2?)含量的变化,以期阐明铝胁迫造成橡胶幼苗死亡的机制,为橡胶园土壤改良、橡胶树耐铝品种的选择和栽培提供依据。
1 材料与方法
1.1 材料
橡胶幼苗为‘热研7-33-97无性系组培苗,由中国热带农业科学院橡胶研究所提供。
1.2 方法
1.2.1 试验设计 试验于2019年6至10月在海南省海口市中国热带农业科学院橡胶研究所恒温培养箱内进行。恒温培养箱设白天温度25 ℃、晚上温度20 ℃,光照12 h,强度400 μmol/m2·s。取沙培2蓬叶的橡胶组培苗,洗净,移至装有5 L营养液的桶中预培养,桶的规格为:上部直径29 cm,下部直径21 cm,高20 cm,预培养的营养液为:含有40 μmol/L AlCl3·6H2O(防止铝处理可能出现的休克作用[26])pH 5.5的Hoagland营养液[配方:2.8 mg/L H3BO3,3.4 mg/L MnSO4·H2O,0.1 mg/L CuSO4·5H2O,0.22 mg/L ZnSO4·7H2O,0.1 mg/L (NH4)6Mo7O24·4H2O,6.72 mg/L Na2EDTA,5.58 mg/L FeSO4·7H2O,9.4 mg/L Ca(NO3)2·4H2O,5.2 mg/L MgSO4·7H2O,6.6 mg/L KNO3,1.2 mg/L NH4H2PO4,现配现用],连续增氧通气,每3 d更换一次营养液,培养5 d。
每个处理16株苗,设置3种Al3+浓度处理,并以不加Al3+ pH为5.5和4.2的T1、T2为对照,因为在前期大田调研发现,胶园土壤pH为5.5,极端条件下为4.2。此外,也为排除培养液pH变化对橡胶幼苗生长的影响(详见表1),分别在处理6、24、48、72、96 h后测定相关生理生化指标。
1.2.2 项目测定 每个处理取苗4株,剪下所有叶片和根系,测定其鲜重和烘干后干重。计算出相对含水量。叶绿素含量用SPAD-502叶绿素仪(Konica-Minota, Tokyo, 日本)测定,用SPAD值表示。根系活力测定采用TTC法[27];根系导水率的测定采用压力室法[28];过氧化氢(H2O2)含量采用北京索莱宝生物公司提供的过氧化氢检测试剂盒(微量法)进行测定;超氧阴离子(O2?)含量采用羟胺氧化法[29]测定。
1.3 数据处理
采用SAS 9.4软件的Duncan新复极差法对测定数据进行单因素方差分析(P<0.05),用Origin 2016和Excel软件作图。
2 结果与分析
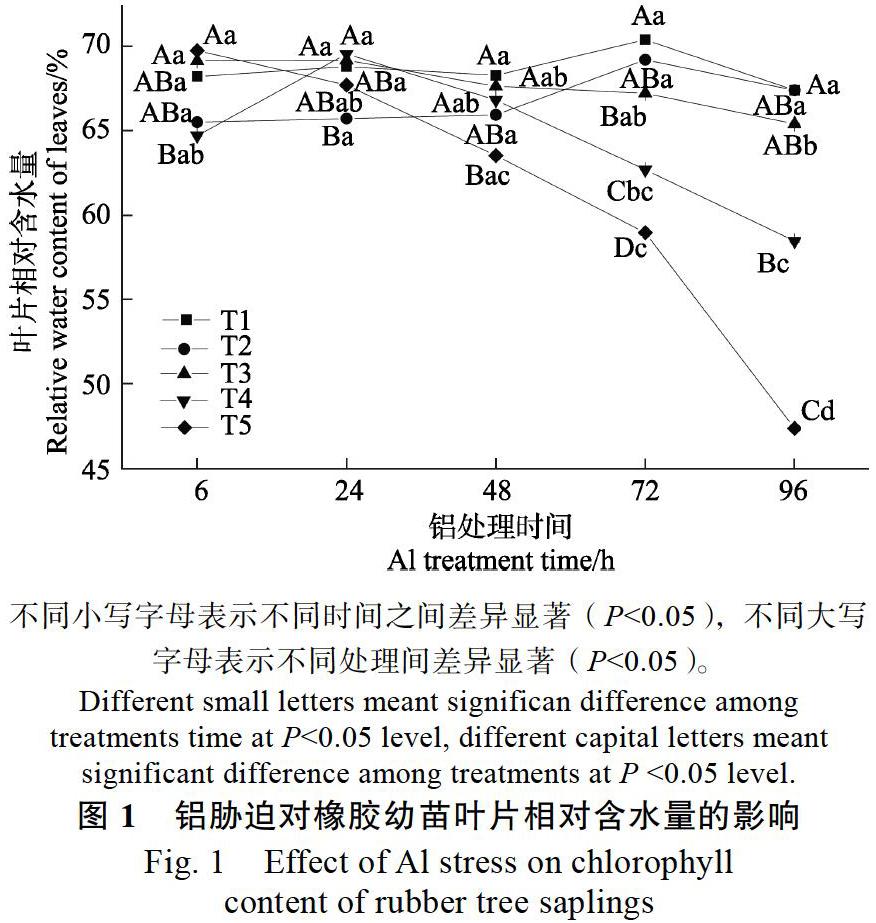
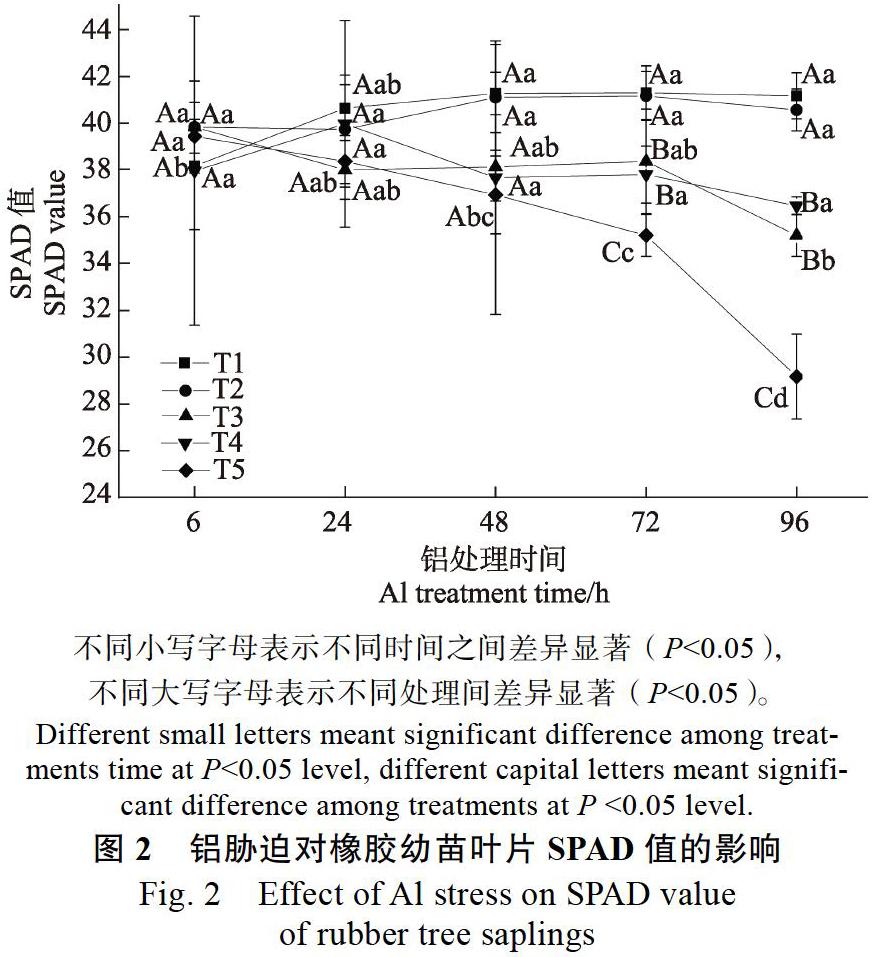
2.1 铝胁迫对橡胶苗叶片SPAD值及相对含水量的影响
由图1、图2可以看出,与T1处理相比,T2处理对橡胶幼苗叶片SPAD值及叶片相对含水量无显著影响,说明处理液酸度由5.5降至4.2不会影响橡胶幼苗叶片SPAD值和相对含水量。而在不同浓度铝胁迫下橡胶幼苗叶片SPAD值及叶片相对含水量均会出现不同程度的下降。各浓度铝处理下,胁迫24 h前对橡胶幼苗叶片相对含水量和SPAD值的影响均不显著,但铝胁迫下均随着处理时间的延长呈下降趋势。T3铝处理96 h时,叶片相对含水量显著降低;T4胁迫72 h,橡胶幼苗叶片相对含水量就显著降低;而胁迫浓度为T5时,处理48 h便可显著降低橡胶幼苗叶片相对含水量。铝处理对叶片SPAD值的影响略有不同,胁迫浓度为T4时,处理96 h显著降低SPAD值;T5胁迫72 h时,显著降低叶片SPAD值。其中,铝离子胁迫浓度为T5时,对橡胶幼苗叶片SPAD值和叶片相对含水量的影响最为显著,在铝胁迫48 h后显著降低,叶片SPAD值在T5铝胁迫处理48、72、96 h时,分别比同一pH值T2未加铝处理6 h时的叶片SPAD值降低了6.3%、10.7%和26.0%,而叶片相对含水量比同一pH值T2未加铝处理6 h时降低了9.0%、15.0%、32.0%。说明高浓度铝胁迫会降低橡胶幼苗叶片SPAD值及葉片相对含水量,且抑制作用随时间的延长而逐渐加强。
2.2 铝胁迫对橡胶苗根系活力和根系导水率的影响
叶片相对含水量和SPAD值的下降可能由于根系活力的下降引起,为此我们比较了不同浓度铝胁迫对橡胶苗根系活力的影响。由表2可以看出,与T1相比,T2溶液处理对根系活力有一定的促进作用或没有显著影响。而铝胁迫处理则会使橡胶幼苗根系活力均显著下降。而且T4、T5浓度下根系活力显著低于T3,但T4和T5浓度之间差异不显著。在根系活力随铝胁迫处理时间的变化方面,T1、T2、T3、T4铝胁迫处理24 h时,橡胶幼苗根系活力较处理6 h有所提高,增幅分别为50.43%、50.49%、33.24%、17.05%,表明相同处理时间铝毒害对橡胶幼苗根系活力的影响强于培养液酸度的变化,而随后T3、T4随着处理时间的延长根系活力受到抑制而降低; T3铝处理96 h橡胶苗根系活力显著降低;T4处理72 h后橡胶幼苗根系活力显著降低;T5铝胁迫下橡胶幼苗根系活力随时间的延长前期无显著差异,但在处理96 h后显著下降。T3、T4、T5铝离子处理幼苗96 h,其橡胶幼苗根系活力分别为T2无铝胁迫的41.80%、15.20%和9.60%。其说明T3、T4和T5三种浓度铝胁迫在6 h前可能已经造成橡胶苗根系活力下降,铝胁迫对橡胶幼苗根系活力的抑制随浓度增加而加强,并且随着处理时间的延长整体呈下降趋势。
根系活力的下降可能会导致根系导水率的下降。由表3可知,铝胁迫对根系导水率的影响与根系活力的影响基本一致。与T1相比,T2溶液对根系导水率有一定提高或没有显著变化。而与铝胁迫对根系活力影响一致,从胁迫6 h开始,T3、T4、T5铝胁迫均造成橡胶幼苗根系导水率的显著下降,并且随着处理时间的延长,T3、T4均未表现出显著差异,只有T5在处理96 h根系导水率显著降低。铝胁迫处理96 h时,T3、T4、T5铝胁迫处理的橡胶幼苗根系导水率分别是pH 4.2不加铝处理的29.13%、6.25%、0.60%;T5处理96 h橡胶幼苗根系导水率比处理6 h时下降了96.52%,根系已基本完全丧失吸水能力。说明与根系活力变化一致处理在6 h前已经造成橡胶幼苗根系导水率显著降低,并且在T5处理96 h后根系已基本完全死亡,丧失吸水能力。
2.3 铝胁迫对橡胶苗根系H2O2和O2?含量的影响
根系活力和导水率的下降可能由于根系活性氧的累积引起,为此我们研究了不同浓度铝处理下根系H2O2和O2?含量的变化。由图3的结果可以看出,低pH和铝胁迫均会使橡胶幼苗根系H2O2含量增加,T2处理24 h时使根系H2O2含量显著增加,但随着处理时间的延长,T2处理的根系H2O2含量与T1差异不显著;而T3、T4、T5铝胁迫处理均会使橡胶苗根系H2O2含量始终显著高于不加铝pH 5.5 T1溶液;说明酸度降低也会造成H2O2的累积,但酸性条件下铝胁迫也会造成H2O2的累积。T5铝胁迫下处理24 h根系H2O2含量就显著高于T2;而处理24 h后,随着处理时间的延长各种浓度铝胁迫下橡胶幼苗根系H2O2含量均显著高于T2,但T4、T5铝胁迫下橡胶幼苗根系H2O2含量无显著差异。在T3、T4、T5铝胁迫处理96 h时,橡胶幼苗根系H2O2含量是T2的1.52、1.79、1.91倍。表明铝胁迫会造成胶幼苗根系H2O2累积,对植物可能产生毒害影响。
铝胁迫对根系O2?的影响见图4,可以看出,T2处理24 h时,橡胶幼苗根系超氧阴离子含量(O2?)与T1差异不显著且高于T3铝胁迫处理;而处理48 h时,T2处理的根系O2?含量增加并显著高于T1;至处理96 h时,根系O2?含量与T1无显著差异。说明培养液酸度由5.5降低到4.2也会影响根系O2?含量的变化。此外,不同浓度铝胁迫下根系O2?含量随着处理时间的延长呈上升趋势,在铝胁迫处理96 h前,各种浓度铝胁迫下橡胶幼苗根系O2?含量差异不显著,但在铝胁迫处理96 h时,T3、T4、T5根系O2?含量显著高于T1、T2;而且T4、T5的根系O2?含量显著高于T3,T4、T5根系O2?含量差异不显著,说明铝胁迫也会造成橡胶苗根系O2?的累积,而且高浓度比低浓度铝对橡胶苗根系O2?含量的影响更大。
3 讨论
活性氧(ROS)累积是植物在逆境胁迫下作出的氧化应激反应,ROS累积过多会使植物的细胞质膜被破坏而影响到植物生长和发育[30],而植物体清除活性氧依赖于植物自身的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧化物酶(POD)等抗氧化酶组成的ROS清除系统。在先前的研究中,我们测定了不同浓度铝胁迫处理下橡胶幼苗SOD、POD、CAT的活性,发现SOD、CAT和POD的活性随着处理液中铝浓度的增加而显著下降,并且随着处理时间的延长呈现出先升高后下降的趋势[24-25, 31]。说明短时间低浓度处理可使SOD、POD和CAT的活性升高,清除植物体内多余的ROS,但随着铝处理浓度的增加和时间的延长,植株体内的抗氧化酶活性失调,使得ROS产生和清除失衡导致ROS在植株体内累积,最终造成植株生长发育受阻。H2O2和O2?是ROS在植物体内不同的存在形式,本试验直接测定了铝胁迫下橡胶幼苗H2O2和O2?含量的变化,结果显示:与pH 4.2不添加铝离子的处理相比,铝胁迫可以显著增加橡胶幼苗根系H2O2和O2?含量,并且随着处理时间的增长,根系H2O2和O2?含量呈上升趋势,其中,200 mmol/L Al3+胁迫处理橡胶幼苗96 h,其根系H2O2和O2?的含量分别是pH 4.2不加铝离子处理的1.94和1.94倍。这一实验结果证实了随着处理时间的延长,ROS会在橡胶苗根系中累积,有可能破坏植物体内的抗氧化酶清除系统,使得ROS不能被及时清除而在植株体内大量累积,可能对植物产生毒害。前人对大豆在铝胁迫下ROS积累的研究以及夜间高温下钙对番茄幼苗ROS含量影响的报道也证明了这一结论[32, 33]。
植物根系是直接与铝离子接触的部位,植物根系根尖部位受铝毒损害最为严重[34]。而根系导水率是植物吸收和传导水分能力的一个重要指标[35],关系着植株能否正常生长发育。有研究表明,ROS累积可造成水通道蛋白的门控效应,造成水通道蛋白活性下降,根系水分的吸收運输受到抑制,从而降低植物根系导水率[36]。而根系导水率的降低会致使叶片缺水,气孔开度减小从而抑制植物生长[37-39]。本研究结果表明:不同浓度铝胁迫处理,可显著降低橡胶幼苗的根系活力,其中200 mmol/L铝离子胁迫96 h对橡胶幼苗根系活力的抑制作用最强,仅为pH 4.2不添加铝处理的9.60%。这与前人报道的铝胁迫造成烤烟以及大豆的根系活力下降的研究结果相符[40-41]。铝毒害造成根系活力的下降可显著降低橡胶幼苗根系导水率,与pH 4.2不加铝处理相比,不同浓度的铝胁迫橡胶幼苗在6 h时根系导水率已经显著下降,并且随着处理时间的延长,有进一步下降的趋势;其中,铝离子浓度为200 mmol/L处理24、48、72和96 h时橡胶幼苗根系导水率分别比处理6 h下降了31.61%、41.39%、13.70%和96.52%,说明处理时间越长对根系导水率的抑制作用是叠加的、不可逆的,最终造成根系导水能力的丧失和橡胶苗的死亡。这些试验结果与其他重金属胁迫下根系导水率下降的报道相同[42]。值得注意的是,Gunse等[43]对玉米根系水分转运特性的研究发现,铝胁迫处理几分钟或几小时后会导致根系导水率降低,而本实验结果发现,铝胁迫处理在6 h前可能已经造成橡胶幼苗根系导水率以及根系活性降低,但铝胁迫造成橡胶幼苗根系导水率和根系活性降低的确切时间仍需进一步的实验验证。
叶绿素含量是植物能否进行正常生长发育的决定因素之一,SPAD值可以反映叶片叶绿素含量及其变化趋势[44]。而叶片相对含水量变化可作为判断植物非生物胁迫耐受度,植物细胞含水量降低是因为细胞的失水,细胞失水会造成植物生长受阻[45]。本试验结果表明:200 mmol/L铝胁迫处理48 h就能使橡胶叶片SPAD值和相对含水量显著降低,早于50 mmol/L的96 h和100 mmol/L的72 h;铝胁迫处理48 h后随着胁迫时间的延长对橡胶幼苗叶片SPAD值和相对含水量有显著的抑制作用,表明铝离子浓度越高对橡胶苗SPAD值和相对含水量抑制作用越强。这与Chen[46]报道的铝胁迫造成植物嫩芽SPAD值和相对含水量降低的结果一致。此外,本研究结果也证明了张晗等[24]、安锋等[25]报道的橡胶幼苗对铝毒害的耐受浓度为100~200 mmol/L。
综上,铝胁迫会造成橡胶幼苗根系H2O2和O2?的累积和ROS清除系统的破坏,抑制橡胶幼苗根系活性,使得根系导水率下降没有充足的水分向上运输到叶片,造成橡胶苗叶片相对含水量降低、叶片缺水枯黄,叶绿素含量降低,植株不能正常进行光合作用,进而影响整个植株的正常生长和发育,造成橡胶苗死亡。
参考文献
罗 亮, 谢忠雷, 刘 鹏, 等. 茶树对铝毒生理响应的研究[J]. 农业环境科学学报, 2006, 25(2): 305-308.
赵天龙, 解光宁, 张晓霞, 等. 酸性土壤上植物应对铝胁迫的过程与机制[J]. 应用生态学报, 2013, 24(10): 3003-3011.
应小芳, 刘 鹏, 徐根娣. 土壤中的铝及其植物效应的研究进展[J]. 生态环境, 2003, 12(2): 237-239.
Halman J M, Schaberg P G, Hawley G J, et al. Calcium and aluminum impacts on sugar maple physiology in a northern hardwood forest[J]. Tree Physiology, 2013, 33(11): 1242- 1251.
徐圆圆, 陆明英, 蒋维昕, 等. 铝胁迫下不同耐铝型桉树无性系根和叶抗氧化特征的差异[J]. 浙江农林大学学报, 2016, 33(6): 1009-1016.
于翠平, 潘志强, 陈 杰, 等. 铝对茶树生长与生理特性影响的研究[J]. 植物营养与肥料学报, 2012, 18(1): 182-187.
吴琼鸯, 郑伟伟, 罗 亮, 等. 铝对茶树根系生理的影响[J]. 湖北农业科学, 2005(3): 80-82.
刘保国, Vesna Hadzi-Taskovic Sukalovic. 铝对玉米生长和硝酸还原酶活性的影响[J]. 植物生理学报, 1998, 24(4): 347-353.
石贵玉. 铝对水稻幼苗生长和生理的影响[J]. 广西植物, 2004, 24(1): 77-80.
田 聪, 张 烁, 粟 畅, 等. 铝胁迫下大豆根系有机酸积累的特性[J]. 大豆科学, 2017, 36(2): 256-261.
Clarkson D T. Effect of aluminum on the uptake and metabolism of phosphorus by barley seedlings[J]. Plant Physiology, 1996, 41(1): 165-172.
張盛楠, 刘亚敏, 刘玉民, 等. 马尾松幼苗生长及生理特性对铝胁迫的响应[J]. 西北植物学报, 2016, 36(10): 2022-2029.
Kollmeier M, Felle H H, Horst W J. Genotypical differences in aluminum resistance of maize are expressed in the distal part of the transition zone. Is reduced basipetal auxin flow involved in inhibition of root elongation by aluminum[J]. Plant Physiology, 2000, 122(3): 945-956.
Rengel Z. Disturbance of cell Ca2+ homeostasis as a primary trigger of Al toxicity syndrome[J]. Plant, Cell and Environment, 1992, 15: 931-938.
唐剑锋, 林咸永, 章永松, 等. 小麦根系对铝毒的反应及其与根细胞壁组分和细胞壁对铝的吸附?解吸性能的关系[J]. 生态学报, 2005, 25(8): 1890-1897.
孟长军. 铝胁迫对白苦瓜幼苗生长状况和生理特性的影响[J]. 中国农业科技导报, 2018, 20(8): 23-28.
初晓辉, 张艾青, 段新慧, 等. 铝胁迫对多花黑麦草生长和生理的影响[J]. 草原与草坪, 2017, 37(6): 48-56.
曹 林, 吴玉环, 章 艺, 等. 外源水杨酸对铝胁迫下菊芋光合特性及耐铝性的影响[J]. 水土保持学报, 2015, 29(4): 260-266.
张云华, 孟庆玲, 计成林, 等. 铝胁迫对转C4磷酸烯醇式丙酮酸羧化酶基因水稻光合作用和活性氧代谢的影响[J]. 生物技术通报, 2014(7): 81-85.
刘 强, 胡 萃, 柳正葳, 等. 铝胁迫对烟草叶片光能利用、光保护系统及活性氧代谢的影响[J]. 华北农学报, 2017, 32(1): 118-124.
刘 强, 尹 丽, 龙婉婉, 等. 铝胁迫对蓼科植物生长和光合、蒸腾特性的影响[J]. 广西植物, 2011, 31(2): 227-232.
李明谦, 张凤良, 李小琴, 等. 橡胶树无性系苗期生长和光合生理特性的比较[J]. 西南林业大学学报(自然科学), 2020, 40(2): 1-5.
贝美容, 蔡 隽, 戚春林, 等. 2种新型种植材料(苗木)橡胶幼树的施肥效应[J]. 热带作物学报, 2019, 40(11): 2105-2111.
张 晗, 安 锋, 袁 坤, 等. 不同铝水平胁迫对橡胶树幼苗若干生理指标的影响[J]. 热带作物学报, 2014, 35(10): 1992-1996.
安 锋, 李昌珍, 张婷婷, 等. 铝胁迫对橡胶苗生理和叶绿素荧光特性的影响[J]. 应用生态学报, 2018, 29(12): 4191-4198.
徐镜波, 袁晓凡, 郎佩珍. 过氧化氢酶活性及活性抑制的紫外分光光度测定[J]. 环境化学, 1997, 16(1): 73-76.
郝再彬, 苍 晶, 徐 仲. 植物生理实验[M]. 哈尔滨: 哈尔滨工业大学出版社, 2004.
胡田田, 康绍忠. 局部灌水方式对玉米不同根区土-根系统水分传导的影响[J]. 农业工程学报, 2007, 23(2): 11-16.
李忠光, 龚 明. 植物中超氧阴离子自由基测定方法的改进[J]. 云南植物研究, 2005, 27(2): 211-216.
Vale G, Mehennaoui K, Cambier S, et al. Manufactured nanoparticles in the aquatic environment-biochemical responses on freshwater organisms: A critical overview[J]. Aquatic Toxicology, 2016, 170(23): 162-174.
彭 艳, 李 洋, 杨广笑, 等. 铝胁迫对不同小麦SOD、CAT、POD活性和MDA含量的影响[J]. 生物技术, 2006, 16(3): 38-42.
杨 喆, 王芳妹, 王 瀚, 等. H2O2参与大豆根尖铝毒调节的研究[J]. 大豆科学, 2011, 30(1): 105-108.
李天来, 高晓倩, 刘玉凤. 夜间低温胁迫下钙对番茄幼苗根系活力及活性氧代谢的调控作用[J]. 西北农业学报, 2011, 20(8): 127-132.
沈玉芳, 曲 东, 王保莉, 等. 干旱胁迫下磷营养对不同作物苗期根系导水率的影响[J]. 作物学报, 2005, 31(2): 214-218.
杨启良, 张富仓, 刘小刚, 等. 环境因素对植物导水率影响的研究综述[J]. 中国生态农业学报, 2011, 19(2): 456-461.
Boursiac Y, Prak S, Boudet J, et al. The response of Arabidopsis root water transport to a challenging environment implicates reactive oxygen species-and phosphorylation-dependent internalization of aquaporins[J]. Plant Signal Behavior, 2008, 3(12): 1096-1098.
Veselova S V, Farhutdinov R G, Veselov S Y, et al. The effect of root cooling on hormone content, leaf conductance and root hydraulic conductivity of durum wheat seedlings (Triticum durum L.)[J]. Journal of Plant Physiology, 2005, 162(1): 21-26.
Lovelock C E, Ball M C, Feller I C, et al. Variation in hydraulic conductivity of mangroves: Influence of species, salinity, and nitrogen and phosphorus availability[J]. Physiologia Plantarum, 2006, 127(21): 457-464.
Martre P, North G B, Nobel P S. Hydraulic conductance and mercury-sensitive water transport for roots of opuntia acanthocarpa in relation to soil drying and rewetting1[J]. Plant Physiology, 2001, 126(1): 352-362.
李淮源, 劉柏林, 邓世媛, 等. 铝胁迫对烤烟生长和光合特性的影响[J]. 烟草科技, 2015, 48(9): 9-13.
俞慧娜, 刘 鹏, 徐根娣. 大豆生长及叶绿素荧光特性对铝胁迫的反应[J]. 中国油料作物学报, 2007, 29(3): 257-265.
孔祥瑞, 曲 东, 周莉娜. 硫营养对重金属胁迫下玉米和小麦根系导水率的影响[J]. 西北植物学报, 2007, 27(11): 2257-2262.
Gunse B, Poschenrieder C, Barcelo J. Water transport properties of roots and root cortical cells in proton- and Al-stressed maize varieties[J]. Plant Physiology, 1997, 113(2): 595-602.
贾 朋, 钱 磊, 罗树凯, 等. 洋紫荆叶绿素含量的分布特征及与叶片氮含量的关系[J]. 中国城市林业, 2019, 27(11): 1-7.
Rahman A, Mostofa M G, Nahar K, et al. Exogenous calcium alleviates cadmium-induced oxidative stress in rice (Oryza sativa L.) seedlings by regulating the antioxidant defense and glyoxalase systems[J]. Brazilian Journal of Botany, 2016, 39(2): 393-407.
Chen L S. Physiological responses and tolerance of plant shoot to aluminum toxicity[J]. Journal of Plant Physiology and Molecular Biology, 2006(2): 143-155.

