香蕉枯萎病菌分子检测研究进展
杨迪 杜婵娟 叶云峰 彭军 张欣 付岗
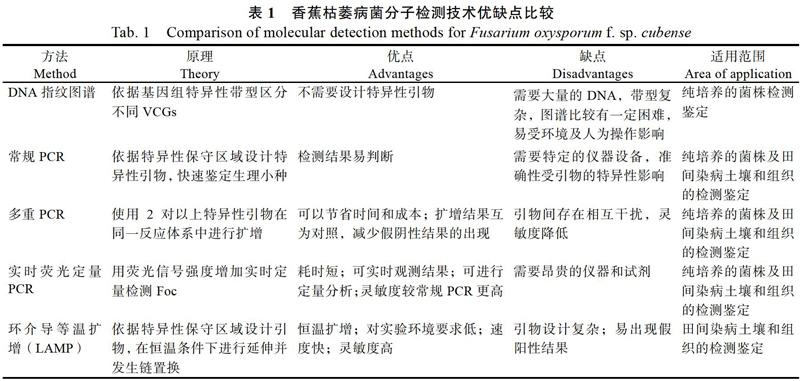


摘 要:香蕉枯萎病是全世界香蕉产业共同面临的毁灭性病害,但目前生产上仍缺乏适宜的抗病品种和有效的治疗措施。因此,借助快速准确的枯萎病菌检测技术及时明确病原菌以控制该病的传播和蔓延显得尤为重要。本文回顾了近年来国内外香蕉枯萎病菌分子检测技术的发展历程,归纳和总结了DNA指纹图谱、普通PCR、多重PCR、荧光定量PCR及等温扩增技术在该病菌检测中的研究进展,分析了不同检测技术的优缺点,并指出可能存在的问题和研究发展方向,为该病的分子检测技术优化和防控策略制定提供参考。
关键词:香蕉枯萎病;尖孢镰刀菌古巴专化型;分子检测
中图分类号:S436.68+1 文献标识码:A
Abstract: Banana Fusarium wilt is a devastating disease in global banana industry. At present, there is still no available measures can be used for curing this disease, and lack of suitable resistant varieties. So, it is very important that developing the rapid and accurate detection technology in order to slow down the spread speed of banana Fusarium wilt in the field. In this paper, the development of molecular detection techniques on Fusarium oxysporum f. sp. cubense was reviewed. The detection technology based on DNA fingerprinting, general PCR, multiplex PCR, fluorescence quantitative PCR and isothermal amplification were summarized. The advantages and disadvantages of different detection technologies were analyzed. Futhermore, the problems lied in detection of this pathogen and possible research directions in the future were pointed out.
Keywords: banana Fusarium wilt; Fusarium oxysporum f. sp. cubense; molecular detection
DOI: 10.3969/j.issn.1000-2561.2020.12.029
香蕉枯萎病是由尖孢镰刀菌古巴专化型(Fusarium oxysporum f. sp. cubense, Foc)侵染引起的检疫性土传病害[1]。该病于1874年首次在澳大利亚发现,1910年在巴拿马大爆发,直接导致巴拿马乃至整个中南美洲香蕉产业的衰退。随后,抗病品种‘香芽蕉(Cavendish, AAA)的种植和推广使世界香蕉产业重新焕发生机;但20世紀后期香蕉枯萎病菌4号生理小种的出现,使香蕉产业再次面临巨大威胁[2-4]。
香蕉枯萎病菌依据寄主致病性分为1号(Race 1, R1)、2号(Race 2, R2)和4号生理小种(Race 4, R4)。根据不同侵染条件,4号小种又分为热带4号(Tropical Race 4, TR4)和亚热带4号(Subtropical Race 4, STR4)。其中R1和R2侵染粉蕉,R4可侵染几乎所有栽培蕉[5-8]。因缺乏有效药剂和抗病品种,该病在生产上极难控制[9-11];因此,快速准确地检测该病的病原菌以便及时采取销毁、隔离措施阻止该病的传播和蔓延至关重要。
依靠传统方式分离、接种、鉴定病原菌耗时耗力,且需要经验丰富的研究人员才能完成[12-17]。随着PCR技术与高通量测序技术的发展,各种基于基因序列特征的分子快速检测技术逐渐应用于香蕉枯萎病菌的检测[18-19]。与传统检测方法相比,分子检测技术更加高效便捷,在生产上更具实用价值[20-21]。本文对国内外近年来香蕉枯萎病菌分子检测技术的研究进展进行分析和梳理,并提出存在的问题和将来可能的研究方向,以期为香蕉枯萎病菌的快速检测研究提供借鉴。
1 基于DNA指纹图谱的香蕉枯萎病菌检测
1990年John等[22]首先提出了AP-PCR技术,利用随机引物扩增获得多态性DNA指纹图谱,为菌株的分子鉴定提供了一种有效方法。Bentley等[23-24]首次将该技术应用于香蕉枯萎病菌检测,通过分析11株澳大利亚Foc菌株的DNA多态性图谱,发现根据基因组特异性带型对菌株进行分组的结果与之前基于寄主范围、营养亲和群(vegetative compatibility groups, VCGs)、电泳核型分析和挥发性化合物色谱图的分组结果一致。随后该研究组扩大测试菌株的样本量和来源范围,进一步验证了DNA指纹图谱与生理小种和VCGs的相关性,建立了香蕉枯萎病菌的DNA指纹图谱检测方法[25-27]。Gerlach等[28]采用DNA指纹图谱技术对澳大利亚分属于4个生理小种和8个VCGs的94株Foc菌株进行测试,发现DNA指纹图谱具有VCG特异性,并且利用不同电泳带型可以区分出与3个生理小种相对应的VCG群。刘景梅等[29]使用2个随机引物对广东18个Foc菌株进行分析,也证实了Foc R1和Foc R4的DNA图谱存在差异,而同一小种内菌株的RAPD电泳谱带差异较小,说明DNA指纹图谱可用于Foc生理小种的检测。谢艺贤等[30]对分离自海南、广东的18个Foc菌株进行RAPD图谱分析,结果表明RAPD图谱可区分Foc R1和Foc R4以及菌株地理来源和致病力。同年该研究组分别筛选到2个生理小种的RAPD图谱特征条带,可用于Foc生理小种的检测[31]。
尽管许多研究表明,DNA指纹图谱可以区分Foc R1和Foc R4[29-31],但该方法仍存在扩增条带多、带型难以重复、易受环境及人为操作影响等问题。因此,该技术在检测实用性上仍有局限性。
2 基于香蕉枯萎病菌特定DNA区段的PCR定性检测
随着测序技术和PCR技术的不断发展,利用特异性引物对Foc进行定性检测的技术应运而生。该技术利用不同Foc生理小种的特定DNA区段设计特异性引物进行PCR扩增,通过是否产生特异性条带判断目标菌的有无,检测结果更易判定。
2.1 香蕉枯萎病菌的普通PCR检测
早期的香蕉枯萎病菌PCR检测通常依据不同生理小种或VCG群的RAPD特异性条带的SCAR分子标记来设计引物进行鉴定。刘景梅等[32]利用RAPD技术对广东的18个Foc菌株进行分析,成功将4个RAPD标记简化为SCAR标记,准确鉴定出广东蕉区的Foc R1和Foc R4。叶建军等[33]利用SCAR标记与ITS序列分析相结合的方法对Foc R4菌株进行扩增,进一步提高了检测的准确性。Lin等[34]通过随机引物OP-A02对台湾地区的Foc R4菌株进行RAPD扩增,根据扩增产生的特异性DNA片段设计引物Foc-1/Foc-2,检测下限可达10 pg基因组DNA。廖林凤等[35]采用RAPD技术对广东、广西的30个Foc菌株和3个尖孢镰刀菌不同专化型菌株进行比较及聚类分析,将1个RAPD标记转化为SCAR标记,建立了Foc R4号生理小种快速检测技术,检测灵敏度为2 ng新鲜菌丝,并可对染病植株的不同部位进行检测。
利用SCAR标记设计引物进行检测和DNA指纹图谱相比,结果更易于判定,但SCAR标记在基因组上的定位不确定,因此许多学者选择利用菌株的保守区段设计特异性引物,以提高检测结果的稳定性。王国芬等[36]依据Foc的ITS序列设计合成2对引物A(Fus F1/R1)和B(Fus F1/R2),其对目标菌株的检测下限分别达100 fg和10 pg;其中引物A对Foc菌丝体基因组检测能力较强,而引物B对感病组织有较好的检测能力,可应用于病原菌的检测和田间香蕉枯萎病的早期鉴定。Dita等[37-38]基于IGS区域存在的2个单核苷酸多态性位点开发了用于检测Foc TR4(VCG01213)的PCR引物。采用該引物对土壤和染病香蕉组织进行检测,可以检出所有感染样品中的Foc TR4。Li等[39]同样依据该区段的差异设计了可检测Foc TR4的特异性引物。
基于Foc基因组的保守区段设计引物,虽然能对Foc进行区分,但是对不同生理小种的区分有一定局限,往往还需要借助其他特征标记作为辅助。因致病性相关基因位点只存在于某种特定致病性菌株中,因此,利用与致病性相关位点设计引物,理论上可以更精准地区分不同致病性的生理小种。2013年Li等[40]通过鉴定Foc TR4突变株W2987的突变位点,发现1个假定毒力基因位点,并依据该基因区段设计引物用于检测Foc TR4。该引物在香蕉染病组织和被病原菌污染的土壤样品中均可检出Foc TR4,检出限为0.001 ng/?L基因组DNA和40个孢子/g土壤。这是毒力相关基因位点首次应用于Foc生理小种的检测。2014年Fraser-Smith研究组[41]对Foc不同生理小种的致病相关基因SIX8进行了鉴定,检测出2个SIX8基因同系物(Foc-SIX8a和Foc-SIX8b),并依据此基因位点设计引物用于检测Foc R4和Foc STR4。此后,该研究组以SIX效应基因为靶点,开发出一组引物,分别可扩增Foc R1中的SIX6基因、Foc TR4中的SIX1基因、Foc STR4中的SIX8基因、Foc VCG 0121中的SIX9/SIX10基因和Foc VCG 0122中的SIX13基因,并通过限制性酶切的方法区分SIX1和SIX13基因扩增产物,从而构建了一套可以准确检测Foc R1、Foc STR4和Foc TR4以及Foc VCG 0121和Foc VCG 0122的方法[42]。2016年杨腊英等[43]分析了来自不同地区的Foc菌株的SIX2基因序列,并依据该区段设计检测Foc R4的特异性引物,检测灵敏度可达5 pg/25 ?L,并可用于感病球茎组织的检测。
2.2 香蕉枯萎病菌的多重PCR检测
多重PCR是在同一PCR反应中添加多对引物,同时检测不同靶标序列的方法[44]。吕成伟等[45]基于Foc的ITS序列及不同生理小种的SCAR标记设计特异引物PR1/PR2和ST1/ST2,建立了香蕉枯萎病菌生理小种的双重PCR检测方法,可同时检测Foc R1和Foc R4,检测灵敏度可达200 pg。Dita等[37]利用引物组EF-1/EF-2、Foc TR4特异性引物组及香蕉肌动蛋白引物组分别构建了真菌和植物组织样品中Foc TR4的多重PCR体系,以TEF-1α引物组和香蕉肌动蛋白引物组作为内阳性对照,前者用来排除真菌样品中的假阴性现象,后者用来排除香蕉组织样品中的假阴性现象。李敏慧等[46]基于Foc R4疑似致病基因序列分别设计了可检测Foc R1和Foc R4的特异性引物以及尖孢镰刀菌的通用引物,建立了三重PCR方法,可同步检测Foc R1和Foc R4,并用于香蕉组织及土壤中香蕉枯萎病菌的检测。
相对于DNA指纹图谱检测,基于病菌特定DNA区段进行定性检测需要的模板量较少,扩增出的条带单一,提高了检测结果的准确性,同时降低了检测结果的判定难度,在生产实践中得到广泛应用。多重PCR可在同一体系中同时扩增多个目标基因,扩增结果可作为内部对照互相参考验证,一定程度上能避免假阴性结果的出现,还可以节约时间及成本[37, 46]。但同一体系中存在多对引物,易相互干扰而出现多条带或引物二聚体,影响结果的判断;同时由于引物间竞争靶标序列,灵敏度降低。这2种PCR方法在扩增后均需通过凝胶电泳对产物进行检测,不能实时查看结果,也无法对病原菌进行定量。
目前已报道的分子检测方法均为基于病菌DNA序列的检测,均需从香蕉植株中取一部分组织提取DNA,并且需要操作者具备一定程度的分子生物学或植物病理学研究背景。随着多学科交叉研究的发展,基于物理图谱的无损检测技术将会是未来检测技术开发的一个重要方向。2020年初,Lin等[67]将拉曼光谱应用于田间感病香蕉的检测,在无症状的Foc感染样本中检测到香蕉枯萎病菌的比率为76.2%,与其他分子检测方法检出率相当。这一研究为田间香蕉枯萎病菌的检测鉴定提供了新思路。随着交叉学科研究的不断深入,未来香蕉枯萎病的诊断将向更简便智能的方向发展。同时,适用于一线农技人员的便携式物理无损检测仪器和自动化检测方法的开发,也将有助于进一步扩大香蕉枯萎病菌检测的适用场景和范围。
参考文献
王振中. 香蕉枯萎病及其防治研究进展[J]. 植物检疫, 2006(3): 198-200.
麦明晓, 黄惠琴, 鲍时翔. 香蕉镰刀菌枯萎病4号生理小种研究进展[J]. 中国生物防治, 2009, 25(S1): 71-75.
Ploetz R C. Fusarium wilt of banana[J]. Phytopathology, 2015, 105(12): 1512-1521.
付 岗, 叶云峰, 杜婵娟, 等. 香蕉枯萎病菌群体多样性研究进展[J]. 植物检疫, 2016, 30(2): 1-6.
Waite B H, Stover R H. Studies on Fusarium wilt of bananas: VI. Variability and the cultivar concept in Fusarium oxysporum f. sp. cubense[J]. Canadian Journal of Botany, 1960, 38(6): 985-994.
Stover R H, Waite B H. Studies on Fusarium wilt of bananas: V. Pathogenicity and distribution of Fusarium oxysporum f. sp. cubense races 1 and 2[J]. Canadian Journal of Botany, 1960, 38(1): 51-61.
Page O T. Variation in the banana-wilt pathogen, Fusarium oxysporum f. sp. cubense[J]. Canadian Journal of Botany, 1961, 39(3): 545-557.
Ploetz R C, Correll J C. Vegetative compatibility among races of Fusarium oxysporum f. sp. cubense[J]. Plant Disease, 1988, 72(4): 325-328.
李 斌, 盛 鸥, 李春雨, 等. 香蕉枯萎病病原菌的研究进展[J]. 分子植物育种, 2013, 11(5): 638-646.
曾 莉, 郭志祥, 番华彩, 等.云南香蕉枯萎病及防治研究进展[J]. 热带农业科技, 2016, 39(4): 19-22, 24.
李华平, 李云锋, 聂燕芳. 香蕉枯萎病的发生及防控研究现状[J]. 华南农业大学学报, 2019(5): 128-136.
Stover R H. Studies on Fusarium wilt of bananas: VIII. Differentiation of clones by cultural interaction and volatile substances[J]. Canadian Journal of Botany, 1962, 40(11): 1467-1471.
Komada H. A new selective medium for isolating Fusarium from natural soil[J]. Review of Plant Protection Research, 1975, 8: 114-124
Sun E J. Identification of Fusarium oxysporum f. sp. cubense race 4 from soil or host tissue by cultural characters[J]. Phytopathology, 1978, 68(11): 1672-1673.
Moore N Y, Hargreaves P A, Pegg K G, et al. Characterisation of strains of Fusarium oxysporum f. sp. cubense by production of volatiles[J]. Australian Journal of Botany, 1991, 39(2): 161-166.
Puhalla J E. Classification of strains of Fusarium oxysporum on the basis of vegetative compatibility[J]. Canadian Journal of Botany, 2011, 63(2): 179-183.
張绍升, 肖 顺, 刘国坤. 香蕉枯萎病早期诊断和病原菌快速检测[J]. 中国热带农业, 2011(6): 55-56.
彭埃天, 宋晓兵, 凌金锋, 等. 香蕉枯萎病菌4号生理小种分子检测与枯萎病生物防治研究进展[J]. 果树学报, 2009, 26(1): 77-81.
曾莉莎, 吕 顺, 刘文清, 等. 基于多基因序列分析对尖孢镰孢菌古巴专化型(香蕉枯萎病菌)生理小种的鉴定[J]. 菌物学报, 2014, 33(4): 867-882.
Badali H, Nabili M. Molecular tools in medical mycology; Where we are![J]. Jundishapur Journal of Microbiology, 2012, 6(1): 1-3.
彭丹丹, 张源明, 舒灿伟, 等. 植物病原真菌分子检测技术的研究进展[J]. 基因组学与应用生物学, 2017, 36(5): 2015-2022.
John W, Michael M C. Fingerprinting genomes using PCR with arbitrary primers[J]. Nucleic Acids Research, 1990, 18(24): 7213-7218.
Boehm E W A. Statistical analysis of electrophoretic karyotype variation among vegetative compatibility groups of Fusarium oxysporum f. sp. cubense[J]. Molecular Plant Microbe Interactions, 1994, 7(2): 196-207.
Bentley S, Pegg K G, Dale J L. Optimization of RAPD-PCR fingerprinting to analyse genetic variation within populations of Fusarium oxysporum f. sp. cubense[J]. Journal of Phytopathology, 1994, 142(1): 64-78.
Bentley S, Pegg K G, Dale J L. Genetic variation among a world-wide collection of isolates of Fusarium oxysporum f. sp. cubense analysed by RAPD-PCR fingerprinting[J]. Mycological Research, 1995, 99(11): 1378-1384.
Bentley S, Bassam B J. A robust DNA amplification fingerprinting system applied to analysis of genetic variation within Fusarium oxysporum f. sp. cubense[J]. Journal of Phytopathology, 1996, 144(4): 207-213.
Bentley S, Pegg K G, Moore N Y, et al. Genetic variation among vegetative compatibility groups of Fusarium oxysporum f. sp. cubense analyzed by DNA fingerprinting[J]. Phytopathology, 1998, 88(12): 1283-1293.
Gerlach K S, Bentley S, Moore N Y, et al. Characterisation of Australian isolates of Fusarium oxysporum f. sp. cubense by DNA fingerprinting analysis[J]. Australian Journal of Agricultural Research, 2000, 51(8): 945-953.
刘景梅, 王璧生, 陈 霞, 等. 廣东香蕉枯萎病菌生理小种RAPD技术的建立[J]. 广东农业科学, 2004(4): 43-45, 55.
谢艺贤, 张 欣, 漆艳香, 等. 香蕉枯萎病菌的致病性测定及其RAPD分析[J]. 热带作物学报, 2005, 26(2): 68-71.
漆艳香, 谢艺贤, 张 欣, 等. 海南省香蕉枯萎菌生理小种的RAPD分析[J]. 菌物学报, 2005, 24(3): 394-399.
刘景梅, 陈 霞, 王璧生, 等. 香蕉枯萎病菌生理小种鉴定及其SCAR标记[J]. 植物病理学报, 2006(1): 28-34.
叶建军, 朱 军, 黄惠琴, 等. 一种快速、有效的香蕉枯萎病病原菌FOC4的分子检测方法[J]. 中国生物防治学报, 2008, 24(S1): 102-105.
Lin Y H, Chang J Y, Liu E T, et al. Development of a molecular marker for specific detection of Fusarium oxysporum f. sp. cubense race 4[J]. European Journal of Plant Pathology, 2009, 123(3): 353-365.
廖林凤, 董章勇, 王振中, 等. 香蕉枯萎病菌RAPD分析及4号生理小种的快速检测[J]. 植物病理学报, 2009, 39(4): 353-361.
王国芬, 彭 军, 代 鹏, 等. 香蕉枯萎病镰刀菌ITS序列的PCR扩增及其分子检测[J]. 华南热带农业大学学报, 2007, 13(3): 1-5.
Dita M A, Waalwijk C, Buddenhagen I W, et al. A molecular diagnostic for tropical race 4 of the banana Fusarium wilt pathogen[J]. Plant Pathology, 2010, 59(2): 348-357.
Dita M A, Waalwijk C, Mutua P, et al. Detecting Fusarium oxysporum f. sp. cubense tropical race 4 in soil and symptomless banana tissues[J]. Acta Horticulturae, 2013(986): 127-130.
Li C Y, Mostert G, Zuo C W, et al. Diversity and distribution of the banana wilt pathoge Fusarium oxysporum f. sp. cubense in China[J]. Fungal Genomics Biology, 2013, 3(2): 111.
Li M H, Shi J, Xie X, et al. Identification and application of a unique genetic locus in diagnosis of Fusarium oxysporum f. sp. cubense tropical race 4[J]. Canadian Journal of Plant Pathology, 2013, 35(4): 482-493.
Fraser-Smith S, Czislowski E, Meldrum R A, et al. Sequence variation in the putative effector gene SIX8 facilitates molecular differentiation of Fusarium oxysporum f. sp. cubense[J]. Plant Pathology, 2014, 63(5): 1044-1052.
Carvalhais L C, Henderson J, Rincon-Florez V A, et al. Molecular diagnostics of banana Fusarium wilt targeting Secreted-in-Xylem genes [J]. Frontiers in Plant Science, 2019, 10: 547.
楊腊英, 郭立佳, 汪 军, 等. 香蕉枯萎病菌SIX2基因序列及特异性分析[J]. 植物保护, 2016, 42(5): 118-124.
Henegariu O, Heerema N A, Dlouhy S R, et al. Multiplex PCR: Critical parameters and step-by-step protocol[J]. Biotechniques, 1997, 23(3): 504-511.
吕伟成, 张绍升, 林志远. 一步双重PCR检测香蕉枯萎病菌生理小种[J]. 中国农学通报, 2009, 25(1): 237-240.
李敏慧, 余雄涛, 王鸿飞, 等. 香蕉枯萎病菌1号和4号生理小种的快速检测与鉴定[J]. 中国农业科学, 2012, 45(19): 3971-3979.
Heid C A, Stevens J, Livak K J, et al. Real time quantitative PCR[J]. Genome Research, 1996, 6(10): 986-994.
Lin Y H, Su C C, Chao C P, et al. A molecular diagnosis method using real-time PCR for quantification and detection of Fusarium oxysporum f. sp. cubense race 4[J]. European Journal of Plant Pathology, 2013, 135(2): 395-405.
魏 森, 陈汉清, 曾 涛, 等. 土壤中香蕉枯萎病菌FOC4的实时荧光定量PCR检测[J]. 基因组学与应用生物学, 2019, 38(8): 3548- 3553.
Yang L L, Sun L X, Ruan X L, et al. Development of a single-tube duplex real-time fluorescence method for the rapid quantitative detection of Fusarium oxysporum f. sp. cubense race 1 (FOC1) and race 4 (FOC4) using TaqMan probes[J]. Crop Protection, 2015, 68: 27-35.
Aguayo J, Mostert D, Fourrier-Jeandel C, et al. Development of a hydrolysis probe-based real-time assay for the detection of tropical strains of Fusarium oxysporum f. sp. cubense race 4[J]. PLoS One, 2017, 12(2): e0171767.
马月萍, 戴思兰, 马艳蓉. 荧光定量PCR技术在植物研究中的应用[J]. 生物技术通报, 2011(7): 37-45.
Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA[J]. Nucleic Acids Research, 2000, 28(12): E63.
Li B J, Du J L, Lan C Z, et al. Development of a loop-mediated isothermal amplification assay for rapid and sensitive detection of Fusarium oxysporum f. sp. cubense race 4[J]. European Journal of Plant Pathology, 2013, 135(4): 903-911.
Zhang X, He Z, Pu J J, et al. Development of a real-time fluorescence loop-mediated isothermal amplification assay for rapid and quantitative detection of Fusarium oxysporum f. sp. cubense tropical race 4 in soil[J]. PLoS One, 2013, 8(12): e82841.
Peng J, Zhang H, Chen F P, et al. Rapid and quantitative detection of Fusarium oxysporum f. sp. cubense race 4 in soil by real-time fluorescence loop-mediated isothermal amplification[J]. Journal of Applied Microbiology, 2014, 117(6): 1740-1749.
胡宗悅, 须周恒, 卢亦愚. 环介导等温扩增技术的常见问题分析与研究进展[J]. 病毒学报, 2016, 32(5): 659-665.
Lin Y H, Lin Y J, Chang T D, et al. Development of a TaqMan probe-based insulated isothermal polymerase chain reaction (iiPCR) assay for detection of Fusarium oxysporum f. sp. cubense race 4[J]. PLoS One, 2016, 11(7): e0159681.
张吉祥, 凌 键, 谢丙炎, 等. 尖孢镰刀菌专化型及生理小种分子检测研究进展[J]. 中国农学通报, 2013, 29(36): 338-342.
孙 勇, 曾会才, 彭 明, 等. 香蕉枯萎病致病分子机理与防治研究进展[J]. 热带作物学报, 2012, 33(4): 759-766.
李敏慧, 苑曼琳, 姜子德, 等. 香蕉枯萎病菌致病机理研究进展[J]. 果树学报, 2019, 36(6): 803-811.
Aslam S, Tahir A, Aslam M F, et al. Recent advances in molecular techniques for the identification of phytopathogenic fungi - a mini review[J]. Journal of Plant Interactions, 2017, 12(1): 493-504.
Koenig R L, Ploetz R C, Kistler H C. Fusarium oxysporum f. sp. cubense consists of a small number of divergent and globally distributed clonal lineages[J]. Phytopathology, 1997, 87(9): 915-923.
Katan T. Current status of vegetative compatibility groups in Fusarium oxysporum[J]. Phytoparasitica, 1999, 27(1): 51-64.
Fourie G, Steenkamp E T, Gordon T R, et al. Evolutionary relationships among the Fusarium oxysporum f. sp. cubense vegetative compatibility groups[J]. Applied and Environmental Microbiology, 2009, 75(14): 4770-4781
Li M H, Yang B, Leng Y, et al. Molecular characterization of Fusarium oxysporum f. sp. cubense race 1 and 4 isolates from Taiwan and Southern China[J]. Canadian Journal of Plant Pathology, 2011, 33(2): 168-178.
Lin Y J, Lin H K, Lin Y H. Construction of raman spectroscopic fingerprints for the detection of Fusarium wilt of banana in Taiwan[J]. PLoS One, 2020, 15(3): e0230330.

