鹿角蕨孢子萌发与快速繁殖技术研究
叶秀仙 陈艺荃 方能炎 吴建设 钟淮钦


摘要:【目的】建立鹿角蕨孢子萌發与快速繁殖技术体系,为鹿角蕨规模化育苗提供技术支撑。【方法】以鹿角蕨孢子为外植体,采用3种不同消毒方法进行孢子灭菌与萌发;利用正交设计法,探讨基本培养基(MS、改良1号和改良2号)及植物生长调节剂(6-BA、KT、NAA和IBA)等对绿色球状体(GGB)增殖、丛生芽增殖及生根培养等关键环节的影响,筛选出适宜的孢子消毒方法及GGB增殖、丛生芽增殖和生根培养基配方。【结果】适宜孢子消毒的方法为超声波清洗器振荡清洗40 min,污染率低,仅为6.7%,孢子萌发率高达100.0%;各试验因素对GGB增殖影响的主次关系为基本培养基>6-BA>CH>NAA,以改良1号为基本培养基较好,6-BA适宜浓度为0.5 mg/L,NAA适宜浓度为0.1 mg/L,CH适宜浓度为0.2 g/L,42 d平均增殖系数达5.5;各试验因素对丛生芽增殖影响的主次关系为IBA>6-BA>NAA>KT,IBA适宜浓度为0.5 mg/L,6-BA适宜浓度为0.3 mg/L,KT适宜浓度为0.1 mg/L,NAA适宜浓度为0.3 mg/L,60 d平均增殖系数达5.3;添加NAA 0.3 mg/L为最适浓度,生根率为100.0%;试管苗移栽60 d成活率达98.5%。【结论】超声波清洗器振荡清洗40 min能有效降低鹿角蕨孢子污染率,提高孢子萌发率。鹿角蕨GGB增殖培养基以改良1号+6-BA 0.5 mg/L+NAA 0.1 mg/L+CH 0.2 g/L较适宜,丛生芽增殖培养基以改良2号+6-BA 0.3 mg/L+ KT 0.1 mg/L+NAA 0.3 mg/L+IBA 0.5 mg/L较适宜,生根培养基以改良1号+ NAA 0.3 mg/L较适宜。
关键词: 鹿角蕨;超声波;绿色球状体;正交设计;快速繁殖
中图分类号: S682.35 文献标志码: A 文章编号:2095-1191(2020)11-2773-08
Spore germination and rapid propagation of Platycerium wallichii Hook.
YE Xiu-xian1, CHEN Yi-quan2, FANG Neng-yan1, WU Jian-she1, ZHONG Huai-qin1*
(1Institute of Crop Sciences,Fujian Academy of Agricultural Science, Fuzhou 350013, China; 2Institute of Agricultural Engineering and Technology, Fujian Academy of Agricultural Sciences,Fuzhou 350003, China)
Abstract:【Objective】The technique system of spore germination and rapid propagation of Platycerium wallichii Hook. was established to provide technical support for large-scale breeding of P. wallichii. 【Method】The spores of P. wallichii were explants, they were sterilized and germinated by three different disinfection methods.The orthogonal design was used to study the effects of the key factors such as culture medium(MS, Improvement #1 and Improvement #2),phytohormone(6-BA,KT,NAA and IBA)on the proliferation of green globular body(GGB),multiplication of cluster buds and rooting culture,the suitable spore disinfection method and the medium formula of GGB multiplication,cluster bud multiplication and rooting were selected. 【Result】The suitable method of spore disinfection was washed with ultrasonic wave cleaner for 40 min,the contamination rate was only 6.7% ,the spore germination rate was as high as 100.0% . The primary and secondary relationship of each experimental factor to the bud multiplication was the basic medium>6-BA>CH>NAA. The best multiplication medium was Improvement # 1,the proper concentrations were 6-BA 0.5 mg/L, NAA 0.1 mg/L,and CH 0.2 g/L, resulted in an averaged propagation coefficient of 5.5 in 42 d. The primary and secondary relationship of each experimental factor to the multiplication of GGB was IBA>6-BA>NAA>KT,the optimum concentration of IBA was 0.5 mg/L,6-BA was 0.3 mg/L,KT was 0.1 mg/L,the optimum concentration of NAA was 0.3 mg/L,the average multiplication coefficient was 5.3 on 60 d. The optimum concentration of NAA was 0.3 mg/L,the rooting rate was 100.0%,and the survival rate of plantlets transplanted in vitro was 98.5% on 60 d. 【Conclusion】When spores are washed with ultrasonic wave cleaner for 40 min,the disinfection effect is good and the germination rate is high,the suitable medium for GGB proliferation is Improvement #1+6-BA 0.5 mg/L+NAA 0.1 mg/L+CH 0.2 g/L,the best medium for multiplication of cluster buds is Improvement #2+6-BA 0.3 mg/L+ KT 0.1 mg/L+NAA 0.3 mg/L+IBA 0.5 mg/L,and the best medium for rooting is Improvement #1+NAA 0.3 mg/L.
Key words: Platycerium wallichii Hook.; ultrasonic wave; green globular body; orthogonal design; rapid propagation
Foundation item: Basic Research Project of Fujian Public Welfare Research Institutes(2017R1026-9); Technology Innovation Team of Fujian Academy of Agricultural Sciences(STIT2017-2-9)
0 引言
【研究意义】鹿角蕨(Platycerium wallichii Hook.)为鹿角蕨科鹿角蕨属多年生常绿草本植物,国家二级保护植物,在我国主要分布于云南西南部盈江县那邦坝,生长于海拔210~950 m的山地雨林中,缅甸、印度东北部及泰国也有分布(沈晓岚等,2008;张哲等,2018)。鹿角蕨常作为室内垂吊或壁挂的观赏植物,是室内观叶植物中珍贵稀有的精品,也是室内立体绿化的好材料,应用前景广阔。目前,鹿角蕨常用的繁殖方法包括分株繁殖和孢子繁殖,但分株繁殖的繁殖系数较小,而孢子繁殖的孢子自然萌发率较低,均限制了其在鹿角蕨繁殖中的应用。因此,急需攻克鹿角蕨孢子无菌播种繁殖技术,解决育苗技术,为鹿角蕨资源保护及人工繁育提供技术保障。【前人研究进展】关于鹿角蕨繁殖方面的研究国内已有一些报道。王承义和王颖(2000)报道了细胞分裂素和蔗糖对鹿角蕨芽分化的影响,认为6-BA较适宜于诱导鹿角蕨不定芽分化,用糖量为30 g/L时不定芽增殖率最高。黄执缨(2004)以二歧鹿角蕨幼嫩真叶为外植体建立了鹿角蕨组织培养技术,筛选出适宜幼嫩真叶诱导绿色球状体(GGB)的培养基为MS+6-BA 0.1 mg/L+IBA 0.05 mg/L,GGB诱导丛生芽适宜的培养基为MS+KT 0.5 mg/L+IAA 0.5 mg/L,生根培养基为1/2MS+NAA 0.1 mg/L。郭捡等(2012,2013)研究表明,鹿角蕨孢子萌发适宜温度为20~30 ℃,在黑暗条件下孢子不萌发,孢子萌发和配子体发育最适光照强度为60~80 μmol/(m2·s),配子体在pH 4.5~7.5的范围均可正常发育,蔗糖浓度≤2%的培养条件更利于孢子的萌发及原叶体的形成,当幼孢苗株高达2~3 cm时即可移栽。国外也有一些关于鹿角蕨繁殖的研究,Camloh和Gogala(1991)研究表明,在改良MS培养基上培养二歧鹿角蕨幼叶诱导不定芽,无需添加外源生长调节剂,6-BA甚至会抑制芽的生长,生根培养中影响根系发育的主要因素是培养基的浓度,IBA处理不促进生根;Camloha等(1994)研究发现,以二歧鹿角蕨幼叶为外植体,在经Hennen和Sheehan改良过的Murashige和Skoog培养基中,添加不同浓度的6-BA,可诱导出不定芽,但在不添加6-BA的培养基上培养40 d的外植体中,大多数外植体可产生10~35个芽;Kwa等(1997)研究发现,在皇冠鹿角蕨细胞悬浮培养再生愈伤组织的形态发生过程中,与浅绿色孢子体愈伤组织相比,深绿色配子体愈伤组织的生长和形态发生速度更快;Teng(1997)研究表明,二歧鹿角蕨叶细胞悬浮培养时,在无生长调节剂的培养基中加入活性炭可极大增加再生孢子体的数量,其改善程度取决于细胞团块大小和培养基组成。【本研究切入点】目前,关于鹿角蕨组织培养的报道大多以幼孢子体茎尖或叶片为外植体,存在繁殖效率低等问题,且鹿角蕨不同品种对培养基的要求不同,不同激素对不同品种的效应也存在差异。【拟解决的关键问题】采用二歧鹿角蕨孢子无菌萌发形成GGB的快速繁殖途径,筛选适宜孢子消毒的灭菌方法及GGB增殖、丛生芽增殖和试管苗生根培养基配方,建立孢子萌发与快速繁殖技术体系,为鹿角蕨规模化育苗提供技术支撑。
1 材料与方法
1. 1 试验材料
试验在福建省特色花卉工程技术研究中心花卉育种实验室进行。以二歧鹿角蕨(Platycerium bifurcatum)孢子作为启动培养的外植体。试剂均为分析纯(国药集团化学试剂有限公司);白糖为优质白砂糖(厦门古龙牌);琼脂粉、卡拉胶(日本),強度1400 g/cm2;花宝1号(美国),其N∶P∶K质量比7∶6∶19。超声波清洗器为舒美牌旋钮型台式超声波清洗器(型号KQ-100E,昆山市超声仪器有限公司),其主要技术参数:清洗槽容量4 L,超声功率100 W,超声频率40 KHz,加热功率400 W,温度常温至80 ℃可调。
1. 2 试验方法
1. 2. 1 外植体消毒灭菌 从鹿角蕨健康母株上切取带有成熟孢子的叶片,用自来水冲洗干净,将叶片切割成2.0 cm×5.0 cm的片块,在超净工作台上采取3种不同消毒方法进行灭菌处理:(1)75%酒精30 s+0.1% HgCl2溶液浸泡 8 min+无菌水冲洗5次;(2)75%酒精30 s+0.1% HgCl2溶液浸泡4 min+无菌水冲洗3次+超声波清洗器振荡清洗20 min;(3)超声波清洗器振荡清洗40 min。其中超声波清洗器清洗槽中添加的清洗液为无菌水,接种室空调温度为25 ℃。外植体经3种方法处理后,分别取出放入无菌容器中,再用无菌纸巾吸干水分,用无菌刀片刮下孢子,备用。
1. 2. 2 孢子萌发 将上述不同消毒方法处理好的孢子接种到萌发培养基MS+TDZ 0.5 mg/L+NAA 0.1 mg/L+活性炭0.5 g/L+白糖30.0 g/L+琼脂粉5.0 g/L中进行培养,每处理接种10瓶,3次重复,并定期观察污染与萌发情况,接种30 d后统计污染率与孢子萌发率。
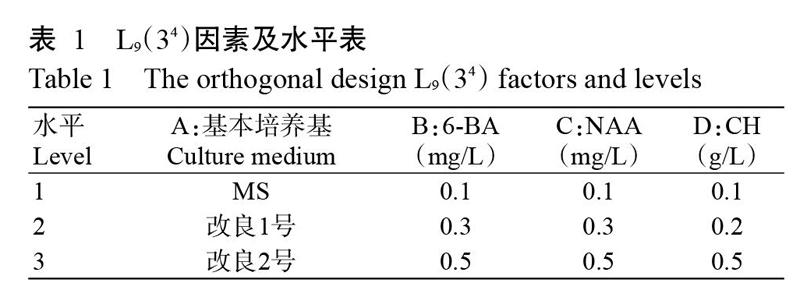
1. 2. 3 GGB增殖与芽分化 以孢子萌发获得的GGB为增殖培养材料,采用4因素3水平L9(34)正交设计,选择基本培养基、6-BA、NAA、水解酪蛋白(CH)为试验因素,各设3个水平(表1)。各处理培养基均附加白糖30.0 g/L、琼脂粉3.0 g/L、卡拉胶3.0 g/L。每处理接种5瓶,每瓶接入GGB重量5.0~6.0 g,3次重复,共9个处理。
将增殖获得的GGB接种到芽分化培养基改良2号+IBA 0.5 mg/L+活性炭0.5 g/L+白糖30.0 g/L+琼脂粉5.0 g/L中进行芽分化培养。
改良1号基本培养基组分:花宝1号1.80 g/L、KNO3 0.95 g/L、(NH4)2SO4 0.85 g/L、KH2PO4 0.25 mg/L、MgSO4·7H2O 0.25 g/L、CaCl2·2H2O 0.40 g/L、FeSO4·7H2O 27.80 mg/L、Na2·EDTA 37.30 mg/L、VB1 10.00 mg/L、VB5 5.00 mg/L、VB6 1.00 mg/L、甘氨酸2.00 mg/L、肌醇150.00 mg/L。
改良2号基本培养基组分:花宝1号1.20 g/L、KNO3 0.95 g/L、(NH4)2SO4 0.85 g/L、KH2PO4 0.25 mg/L、MgSO4·7H2O 0.25 g/L、CaCl2·2H2O 0.20 g/L、MnSO4·H2O 16.90 mg/L、ZnSO4·7H2O 8.60 mg/L、H3BO3 6.20 mg/L、KI 0.83 mg/L、Na2MoO2·2H2O 0.25 mg/L、CoCl2·6H2O 0.025 mg/L、CuSO4·5H2O 0.025 mg/L、FeSO4·7H2O 27.80 mg/L、Na2·EDTA 37.30 mg/L、VB1 5.0 mg/L、VB5 3.0 mg/L、VB6 1.0 mg/L、甘氨酸2.0 mg/L、肌醇180.0 mg/L。
1. 2. 4 丛生芽增殖培养 以上述分化培养获得的小芽为丛生芽增殖培养材料,芽增殖采用4因素3水平L9(34)正交设计,以改良2号为基本培养基,选择6-BA、KT、NAA、IBA为试验因素,各因素取3个水平(表2)。各处理培养基均附加琼脂粉3.0 g/L、卡拉胶3.0 g/L、香蕉粉3.0 g/L、活性炭0.3 g/L、白糖30.0 g/L,每处理接种10瓶,每瓶接种12团(每团带3~5个小芽),3次重复。增殖培养60 d时统计丛生芽增殖系数(增殖系数=增殖芽数/接种芽数)。
1. 2. 5 生根培养 将获得的健壮丛生芽切割成单芽(芽大小为2.0~2.5 cm)作为生根培养材料,接种于以改良1号为基本培养基,添加不同浓度NAA(0、0.1、0.3、0.5 mg/L)、活性碳0.5 g/L、白糖20.0 g/L、香蕉粉3.0 g/L、琼脂粉3.6 g/L及卡拉胶3.6 g/L的4种培养基中,每处理接种5瓶,每瓶接种25株,3次重复。生根培养75 d时统计生根情况。
1. 2. 6 炼苗移栽 当幼苗长至高4.0~5.0 cm、3~4片叶时,将其置于遮光率70%~80%的温室中炼苗并进行移栽种植,定期观测植株移栽成活率及生长表现。
1. 2. 7 培养方式与培养条件 以650 mL的组培瓶为培养容器,采用固体培养基培养方式,pH 5.6~5.8,培养温度(24±3)℃,光照强度1500~2000 lx,光照时间10 h/d。
1. 3 统计分析
采用正交设计助手v3.1进行数据分析。
2 结果与分析
2. 1 不同消毒灭菌方法对鹿角蕨孢子萌发的影响
将消毒灭菌后的孢子接种到萌发培养基中进行无菌萌发,培养10~15 d,孢子由棕黄色逐渐转绿,并膨胀生长,产生类似兰花原球茎的GGB(图1)。培养30 d时,统计孢子萌发与污染情况。从表3可知,不同消毒灭菌处理方法对孢子外植体灭菌和萌发的影响达显著水平(P<0.05,下同),其中超声波清洗振荡40 min的污染率最低,仅为6.7%,显著低于其他灭菌方法,且萌发率达100.0%,显著高于其他灭菌方法。综合考虑灭菌效果与萌发率,超声波清洗器振荡清洗的方法更适合于外植体的灭菌消毒。
2. 2 鹿角蕨GGB增殖与芽分化
2. 2. 1 GGB增殖 GGB接种14 d时,切口部位开始膨大,21 d时不同处理组陆续增殖。增殖培养42 d时统计GGB增殖系数,结果见表4和表5。表4结果表明,从k值可看出,在GGB增殖过程中,以改良1号为基本培养基较好,6-BA适宜浓度为0.5 mg/L,NAA适宜浓度为0.1 mg/L,CH适宜浓度为0.2 g/L;從R可看出,不同因素对GGB增殖影响的主次关系为A>B>D>C,说明对GGB增殖起主要作用的是基本培养基,其次是6-BA和CH,NAA对增殖的影响较小。GGB增殖最佳处理组合是A2B3C1D2,即改良1号+6-BA 0.5 mg/L+NAA 0.1 mg/L+CH 0.2 g/L,增殖培养42 d,平均增殖系数达5.5。
从表5可知,基本培养基、6-BA和CH这3种因素均显著影响鹿角蕨GGB增殖系数,但其影响程度有明显差异,表现为基本培养基>6-BA>CH,NAA对鹿角蕨GGB增殖系数无显著影响(P>0.05,下同),与极差分析结果一致。
2. 2. 2 GGB分化出芽 将GGB接种到芽分化培养基改良1号+IBA 0.5 mg/L+活性炭0.5 g/L+白糖30.0 g/L+琼脂粉5.0 g/L中进行培养(叶秀仙等,2020)。培养30 d时,陆续分化出芽(图2)。
2. 3 鹿角蕨丛生芽增殖
丛芽团接种28 d时,芽基部切口部位开始膨大,35 d时不同处理组陆续长出丛生芽。增殖培养60 d时统计丛生芽增殖系数,结果见表6和表7。从表6可知,从k值可看出,在鹿角蕨丛生芽增殖培养过程中,IBA适宜浓度为0.5 mg/L,6-BA适宜浓度为0.3 mg/L,KT适宜浓度为0.1 mg/L,NAA适宜浓度为0.3 mg/L;从R可看出,不同因素对丛生芽增殖影响的主次关系为D>A>C>B,说明对鹿角蕨丛生芽增殖起主要作用的是IBA,其次是6-BA和NAA,KT对丛生芽增殖的影响较小。丛生芽增殖最佳处理组合是A2B1C2D3,即6-BA 0.3 mg/L+KT 0.1 mg/L+NAA 0.3 mg/L+IBA 0.5 mg/L,60 d平均增殖系数达5.3,实现了种苗大量繁殖,为规模化育苗提供了技术保障(图3)。
从表7可知,IBA显著影响鹿角蕨丛生芽增殖系数,其影响程度最大,与极差分析结果一致。其他因素对丛生芽增殖无显著影响。
2. 4 鹿角蕨生根培养及移栽
从表8可知,在0~0.5 mg/L范围内,随着NAA浓度的升高,生根数和生根率均呈先升高后降低的變化趋势,当NAA浓度为0.3 mg/L时生根数最多,生根率最高,说明添加NAA 0.3 mg/L为最适浓度。
当苗高5.0~6.0 cm,具3~4片叶时,将瓶苗放置于遮光率70%~80%的温室中炼苗约10 d,以提高瓶苗适应力,适应栽培环境。炼苗后进行清水洗苗,洗净根部粘连的培养基,然后将其置于1.0 g/L多菌灵或百菌清杀菌剂溶液中浸泡消毒5 min,捞出晾干,及时剔除畸形、弱小植株,采用泥炭土与珍珠岩(体积比2∶1)作为栽培基质,植入50孔穴盘中,摆放在温室层架上进行常规栽培管理。移栽种植2个月,成活率达98.5%(图4)。
3 讨论
鹿角蕨的叶有二型,分为基部盾形叶和孢子叶,基部盾形叶又叫不育叶或营养叶,孢子叶又叫可育叶或正常叶(Oliwa et al.,2016),孢子囊散生于孢子叶主裂片第1次分叉的凹缺处以下,初时绿色,成熟时棕黄色,每一孢子叶上均密集分布大量孢子,正常条件下,孢子自然萌发率低,而通过组织培养技术进行孢子无菌萌发,可加快鹿角蕨繁殖速度,获得大量组培苗。但由于孢子颗粒极其微小,且裸露于空气中,如何采取有效消毒方法,避免孢子因被消毒剂杀伤致成活率低下而影响萌发,即外植体消毒灭菌是否成功是孢子无菌萌发至关重要的环节。酒精和HgCl2是植物组织培养中常用的消毒剂,其中75%酒精比其他浓度的酒精具有更强的杀菌力和穿透力,但不能彻底杀菌,因此常用作表面消毒的第一步,与HgCl2消毒剂配合使用,而HgCl2的使用浓度与消毒时间掌控较严格,且具有一定毒害作用。此外,超声波清洗也可进行外植体消毒,其原理为超声波作用于液体中时,液体中每个气泡的破裂会产生能量极大的冲击波,相当于瞬间产生几百度的高温和高达上千大气压,这种现象被称之为“空化作用”,超声波清洗正是利用液体中气泡破裂所产生的冲击波来达到清洗和冲刷工件内外表面的作用。本研究结果表明,采用超声波清洗器振荡清洗40 min能达到理想的消毒效果,污染率仅为6.7%,且孢子萌发率可达100.0%,与超声波处理抱茎獐牙菜种子(张卫华和董江泽,2009)及国槐种子(林海,2011)均能促进萌发的研究结果相似,说明采用超声波清洗器振荡清洗能明显促进孢子和种子的萌发,可能是超声波的生物学效应发挥了主要作用,低强度超声波作用于孢子和种子的细胞,会产生胞内微流、胞内质的旋转及涡流运动,提高细胞膜和细胞壁的穿透性,促进了孢子和种子的新陈代谢,从而获得更多能量使得某些关键酶的活性增强,打破孢子和种子的休眠,促使其萌发率提高。
鹿角蕨孢子萌发后形成GGB,类似于兰花组培中的原球茎,原球茎的增殖可在短时间内实现兰花试管苗的大量繁殖,也是各种兰花开展工厂化种苗生产的关键环节。鹿角蕨GGB增殖、芽增殖与生根受培养条件的影响明显,尤其培养基类型、植物生长调节剂的种类和浓度、有机添加物及培养方式等是关键因素。本研究结果表明,在GGB增殖正交设计试验中,对GGB增殖起主要作用的是基本培养基,其次是6-BA和CH,NAA对增殖的影响较小,以改良1号为基本培养基较好,6-BA适宜浓度为0.5 mg/L,NAA适宜浓度为0.1 mg/L,CH适宜浓度为0.2 g/L,与黄韶玲和张洁莲(1993)认为低浓度激素有利于GGB增殖,高浓度激素不利于GGB生长的研究结果一致。在植物组织培养中,基本培养基的选择是除培养材料外决定培养能否成功的另一个重要因素。培养基的种类、成分等均直接影响培养材料的生长发育,所以应根据培养材料的种类和部位,通过试验对比来筛选适宜的基本培养基。植物激素对细胞的生长、分化和发育等一系列的生理变化和形态建成起着控制作用,但作用过程十分复杂,并不是某种激素单独使用的结果,而是不同激素在一定条件下相互作用的结果,因此,需根据培养材料的特点通过反复试验来筛选适宜的激素种类及浓度。此外,培养基配方并非一成不变,其更优化的培养方案有待进一步试验探讨。
在丛生芽增殖正交设计试验中,本研究结果表明,对鹿角蕨丛生芽增殖起主要作用的是IBA,其次是6-BA和NAA,KT对丛生芽增殖的影响较小,IBA适宜浓度为0.5 mg/L,6-BA适宜浓度为0.3 mg/L,KT适宜浓度为0.1 mg/L,NAA适宜浓度为0.3 mg/L,与王承义和王颖(2000)认为细胞分裂素6-BA与KT相比,6-BA更有利于芽的分化与增殖的观点相似,而与黄执缨(2004)认为KT适宜于二歧鹿角蕨丛生芽诱导的结果不一致。但对于IBA对芽增殖起关键作用的结果,未见有鹿角蕨组培相关报道,IBA促进芽增殖,其作用机理还有待于进一步研究探讨。
4 结论
与常规酒精与HgCl2配合消毒法相比,超声波清洗器振荡清洗40 min能有效降低鹿角蕨孢子污染率,提高孢子萌发率。鹿角蕨GGB增殖培养基以改良1号+6-BA 0.5 mg/L+NAA 0.1 mg/L+CH 0.2 g/L较适宜,丛生芽增殖培养基以改良2号+6-BA 0.3 mg/L+KT 0.1 mg/L+NAA 0.3 mg/L+IBA 0.5 mg/L较适宜,生根培养基以改良1号+NAA 0.3 mg/L较适宜。
参考文献:
郭捡,刘婷婷,孟宪利,刘保东. 2013. 鹿角蕨的孢子培养及其繁殖[J]. 园艺学报,40(1):155-162. [Guo J,Liu T T,Meng X L,Liu B D. 2013. Spore culture and propagation of Platycerium wallichii[J]. Acta Horticulturae Sinica,40(1):155-162.]
郭捡,王玥,郭梦桥,刘保东. 2012. 鹿角蕨有性世代发育及繁殖技术研究[J]. 中国农学通报,28(28):216-219. [Guo J,Wang Y,Guo M Q,Liu B D. 2012. Study on sexual generation and propagation of Platycerium wallichii Hook[J]. Chinese Agricultural Science Bulletin,28(28):216-219.]
黃韶玲,张洁莲. 1993. 鹿角蕨的组织培养[J]. 植物生理学通讯,(1):46-47. [Huang S L,Zhang J L. 1993. Tissue culture of Platycerium bifurcatum[J]. Plant Physiology Communications,(1):46-47.]
黄执缨. 2004. 二歧鹿角蕨组织培养的研究[J]. 生物学杂志,21(5):22-24. [Huang Z Y. 2004. Study on tissue culture of Platycerium bifurcatum[J]. Journal of Biology,21(5):22-24.]
林海. 2011. 国槐种子超声波处理效应研究[J]. 北方园艺,(20):51-54. [Lin H. 2011. Effects of ultrasonic wave on Sophora japonica seeds[J]. Northern Horticulture,(20):51-54.]
沈晓岚,王炜勇,俞信英. 2008. 鹿角蕨属植物研究进展[J]. 现代农业科技,(12):32-47. [Shen X L,Wang W Y,Yu X Y. 2008. Advances in the study of Platycerium[J]. Mo-dern Agricultural Science and Technology,(12):32-47.]
王承义,王颖. 2000. 鹿角蕨组织培养[J]. 中国林副特产,(3):23-24. [Wang C Y,Wang Y. 2000. Tissue culture of Platycerium wallichii[J]. Forest By-product and Speciality in China,(3):23-24.]
叶秀仙,方能炎,吴建设,钟淮钦. 2020. 应用正交设计优选二歧鹿角蕨球状体分化培养基研究[J]. 福建农业科技,(2):24-27. [Ye X X,Fang N Y,Wu J S,Zhong H Q. 2020. Study on optimization of differentiation medium for green globularbodies of Platycerium bifurcatum by using orthogonal design[J]. Fujian Agricultural Science and Technology,(2):24-27.]
张卫华,董汇泽. 2009. 超声波处理抱茎獐牙菜种子萌发试验研究[J]. 青海大学学报(自然科学版),27(2):57-59. [Zhang W H,Dong H Z. 2009. Experimental study on ultrasonic waves treatment for promoting Swertia franche-tiana seed germination[J]. Journal of Qinghai University(Nature Science),27(2):57-59.]
张哲,区智,李双智,杨自云,邓莉兰. 2018. 鹿角蕨的资源调查与保护[J]. 黑龙江农业科学,(7):89-92. [Zhang Z,Ou Z,Li S Z,Yang Z Y,Deng L L. 2018. Resources investigation and conservation of Platycerium wallichii[J]. Heilongjiang Agricultural Science,(7):89-92.]
Camloh M,Gogala N. 1991. Platycerium bifurcatum-adventitious bud and root formation without growth regulators in vitro[J]. Acta Horticulturae,(289):89-90.
Camloha M,Gogala N,Rode J. 1994. Plant regeneration from leaf explants of the fern Platycerium bifurcatum in vitro[J]. Scientia Horticulturae,56(3):257-266.
Kwa S H,Wee Y C,Lim T M,Kumar P P. 1997. Morphogenetic plasticity of callus reinitiated from cell suspension cultures of the fern Platycerium coronarium[J]. Plant Cell,Tissue and Organ Culture,48:37-44.
Oliwa J,Kornas A,Skoczowski A. 2016. Morphogenesis of sporotrophophyll leaves in Platycerium bifurcatum depends on the red/far-red ratio in the light spectrum[J]. Acta Phy-siologiae Plantarum,38:247.
Teng W L. 1997. Activated charcoal affects morphogenesis and enhances sporophyte regeneration during leaf cell suspension culture of Platycerium bifurcatum[J]. Plant Cell Reports,17(2):77-83.
(责任编辑 王 晖)
收稿日期:2020-03-03
基金项目:福建省属公益科研院所基本科研专项(2017R1026-9);福建省农业科学院特色花卉创新团队项目(STIT2017-2-9)
作者简介:*为通讯作者,钟淮钦(1979-),副研究员,主要从事观赏植物种质资源评价与生物技术研究工作,E-mail:zhqeeast@163.com。叶秀仙(1977-),副研究员,主要从事花卉育种与组织培养技术研究工作,E-mail:yxx7861@163.com

