紫苏提取物的抗氧化性能及其对晚期糖基化末端产物的抑制作用
(食品营养与安全教育部重点实验室及天津市食品营养与安全国家重点实验室, 天津市食品加工过程控制与安全工程技术中心,天津科技大学食品工程与生物技术学院,天津 300457)
作为药食同源植物之一,紫苏富含多糖、黄酮、多酚类等多种抗氧化成分。其中,含量较高的迷迭香酸(Rosmarinic acid,RosA)能够有效清除体内自由基并抑制AGEs的生成[1-2]。在我国,紫苏资源丰富且成本低廉,在抑制食品加工过程中AGEs生成方面具有广阔的应用前景。
晚期糖基化产物(Advanced glycation end products,AGEs)是指在蛋白质、脂肪酸或核酸的氨基与还原糖的醛基之间发生非酶性糖基化反应而形成的一系列具有高度活性终产物的总称[3]。AGEs能够与身体组织细胞结合并将其破坏,从而加速人体衰老,引起多种慢性退化性疾病,如糖尿病、阿尔茨海默病、动脉粥样硬化等。因此,降低机体内AGEs含量对人体健康有着重要的意义。食品中 AGEs 形成的最主要途径是还原糖与蛋白质、脂质和核酸等的氨基反应的美拉德途径。过程中会形成Amadori产物,该产物经过脱水、重排形成活性羰基化合物,最后再与蛋白质中的氨基聚合产生AGEs[4]。因此对蛋白质羰基、巯基含量的测定能较好地评价AGEs的形成。研究表明,抗氧化活性成分可有效抑制食品加工过程中AGEs的形成,从而减少食物源AGEs的摄入[5-6]。国内现在很多对AGEs研究的重点都在医学上,而从食品添加剂角度来控制AGES含量的研究资料相对较少。目前已有学者发现一些可以抑制AGEs生成的天然抗氧化剂,其中大多数从草本植物中提取。紫苏提取物具有较高的抗氧化活性,理论上可以有效抑制AGEs的生成。但是,紫苏中抗氧化活性成分复杂,极性不同,如何从紫苏中获得最高含量的抗氧化活性成分来应用于抑制AGEs生成才是本实验研究的关键问题。
本文基于单纯形-重心设计实验方法,以抗氧化活性以及AGEs生成抑制率为评价指标,对紫苏中活性成分进行提取工艺优化,建立BSA/Glucose体外模拟体系,初步探究紫苏中抗氧化成分抑制AGEs生成的机理,实验结果为紫苏的应用开发提供一定的科学依据。
1 材料与方法
1.1 材料与仪器
紫苏 自种;甲醇 色谱纯,利安隆博华(天津)医药化学有限公司;牛血清白蛋白(BSA) 分析纯,源叶生物科技有限公司;葡萄糖(Glucose,Glu) 分析纯,天津大茂化学试剂厂;盐酸胍 分析纯,北京Solarbio科技有限公司;迷迭香酸(纯度≥97%) 分析纯,上海阿拉丁生化科技股份有限公司;考马斯亮蓝R250 分析纯,沈阳乐衡科技有限公司;氨基胍(Aminogunidine,AG)、2-硝基苯甲酸(DTNB)、2,4-二硝基苯肼(DNPH) 分析纯,购自Sigma公司;其他试剂 均为国产分析纯。
Agilent 8453型紫外-可见分光光度计 北京普析通用仪器有限公司;FLx800型荧光酶标仪 BioTek有限公司;DYY-87型电泳仪 北京六一仪器厂;Seven Easy台式酸度计 METTLER TOLEDO公司;Alpha-2LDplus真空冷冻干燥机 北京五洲东方科技发展有限公司;AW220万分之一电子天平 日本岛津公司;Infinite M200 Pro全波段酶标仪 上海闪谱生物科技有限公司;RE-2000A旋转蒸发器 上海亚荣生化仪器厂;Agilent 1260高效液相色谱系统(配有紫外、荧光、二极管阵列检测器、自动进样及半制备装置) 安捷伦科技有限公司。
1.2 实验方法
1.2.1 紫苏提取物的制备 取一定量紫苏粉(过80目筛),料液比为1∶40,参照表1配制混合溶剂体系(100 mL),以甲酸调节溶液pH至3.0,超声提取(40 kHz,100 W,60 min),抽滤,55 ℃旋转蒸发除有机溶剂后进行冷冻干燥,得到紫苏提取物[7-10]。
1.2.2 单纯形-重心设计实验 采用三因素单纯形-重心设计实验方法[11],以蒸馏水,无水乙醇和甲醇为自变量(X),以活性成分对DPPH·和ABTS·清除能力、FRAP抗氧化能力及AGEs生成的抑制能力为评价指标(Y),实验设计方案如表1所示。

表1 不同提取溶剂分组情况Table 1 Grouping of different extraction solvents
注:X1:蒸馏水,X2:无水乙醇,X3:无水甲醇,单位为mL。
1.2.3 紫苏提取物抗氧化活性评价
1.2.3.1 DPPH法 用无水乙醇配制DPPH溶液(0.2 mmol/L)。称取一定量紫苏提取物,以无水乙醇稀释适当倍数作为实验组,无水乙醇为空白对照组。取一定体积的DPPH和样品混匀,于室温避光反应30 min,518 nm下测定吸光值。实验中以水溶性维生素E(Trolox)为阳性对照,结果以VE的当量浓度表示[12]。
1.2.3.2 ABTS法 用蒸馏水配制ABTS工作液(7 mmol/L)。以无水乙醇稀释后的紫苏提取物为实验组,无水乙醇为空白对照组。取一定体积的ABTS工作液与样品混匀并避光反应3 min,于734 nm下测定吸光值,以Trolox为阳性对照结果,以VE的当量浓度表示[13]。
1.2.3.3 FRAP 法 用40 mmol/L盐酸溶液、0.3 mol/L醋酸钠溶液、10 mmol/L TPTZ溶液、0.02 mol/L三氯化铁溶液配制FRAP工作液。以乙醇稀释后的紫苏提取物为实验组,无水乙醇为空白对照组。取一定体积的FRAP工作液与样品混匀,37 ℃下反应10 min,于593 nm处测定吸光值,以Trolox为阳性对照,结果以VE的当量浓度表示。
1.2.4 紫苏提取物对AGEs生成的抑制作用
1.2.4.1 BSA/Glucose体外模拟体系中AGEs的检测 参照文献[14-16]中的方法,以无水乙醇稀释后的紫苏提取物为实验组,未添加提取物的为空白对照组,添加同浓度的氨基胍(AG)作为阳性对照组。分别吸取2 mL葡萄糖溶液(300 mmol/L)、1 mL牛血清白蛋白溶液(10 mg/mL)和100 μL样品(75、150、250、350、450、625 μg/mL),混匀;100 ℃水浴反应1 h,冷却至室温,定容至3 mL;于4 ℃ 10000 r/min离心10 min,取上清液,测定荧光值(激发波长370 nm,发射波长440 nm,狭缝宽度5 nm),计算紫苏提取物对AGEs形成的抑制率。

表2 回归模型Table 2 Regression models
注:设定Y1为DPPH自由基清除能力评价实验的响应值,Y2为ABTS自由基清除能力评价实验的响应值,Y3为FRAP抗氧化能力评价实验结果的响应值,Y4为AGEs抑制能力评价实验的响应值,而X1、X2、X3分别是提取溶剂中蒸馏水、无水乙醇、无水甲醇的添加量。
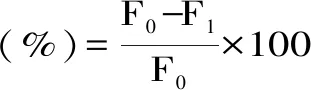
式(1)
式中:F0为空白对照组的荧光强度,F1代表实验组的荧光强度
1.2.4.2 迷迭香酸含量测定 配制迷迭香酸标准溶液并绘制标准曲线,所得的回归方程为y=3739.6+774.8xR2=0.99971。色谱检测条件[17]:色谱柱,依利特C18柱(5 μm,4.6 mm×250 mm);流动相A-水/甲酸(pH=2),流动相B-乙腈(100%);洗脱程序,0~55 min(A,94%~76%),55~55.1 min,(A,76%~94%),55.1~60 min(A,94%);检测器,二极管阵列检测器(DAD);检测波长,λ=330 nm;流速,1 mL/min;柱温,25 ℃;进样量,20 μL。
1.2.4.3 蛋白质羰基(PCO)含量的测定 以BSA溶液为参照,以BSA/Glucose为空白对照,添加AG(60 μg/mL)为阳性对照,不同浓度的紫苏提取物(60、80、100、120 μg/mL)作为实验组分别与2,4-二硝基苯肼(DNPH)溶液(10 mmol/L,1 mL)混匀,避光反应1 h;加入三氯乙酸(1 mL),10000 r/min离心10 min,取下层沉淀加入乙醇-乙酸乙酯混合溶液,12000 r/min离心10 min;取沉淀重复上述步骤3次。以盐酸胍(6 mol/L,pH=2.3,2 mL)溶解沉淀,37 ℃水浴15 min,于370 nm处测定吸光值,记为A(用盐酸胍调零)[18]。PCO的含量按照下面公式计算:

式(2)
式中:A为PCO的含量,nmol/mg protein;B为吸光值;C为摩尔消光系数 22.0 mmol/(L· cm)。
1.2.4.4 蛋白质巯基含量测定 以BSA溶液为参照,以BSA/Glucose为空白对照,添加AG(60 μg/mL)为阳性对照,添加60 μg/mL紫苏提取物作为实验组,分别取2.5 mL磷酸盐缓冲液(PBS)(0.1 mol/L,pH=8.0,含0.1 mol/L-乙二胺四乙酸)和50 μL Ellman试剂(4 mg/mL-DTNB),分别加入250 μL不同浓度的L-半胱氨酸标准溶液(1.5、1.25、1.0、0.75、0.5、0.25、0 mmol/L),避光反应 15 min,于412 nm测定吸光值。以L-半胱氨酸为标准绘制工作曲线Y=0.178x-0.0196,R2=0.996,从而计算样品中巯基含量[19-21]。
1.2.4.5 蛋白交联分析 以BSA溶液为参照,以BSA/Glucose为空白对照,添加AG(100 μg/mL)为阳性对照,不同浓度的紫苏提取物(60、80、100、120 μg/mL)作为实验组,分别于100 ℃沸水浴1 h后进行SDS-PAGE分析。
1.3 数据处理
2 结果与分析
2.1 溶剂对抗氧化物质提取效果的影响
以DPPH·、ABTS·清除能力、FRAP抗氧化能力及AGEs抑制能力为响应值,进行回归拟合并分别建立模型,以探究不同溶剂组合对紫苏中抗氧化物质提取效果的影响,结果如表2和表3所示。

表3 不同溶剂组合的抗氧化物质提取效果及活性评价Table 3 Extraction effect and activity evaluation of antioxidation substances in different solvent combinations
注:X1:蒸馏水,X2:无水乙醇,X3:无水甲醇,单位为mL;“-”表示未进行该稀释倍数下的抗氧化实验。
回归拟合结果表明,四组模型均表现为二次项回归显著,每组模型R2值均处于较高水平,说明二次项回归方程拟合较合理,P值范围表明可信度均大于95%,整体达到较为显著的水平;交互项系数的绝对值与线性项系数的绝对值处于同一水平,说明在提取过程中不同溶剂之间具有一定交互作用,会对紫苏中抗氧化物质的提取产生影响。对AGEs抑制能力评价中,X1X3系数的绝对值大幅度超过X1X2、X2X3另外两组系数的绝对值,说明该实验中,蒸馏水与无水甲醇的交互作用对所提取的抗氧化物质浓度变化有较大影响,对于实验结果的影响相比于其他组合也更加明显。表明该方程对实验结果的拟合较为合适,可以对紫苏抗氧化物质在不同提取溶剂比例下的提取浓度进行预测[22]。
由Design-Expert V8.0.6.1软件分析结果可以清晰地观察到混合溶剂对紫苏中抗氧化活性物质提取效果的影响(图1、图2)。其中,如果等值线为曲线,说明因素之间有交互作用,曲线弯曲的程度代表相互影响的程度,反之,如果等值线为直线,说明因素之间没有交互作用,互不影响[23]。
由图1和图2 可知,三种提取溶剂之间具有一定的交互作用,同时对紫苏提取物中抗氧化物质的提取产生影响。在DPPH·清除实验中,蒸馏水和无水乙醇的交互作用较明显,说明蒸馏水和无水乙醇的共同作用对紫苏抗氧化物质的提取结果影响较大;在ABTS·清除实验以及FRAP抗氧化能力测定实验中,等值线弯曲程度均较弱,说明3种混合溶剂之间的交互作用对紫苏抗氧化物质的提取影响不显著;紫苏提取物对AGEs抑制能力实验中,蒸馏水和无水甲醇之间存在明显的交互作用,这一点与回归模型结论相同。根据Design-Expert V8.0.6.1的优化功能并结合二次回归模型的数学分析结果,设定3种提取溶剂的变化范围和响应值为极大值,得到预测值,即在总量为100 mL混合溶剂体系中,当提取溶剂中无水乙醇、蒸馏水、无水甲醇比例为1∶1.2∶3.4时,可获得最佳的提取效果,对AGEs生成抑制率的预测值为86.1%,相同实验条件下所得AGEs生成抑制率为83.4%,与预测值接近,验证了回归拟合模型的可靠性。

图1 混合溶剂的交互作用对抗氧化物质提取影响的等高线图Fig.1 Contour plots of the interaction of different solvents on the extraction of antioxidants

图2 混合溶剂的交互作用对抗氧化物质提取的影响的响应面图Fig.2 Response surface map of the interaction of different solvents on the extraction of antioxidants
2.2 BSA/Glucose体外模拟体系中AGEs检测
以AG为阳性对照,考察紫苏提取物对BSA/Glucose模拟体系中AGEs生成的抑制作用,结果如图3所示。由图3可知,在相同质量浓度下,紫苏提取物对AGEs生成的抑制率总是大于氨基胍的抑制率。当浓度为75 μg/mL时,紫苏提取物对AGEs的抑制率达47.3%、氨基胍的抑制率为42.5%;当浓度达到625 μg/mL时,紫苏提取物对AGEs的抑制率达到78.1%,而氨基胍的抑制率为60.3%。该结果充分说明,与氨基胍相比紫苏提取物对AGEs的生成表现出较强的抑制作用。因此,紫苏提取物可作为一种良好的天然抗氧化剂应用于食品加工过程中以有效地抑制AGEs的生成;但是,其中发挥作用的活性物质及抑制机理尚不明确。

图3 紫苏提取物和氨基胍对BSA-Glucose 体外模拟反应体系中AGEs的抑制效果Fig.3 Inhibitory effect of Perilla frutescens extract and amino guanidine on AGEs in BSA-Glucose system
2.3 抗氧化组分分析
据文献报道,紫苏中含有较高含量的迷迭香酸,该物质具有较强的抗氧化活性。因此,本文采用HPLC方法对紫苏提取物中的迷迭香酸进行含量测定,结果如图4所示。

图4 迷迭香酸和紫苏提取物样品色谱分析图Fig.4 Chromatographic analysis of rosmarinic acid and Perilla frutescens extract
迷迭香酸标准曲线拟合方程为y=3739.6+774.8x,R2=0.99971,根据方程求得紫苏提取物中迷迭香酸含量为14.8 mg/g,将该数据与张玲[24]的研究结果进行对比,与其紫苏叶中提取的迷迭香酸含量基本一致,证实了混合溶剂提取效果的可靠性。这里,本文仅对紫苏提取物中的一种抗氧化物质进行了定量分析,有关其中起到抑制AGEs生成的关键活性成分的确定仍需进一步研究。
2.4 紫苏提取物对荧光性AGEs生成抑制机理探究
2.4.1 蛋白质羰基含量的测定 美拉德反应中活性羰基化中间产物能与蛋白质反应形成不可逆的AGEs产物,因此降低羰基产物的形成,就能阻断AGEs的形成[25]。如图5所示,BSA/Glucose模拟反应体系中的蛋白质羰基含量明显高于仅含BSA的实验组,说明有葡萄糖存在时,发生糖基化反应的几率大大增加,同时生成的PCO含量较高。当加入60 μg/mL的氨基胍后,PCO含量明显下降,说明氨基胍能有效抑制蛋白氧化生成羰基,羰基含量与蛋白糖基化程度成正比。添加不同浓度的紫苏提取物后,PCO含量随加入紫苏提取物的浓度增加而不断降低,但与相同浓度(60 μg/mL)氨基胍相比,抑制效果较差;当紫苏提取物浓度增加至120 μg/mL时,PCO含量明显低于氨基胍用量为60 μg/mL时的结果。因此,紫苏提取物可有效抑制模拟体系中蛋白质糖基化反应,并且这种抑制效果呈现浓度依赖性,但与相同浓度的氨基胍相比效果较弱,这可能是由于紫苏中抗氧化物质并不主要针对蛋白质羰基起抑制作用,因此效果不如氨基胍理想。

图5 紫苏提取物对BSA/Glucose 模拟体系中蛋白质羰基含量的影响Fig.5 Effects of Perilla frutescens extract on the content of protein carbonyl in the BSA/Glucose system
2.4.2 蛋白质巯基含量的测定 蛋白质巯基含量的变化是蛋白质是否氧化的重要标志。为进一步探究紫苏提取物抑制AGEs生成的机理,采用Ellman法测定沸水浴1 h后反应体系中蛋白质巯基含量的变化。由图6可知,与仅含BSA的对照组相比,BSA/Glucose模拟反应体系中巯基含量明显降低,说明BSA发生了氧化反应,降低量为35.3%。当添加60 μg/mL氨基胍(即组别:BSA/Glucose/AG(60 μg/mL))后,反应体系中巯基含量增加,但仍明显低于仅含BSA的对照组;而当添加紫苏提取物(即组别:BSA/Glucose/perilla(60 μg/mL))后,反应体系中巯基含量明显增加,且增加量高于添加相同浓度氨基胍的实验组,说明与氨基胍相比,紫苏提取物能够更好的抑制蛋白质巯基氧化反应的发生。这可能是由于紫苏中存在具有抗氧化活性、能清除活性氧和自由基的多酚或类黄酮类化合物从而防止蛋白质的巯基被氧化。

图6 紫苏提取物与氨基胍在BSA/Glucose模拟体系中 对蛋白质巯基含量的影响对比Fig.6 Different effects of Perilla extract and AG on protein sulfhydryl in the BSA/Glucose system
2.4.3 牛血清白蛋白交联分析 由SDS-PAGE电泳图谱(图7)可知,与未发生糖基化反应的BSA(66 kDa)相比,发生糖基化的BSA分子量约为100 kDa,分子量明显增加,这说明牛血清白蛋白在非酶糖基化反应过程中与葡萄糖分子发生了交联,导致交联后的蛋白分子量增大,电泳条带滞后。当加入相同浓度(100 μg/mL)的紫苏提取物和氨基胍之后,可以观察到100 kDa条带明显变浅,表明紫苏和氨基胍均能抑制蛋白与葡萄糖交联。通过计算糖基化与未糖基化的BSA比例,相同浓度下紫苏提取物对蛋白质交联的抑制效果明显高于氨基胍,并且随着紫苏提取物浓度增加,对蛋白质交联的抑制效果越好,说明其抑制效果也存在浓度-剂量依赖效应。
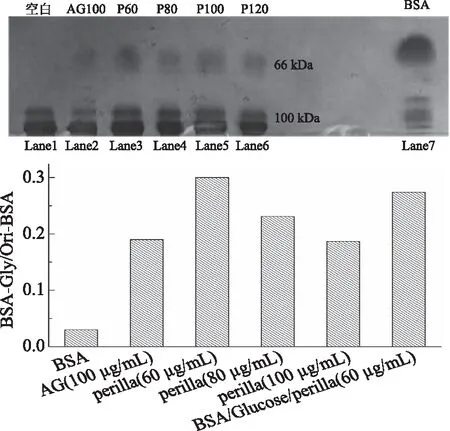
图7 紫苏提取物对BSA/Glucose 体外模拟反应体系中BSA交联的影响Fig.7 Effects of Perilla frutescens extract on BSA cross-linking in BSA/Glucose system. 注:Lane1:BSA/Glucose;Lane2:BSA/Glucose/AG
3 结论
本研究采用单纯形-重心设计法,将3种提取溶剂以不同比例混合,对紫苏中抗氧化活性成分提取工艺进行优化,并对其进行体外抗氧化活性评价,同时建立BSA/Glucose体外模拟体系以考察紫苏提取物对AGEs生成的抑制效果,并对其抑制机理进行初步探究。当混合提取溶剂无水乙醇、蒸馏水、无水甲醇比例为1∶1.2∶3.4 (v/v/v)时,所得紫苏提取物具有较高的体外抗氧化活性以及较好的抑制AGEs生成效果,而且3种提取溶剂之间具有一定的交互作用。紫苏提取物可明显抑制蛋白糖基化过程中羰基的生成、巯基的氧化以及蛋白的交联,但其中的主要活性成分及更为深入的抑制机理有待进一步研究。

