微生物发酵对麦麸水溶性多酚含量、组成及抗氧化活性的影响研究
,*
(1.内蒙古农业大学动物科学学院,内蒙古呼和浩特 010018; 2.内蒙古自治区草食家畜饲料工程技术研究中心,内蒙古呼和浩特 010018)
植物多酚广泛分布于植物的根、叶、皮、果实、果皮中,又称鞣质、单宁,是一类具有多羟基化合物的次生代谢产物[1]。多酚的结构有着独特的性质,能够与蛋白质、多糖等相结合,并且可与金属离子形成络合物[2]。多酚一般分为游离酚、结合酚和束缚型多酚,其中游离酚和结合酚属于可溶性酚类物质,而束缚型多酚属于不可溶型酚类物质[3]。植物多酚具有清除自由基、抗过敏、抗诱变、降血脂等生理功能[4]。同时,多酚还具有很强的抗氧化活性,很多研究表明多酚的抗氧化活性与其含量、结构有着密切的关系[5-9]。
小麦麸皮是小麦加工成面粉的过程中产生的主要副产品[10],多糖和多酚是麦麸中最主要的生理活性物质,对机体的健康发挥着至关重要的作用。由于人们早期对于小麦麸皮的营养价值和功能作用认识不够全面,直接将其用作饲料和一些产品原料[11],使得其价值得不到充分发挥,造成了这一资源的严重浪费。
小麦麸皮多酚大多存在于细胞壁,且以酯键或醚键的形式与糖相结合[12]。目前已经有越来越多关于从麸皮中提取多酚的研究,例如一些传统的水提法,超声波辅助法,微波辅助法、生物法等[13]。微生物发酵法提取多酚是目前的研究热点。例如,胡博涵[3]通过微生物发酵的方法,将麦麸中的束缚型酚酸释放,提高了麦麸的总酚含量和阿魏酸含量,并且提高了其抗氧化活性。周聪[14]通过微生物发酵得到紫麦麸皮总酚含量比未发酵提高了两倍,并且提高了紫麦麸皮的抗氧化活性。由此可见,微生物发酵法处理麸皮,不仅可提高多酚含量和改变其组成,而且可增强其抗氧化活性,但相关研究主要集中在曲霉菌发酵麸皮提取多酚物质。利用枯草芽孢杆菌和酿酒酵母菌混合发酵提取麸皮多酚的研究尚未见报道。本研究选用枯草芽孢杆菌和酿酒酵母菌固态发酵提取麸皮多酚,分析发酵条件对多酚含量的影响,并对其水溶性多酚的组成和抗氧化活性进行研究,为麸皮的高附加值开发利用提供参考。
1 材料与方法
1.1 材料与仪器
菌种:酿酒酵母CGMCC2.119、枯草芽孢杆菌CGMCC1.892 内蒙古自治区草食家畜饲料工程技术研究中心保存;麸皮、豆粕粉、玉米粉 均购于市场;尿素、乙醇、麦芽汁液体培养基、营养肉汤培养基、没食子酸、福林酚、无水碳酸钠、1,1-二苯基-2-三硝基苯肼(DPPH)、FeSO4、H2O2、水杨酸、Na2HPO4、NaH2PO4、六氰合铁酸钾、三氯乙酸、FeCl3等 均为国产市售。
HVA-85型压力蒸汽灭菌锅、GXZ型智力光照培养箱 宁波东南仪器有限公司;SH2-82型旋转气浴恒温振荡器 金坛市岸头中旺实验仪器厂;ZHJH-C1214C型超净工作台、HH-2数显恒温水浴锅 中国鄄城华鲁电热电器有限公司;TDL-5-A型台式高速离心机 上海安亭科学仪器厂;Epoch2型微孔板分光光度计 美国伯腾仪器有限公司。
1.2 实验方法
1.2.1 微生物发酵条件对麦麸水溶性多酚含量的影响 发酵菌种为酿酒酵母:枯草芽孢杆菌2∶1;实验室成员前期研究发现,玉米粉和豆粕可以提高发酵麸皮中多糖含量[15],通过分析多酚含量发现也有明显提高,故本试验选择发酵底物以麸皮为主(麸皮、玉米粉、豆粕粉各占80.46%、9.32%、10.22%),接种量为10%,将菌液与水以一定比例混合配制成浓度为108CFU/g的菌溶液,与发酵底物混合发酵。
1.2.1.1 发酵时间对麸皮多酚含量的影响 发酵时间设置为48、60、72、84、96 h,液料比(菌溶液∶发酵底物)为1∶1 (mL/g),发酵温度37 ℃,发酵结束后产物于45 ℃烘干,备用。
1.2.1.2 发酵温度对麸皮多酚含量的影响 发酵温度设置为31、34、37、40 ℃,液料比为1∶1,发酵时间84 h,发酵结束后产物于45 ℃烘干,备用。
1.2.1.3 发酵液料比对麸皮多酚含量的影响 发酵液料比设置为1∶1.5、1∶1.2、1∶1、1∶0.8、1∶0.6,发酵时间为84 h,发酵温度37 ℃,发酵结束后产物于45 ℃烘干,备用。
1.2.2 水溶性多酚的提取 将烘干的发酵麸皮和未发酵麸皮粉碎,以1∶16 (g/mL)的料水比,90 ℃恒温水浴35 min,水提后的上清液放入烘箱70 ℃烘干,制得水提物。将水提物用60%乙醇以1∶55 (g/mL)的料液比进行多酚提取,50 ℃水浴2 h,离心取上清,冷冻干燥,制备出游离型多酚提取物。残渣用1 mol/L的NaOH处理16 h,离心取上清,将pH调至中性,冷冻干燥,制备出结合型多酚提取物[16]。
1.2.3 多酚含量的测定 先配制1000 μg/mL没食子酸标准液,然后用上述标准液制作浓度分别为:0、10、20、30、40、50 μg/mL的没食子酸工作液。配制10%福林酚试剂与7.5%的Na2CO3。从不同浓度的没食子酸工作液中取1 mL,加入5 mL 10%的福林酚试剂,摇匀反应3~8 min,加入4 mL 7.5%的Na2CO3摇匀室温反应1 h,在765 nm处测定吸光度,绘制标准曲线。同样方法测定样品吸光值,计算多酚含量(mg/g)。

式中:c为用标准曲线计算得到的多酚浓度,mg/g;V为提取液体积,mL;D为稀释倍数;m为发酵麸皮干粉的质量,g。
1.2.4 多酚组成测定 取冷冻样品0.5 g,加液氮研磨,用8 mL 60%乙醇转移到50 mL锥形瓶,100 Hz超声波提取30 min。冷冻离心机10000 r/min、4 ℃离心10 min,取上清液,旋转蒸发仪中35 ℃低压蒸出乙醇,残渣用20 mL超纯水(Milli-Q超纯水仪,18 MΩ·cm)转移到50 mL锥形瓶中。用1 mol/L氢氧化钠溶液调pH至7.0,加入乙酸乙酯20 mL,振荡10 min,然后转移到分液漏斗中分离,水相用20 mL乙酸乙酯萃取1次,合并酯相为中性酚。再用6 mol/L盐酸溶液调水相pH至2.0,用20 mL乙酸乙酯萃取2次,合并酯相为酸性酚。将中性酚和酸性酚合并后35 ℃下浓缩至干,残渣溶于60%甲醇中,在棕色容量瓶中定容至10 mL,用0.22 μm滤膜过滤,上样检测。
采用Diamonsil C18液相色谱柱(5 μm,4.6 mm×250 mm);柱温30 ℃;流速设为1 mL/min;进样量为10 μL;流动相为0.1 mol/L磷酸盐缓冲液(A)与乙腈水溶液(82∶18,v/v);梯度洗脱程序为0 min,7% B;25 min,18% B;30 min,22% B;31 min,50% B;40 min,50% B。采用VWD测器检测,检测波长为245 nm。
与标准品保留时间比较确定色谱峰所属的化合物种类,通过峰面积计算各种化合物含量,结果以干基表示(mg/kg)。
1.2.5 水溶性多酚抗氧化活性测定
1.2.5.1 还原力测定 将1.2.2中制备的样品溶于水配制成0、0.5、1、2、4 mg/mL的溶液待测,将0.75 mL样品与0.75 mL磷酸盐缓冲液(200 mmol/L,pH=6.6)、0.75 mL 1%六氰合铁酸钾50 ℃反应20 min,加0.75 mL三氯乙酸终止反应,取1.5 mL加1.5 mL水和400 μL 0.1%的FeCl3室温反应10 min,700 nm测定吸光度,吸光度越高,还原力越高。
1.2.5.2 DPPH自由基清除率测定 将1.2.2中制备的样品溶于水配制成0、0.5、1、2、4 mg/mL的溶液待测,参照Musa[17]的方法,2 mL不同浓度样品加2 mL DPPH溶液混匀30 min后517 nm处测定其吸光度。
计算公式:
式中:A0表示样品与DPPH反应吸光度;A1表示样品与95%乙醇反应吸光度;A2表示DPPH与水反应吸光度。
1.2.5.3 羟基自由基清除率测定 将1.2.2中制备的样品溶于水配制成0、0.5、1、2、4 mg/mL的溶液待测,参考Rajauria等[18]的测定方法,0.5 mL样品与0.5 mL FeSO4(9 mmol/L)、H2O2(8.8 mmol/L)室温反应10 min,然后与0.5 mL水杨酸乙醇溶液(9.0 mmol/L)室温反应30 min,510 nm处测定吸光度。
计算公式:
式中:A0表示蒸馏水代替样品吸光度;A1表示样品吸光度;A2表示蒸馏水代替FeSO4溶液吸光度。
1.3 数据统计分析
试验数据采用SAS 9.2统计软件进行了单因素方差分析,采用Origin 94-64软件作图。
2 结果与分析
2.1 没食子酸标准曲线
没食子酸标准曲线如图1所示,方程为y=5.9249x+0.0554,R2=0.9996,在测定范围内,线性关系良好,可用于多酚含量的测定。
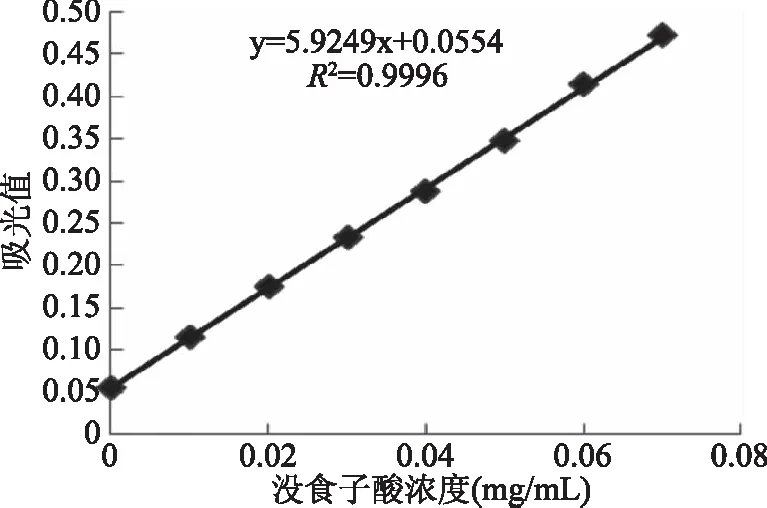
图1 没食子酸标准曲线Fig.1 Standard curve of gallic acid
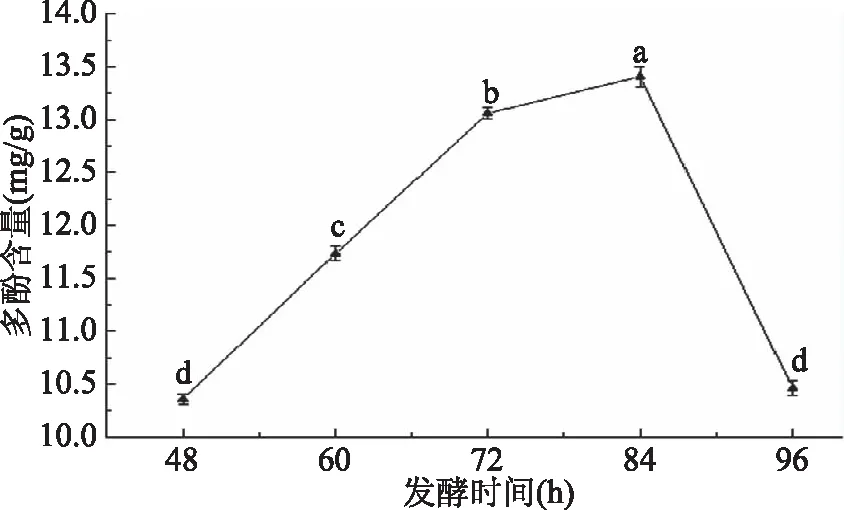
图2 不同发酵时间水溶性麸皮多酚含量的变化Fig.2 Changes of polyphenol content in water-soluble bran under different fermentation time 注:小写字母不同表示差异显著(P<0.05),含有相同字母 表示差异不显著(P>0.05);图3~图4,图7~图9同。
2.2 不同发酵条件对水溶性多酚含量的影响
2.2.1 不同发酵时间水溶性麸皮多酚含量的变化 图2表示不同发酵时间对多酚含量的影响,由图可以看出,在发酵48~84 h,多酚含量随发酵时间的增加而提高,可能由于发酵时间过短,微生物生长不足,发酵不完全,随着时间的增长微生物充分生长繁殖,在84 h多酚含量达到最大值,84 h之后多酚含量开始下降,可能是随着发酵时间的增加,微生物生长进入了衰亡期,提取多酚的能力减弱[19],不再有酚类物质提出,反而随着时间的增加,部分酚酸被降解[21],导致多酚含量下降。因此选用最佳发酵时间为84 h。
2.2.2 不同发酵温度水溶性麸皮多酚含量的变化 微生物生长繁殖都有其适宜的温度,随着温度的改变,其生长速率也会发生改变[20]。由图3可以看出,随着发酵温度的升高,在31~37 ℃随着发酵温度的升高,多酚含量逐渐上升,在37 ℃多酚含量最高,可能温度过低,微生物生长缓慢[20],使得酚类物质提取不充分。37~40 ℃随着发酵温度的升高,多酚含量逐渐下降。可能由于温度过高,导致微生物生理代谢受到影响,酚类物质得率降低。因此,得到最佳发酵温度为37 ℃。

图3 不同发酵温度水溶性麸皮多酚含量的变化Fig.3 Changes of polyphenol content in water-soluble bran under different fermentation temperature
2.2.3 不同液料比水溶性麸皮多酚含量的变化 由图4可知,随着液料比的增加,在1∶1.5~1∶1之间,多酚含量逐渐上升,可能由于水分过低使得微生物的生长得不到足够的水分,使其生长受限,影响发酵效果,因此多酚含量较低。液料比在1∶1~1∶0.6时,多酚的含量下降,可能由于水分过高使得小麦麸皮结块,降低麸皮透气性[21],导致发酵效果不佳,多酚含量降低。因此最终选用液料比为1∶1作为发酵条件。

图6 样品HPLC色谱图Fig.6 HPLC diagram of the sample 注:A:发酵结合酚;B:发酵游离酚;C:未发酵结合酚;D:未发酵游离酚。

图4 不同液料比水溶性麸皮多酚含量的变化Fig.4 Changes of polyphenol content in water-soluble bran under different ratio of feed to liquid
根据单因素结果发酵麦麸,得到发酵后多酚含量为(13.41±0.10) mg/g,而未发酵麸皮多酚含量为(3.40±0.02) mg/g,表明发酵可以增加麸皮多酚的释放。小麦麸皮中酚酸类物质大多以结合态的形式存在于细胞壁[22],微生物发酵使得细胞壁结构松散,从而使酚类物质得以释放,多酚含量增加。随着多酚含量的增加,麸皮多酚的组成成分有何变化尚需进一步分析。FC法常用于测定多酚含量,但由于FC试剂容易被一些糖、蛋白质、环状有机物等还原,导致多酚含量明显被高估[23]。因此为了准确测定多酚组成中单体酚的浓度,本试验采用了高效液相色谱法进行测定。
2.3 发酵与未发酵麸皮水溶性多酚的主要组成分析
图5为标品的HPLC色谱图,图6为样品的HPLC色谱图。

图5 标准品HPLC图谱Fig.5 HPLC spectrum of standard
由表1可看出,发酵麸皮中游离酚的主要组成成分有阿魏酸和香豆酸,且阿魏酸含量高于香豆酸。发酵麸皮中结合酚阿魏酸含量达到1160.6 mg/kg。未发酵麸皮中游离酚包括少量阿魏酸,香豆酸含量为14.78 mg/kg,结合酚含有941.49 mg/kg阿魏酸。与未发酵麸皮相比,发酵后的阿魏酸含量都明显升高,而游离香豆酸含量降低,可能是发酵过程中一些香豆酸被降解成挥发性的酚类物质[24],从而导致发酵后香豆酸含量下降。因此,微生物发酵可以提高游离型和结合型阿魏酸含量,改变水溶性多酚的组成比例。Yin等[25]的报道采用泡盛曲霉、米曲霉和黑曲霉发酵小麦麸皮,发酵麸皮中阿魏酸含量分别达到(416.6±2.2)、(117.4±0.5)、(92.0±0.2) μg/g,较未发酵麸皮阿魏酸含量(27.5±0.5 μg/g)分别提高了1414.9%、326.9%、234.5%。同时,该研究发现采用高效液相色谱法测得的多酚含量远低于FC法,如FC法测得黑曲霉发酵麸皮中多酚含量为10707.5 μg/g,而高效液相色谱法测得多酚含量为676.4 μg/g,其结果与本试验相似。

表1 发酵与未发酵麸皮水溶性多酚的主要组成成分Table 1 The main components of water-soluble polyphenols in fermented and unfermented bran
2.4 抗氧化活性研究
2.4.1 发酵前后水溶性多酚的还原力变化 还原力表示了抗氧化物质的供电子能力,还原性越强,则说明样品抗氧化能力越强[20],图7显示了不同浓度下发酵与未发酵麸皮中水溶性多酚的还原力,并以BHA作为阳性对照,由图7可以看出,发酵与未发酵麸皮中水溶性多酚的还原力随着样品浓度的升高而逐渐增强,且无论是游离型多酚还是结合型多酚,发酵麸皮水溶性多酚的还原力均高于未发酵,且二者均低于对照组。杜小燕等[26]研究表明,发酵能够将麦麸中的束缚型酚类物质释放出来,从而引起抗氧化活性的变化。本试验结果表明发酵后的总酚含量提高,并且发酵使得束缚型的阿魏酸释放,因此还原力也有所提高。
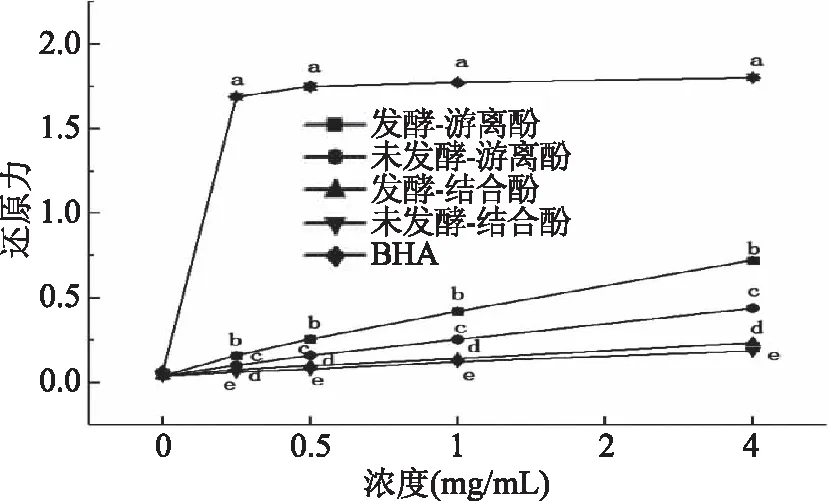
图7 水溶性多酚提取物还原力Fig.7 Reducing power of water soluble polyphenol extract
2.4.2 发酵前后水溶性多酚提取物清除DPPH自由基的能力 图8显示了不同浓度下发酵与未发酵麸皮中水溶性多酚的DPPH自由基清除率,同时以BHA作为阳性对照,由图8可知,随着样品浓度的升高,对DPPH自由基的清除率逐渐升高,两者呈正相关[14],根据线性方程计算得到发酵麸皮游离酚、结合酚、未发酵麸皮游离酚、结合酚以及BHA的IC50分别为:(0.849±0.132)、(2.737±0.075)、(1.958±0.086)、(3.706±0.072)、(0.208±0.22) mg/mL,IC50值越小,其抗氧化能力越强[27],由此可知,发酵麸皮水溶性多酚对DPPH自由基的清除率明显高于未发酵麸皮水溶性多酚,二者都低于对照组。可能由于发酵增加了麸皮多酚的释放,从而提高其对DPPH自由基的清除能力。并且有研究表明小麦麸皮的抗氧化能力与发酵释放的以阿魏酸为主的多酚类物质的增加有密切相关性[28],这与本研究的结果相一致。

图8 水溶性多酚提取物清除DPPH自由基的能力Fig.8 The ability of water-soluble polyphenol extracts to scavenge DPPH free radicals
2.4.3 发酵前后水溶性多酚提取物清除羟基自由基能力 由图9可知,发酵麸皮与未发酵麸皮中水溶性多酚以及对照组BHA对羟基自由基的清除率与其浓度都成线性关系,发酵麸皮游离酚、结合酚的IC50分别为(3.815±0.073)、(5.104±0.077) mg/mL,未发酵麸皮游离酚、结合酚的IC50分别是(2.572±0.073)、(3.495±0.074) mg/mL,BHA的IC50为(4.968±0.083) mg/mL,由此可见,未发酵样品中水溶性多酚对羟基自由基的清除能力明显高于发酵样品,且二者都高于对照组,有研究表明,酚类物质的抗氧化活性与总酚的含量和酚类化合物的组成存在密切的关系[29],因此,本试验所得结果可能是由于发酵与未发酵麸皮中多酚的组成不同导致其对羟基自由基发挥的作用不同。

图9 水溶性多酚提取物清除羟基自由基的能力Fig.9 The ability of water-soluble polyphenol extracts to scavenge hydroxyl radicals
3 结论
枯草芽孢杆菌和酿酒酵母菌混合固态发酵可以提高麸皮多酚含量,在料液比为1∶1、发酵温度37 ℃、发酵时间84 h条件下,水溶性麸皮多酚含量为(13.41±0.10) mg/g,较发酵前提高了294.41%(未发酵麦麸水溶性多酚含量为(3.40±0.02) mg/g)。由此可见,微生物发酵可以明显提高水溶性麸皮多酚含量。
微生物发酵改变了水溶性多酚的组成比例,提高了游离型和结合型阿魏酸含量,且水溶性麸皮多酚主要以结合型阿魏酸形式存在。发酵后,麸皮多酚的还原力和DPPH自由基清除率均得到提高,而羟基自由基的清除率却出现了下降,这可能与其组成有关,相关研究有待进一步探讨。

