虎杖苷对四氧嘧啶诱导的大鼠胰岛细胞损伤的保护作用
李卫玲,茹 琴,林 款,郑小茂,李超英
(江汉大学武汉生物医学研究院,湖北武汉 430056)
糖尿病是一种在全球范围内广泛流行的体内胰岛素的相对或绝对分泌不足引起的糖类、脂质及蛋白质代谢紊乱的内分泌疾病,可引起多种慢性并发症[1]。糖尿病的致病原因是多方面的,糖尿病的发病和进展与胰岛β细胞密切相关,主要包括胰岛β细胞数量减少和(或)β细胞功能障碍。有研究表明,细胞凋亡造成胰岛β细胞数量减少、胰岛结构破坏和功能受损是糖尿病发病的重要原因,线粒体内的氧化应激毒性是β细胞凋亡的直接原因[2]。
近年有临床报道,蓼科蓼属虎杖(PolygonumCuspidatumSieb. et Zucc)可以作为治疗糖尿病主药,并且疗效较好[3]。虎杖苷(Polydatin)是从虎杖干燥根茎中提取的主要生物活性成分之一,是白藜芦醇配糖体,又叫白藜芦醇苷,属于芪类化合物,即羟基二苯乙烯类化合物,化学名称为3,4,5-三羟基芪-3-单-D-葡萄糖苷。虎杖苷是天然的抗氧化剂,可在体内代谢产生白藜芦醇,因此与白藜芦醇有相似的药理学作用,可通过促进自噬、抑制凋亡、抗氧化等机制,发挥内脏保护、神经保护、免疫调节和抗肿瘤活性等多种药理学作用[4-5]。研究表明,虎杖苷对于链脲菌素致糖尿病大鼠模型具有明显的降糖作用。Hao等[6]研究发现,虎杖苷能增加胰岛素受体底物磷酸化水平,激活Akt信号通路,显著降低糖尿病大鼠模型的糖脂代谢。有研究报道,在糖尿病模型中虎杖苷能够调控Nrf2-ARE抗氧化通路,促进Nrf2表达,转录活性,及与ARE结合,促进下游HO-1和SOD1表达[7]。研究表明,白藜芦醇具有保护胰岛β细胞的作用[8-10],而虎杖苷对胰岛细胞的作用暂未见报道。
本研究采用体外培养INS-1细胞为研究对象,采用特异性胰岛β细胞毒剂四氧嘧啶建立损伤模型,研究虎杖苷对胰岛细胞活性和功能的影响及对四氧嘧啶致胰岛细胞损伤的保护作用,初步探讨其对胰岛β细胞氧化应激与凋亡的保护作用的作用机制。
1 材料与方法
1.1 材料与仪器
大鼠胰岛素瘤细胞INS-1细胞 上海博谷生物科技有限公司,细胞均用RPMI 1640完全培养基(含10% 胎牛血清、100 U/mL青霉素及100 μg/mL链霉素),于37 ℃、5% CO2培养;RPMI-1640完全培养基、胎牛血清、青链霉素、克-林重碳酸盐缓冲液(KRB)、磷酸盐缓冲液(PBS)和0.25%胰蛋白酶 均购自Gibco公司;四氧嘧啶(Alloxan)、3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)、二甲基亚砜(DMSO)、DCFH-DA探针 均购自Sigma公司;虎杖苷(纯度≥98%) 购自北京仪化通标科技有限公司;一氧化氮(NO)检测试剂盒、Caspase-3和Caspase-9活性检测试剂盒 碧云天生物技术公司;乳酸脱氢酶(LDH)、还原型谷胱甘肽(GSH)、超氧化物歧化酶(SOD)和丙二醛(MDA)检测试剂盒 南京建成生物科技有限公司;BCA蛋白浓度测定试剂盒 博士德生物工程有限公司;大鼠胰岛素检测试剂盒 上海酶联生物有限公司;其余试剂 均为国产分析纯。
3308型CO2培养箱、Multiskan Go全波长读数仪、Fluoroskan Ascent FL荧光和化学发光检测仪 Thermo公司;BX51倒置显微镜及成像系统 奥林巴斯公司;UP-250手持式超声细胞粉碎机 宁波新芝生物科技股份有限公司。
1.2 实验方法
1.2.1 细胞培养及分组 INS-1细胞用完全培养基培养,倒置显微镜下观察细胞生长情况,细胞融合度达到约90%时,PBS漂洗,0.25%胰酶消化,细胞计数后分板培养。四氧嘧啶造模浓度选择实验中,INS-1细胞分7组,分别加入不同浓度的四氧嘧啶(0、5、10、15、20、25、30 mmol/L),确定后续实验中四氧嘧啶给药浓度。虎杖苷浓度选择实验中,INS-1细胞分8组,分别加入不同浓度的虎杖苷(0、5、10、25、50、100、200、400 μg/mL),细胞增殖实验检测细胞存活率,确定后续实验中虎杖苷给药浓度。虎杖苷保护实验中,INS-1细胞分4组,分别为空白组(完全培养基)、模型组(18 mmol/L四氧嘧啶)和不同浓度虎杖苷保护组(分别给予25、50 μg/mL虎杖苷,同时给予18 mmol/L四氧嘧啶),分别检测细胞存活率、LDH释放、葡萄糖刺激胰岛素分泌量、Caspase-3和Caspase-9活性、活性氧(ROS)、NO、SOD、GSH和MDA的含量。
1.2.2 细胞活性的测定 采用MTT法测定细胞存活率[11]。INS-1细胞接种于96孔板中,细胞密度为5×104个/孔,37 ℃培养过夜。按照1.2.1处理,每个浓度设6个平行孔,37 ℃继续培养24 h。倒置显微镜下观察细胞形态并拍照,每孔加入10 μL MTT溶液(5 mg/mL),继续培养4 h。弃上清,每孔加入150 μL DMSO,酶标仪检测570 nm吸光度值(A),按下面公式计算细胞存活率(%):
细胞存活率(%)=A处理组/A空白组×100
1.2.3 LDH释放的测定 INS-1细胞接种于96孔板中,细胞密度为5×104个/孔,37 ℃培养过夜。按照1.2.1处理,每个浓度设6个平行孔,37 ℃继续培养24 h。细胞上清50 μL/孔,根据LDH检测试剂盒说明书测定,分析各组间的细胞毒性作用。
1.2.4 胰岛素分泌量的测定 INS-1细胞接种于96孔板中,细胞密度为5×104个/孔,37 ℃培养过夜。按照1.2.1处理,每个浓度设6个平行孔,37 ℃继续培养24 h。吸弃上清,PBS漂洗2次,加入含3.3 mmol/L葡萄糖的KRB缓冲液,37 ℃预孵育30 min,弃上清,加入低糖(3.3 mmol/L)或高糖(16.7 mmol/L)葡萄糖的KBB缓冲液孵育1 h,吸取上清100 μL保存于-20 ℃待测。胰岛素测定采用酶联免疫吸附试验法(ELISA),按照试剂盒说明书进行操作。
1.2.5 Caspase-3和Caspase-9活性的测定 INS-1细胞接种于6孔板中,细胞密度为1×106个/孔,37 ℃培养过夜。按照1.2.1处理,每个浓度设3个平行孔,37 ℃继续培养24 h。收集细胞,按照试剂盒操作,检测Caspase-3和Caspase-9活性。
1.2.6 细胞氧化应激指标的测定 INS-1细胞接种于24孔板中,细胞密度为1×105个/孔,37 ℃培养过夜。按照1.2.1处理,每个浓度设3个平行孔,37 ℃继续培养24 h。
1.2.6.1 NO含量的测定 收集细胞上清部分,1000 r/min 离心6 min,取上清各50 μL,按照试剂盒说明书操作检测NO水平。
1.2.6.2 MDA、SOD及GSH含量的测定 细胞经0.25%胰酶消化后,离心收集细胞沉淀,200 μL PBS重悬后超声破碎,功率300 W,每5 s超声一次,间隔10 s,BCA法测定细胞蛋白含量,据试剂盒说明书进行操作分别检测每毫克蛋白中MDA、GSH的浓度及SOD活性。
1.2.6.3 细胞中ROS含量的测定 采用DCFH-DA荧光探针法检测ROS[12],药物处理24 h的细胞,弃上清,加入PBS漂洗1次;加终浓度为10 μmol/L DCFH-DA探针,继续培养30 min。PBS漂洗3次,用细胞刮收集细胞,荧光酶标仪检测,激发波长485 nm,发射波长538 nm,荧光强度反映细胞内ROS水平。
1.3 数据处理
采用统计软件SPSS 16.0对数据进行统计分析,实验所得数据以均数±标准误(x±s)表示,各组之间进行单因素方差分析,以P<0.05为差异有统计学意义。
2 结果与分析
2.1 四氧嘧啶对INS-1细胞增殖的影响
四氧嘧啶对INS-1细胞增殖的影响见表1,与空白组比较,10~15 mmol/L四氧嘧啶处理细胞存活率显著降低(P<0.05),20~30 mmol/L四氧嘧啶处理组细胞存活率极显著降低(P<0.01),表明四氧嘧啶能显著抑制INS-1细胞增殖。由直线回归分析计算四氧嘧啶IC50值为16.5 mmol/L。为了确保后续实验造模成功,选择浓度为18 mmol/L的四氧嘧啶损伤胰岛细胞,建立体外糖尿病细胞模型。
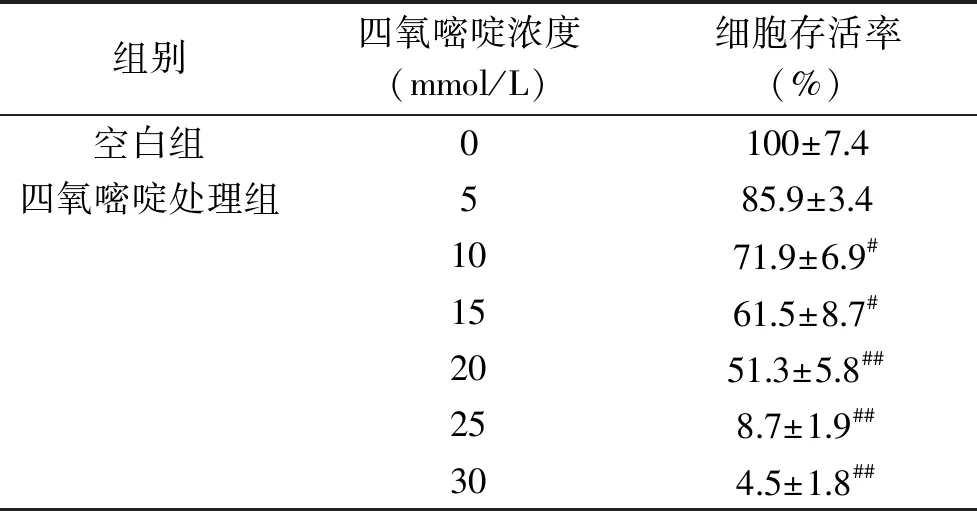
表1 四氧嘧啶对INS-1细胞增殖的影响(x±s)Table 1 Effect of alloxan treatment in different concentrations on the cell viability of INS-1 cells(x±s)
注:与空白组比较,#P<0.05,##P<0.01。
2.2 虎杖苷对INS-1细胞增殖的影响
实验结果如表2所示,虎杖苷浓度在5~100 μg/mL范围内,对INS-1细胞增殖无统计学意义(P>0.05)。其中25、50 μg/mL虎杖苷效果相对较好。200~400 μg/mL虎杖苷能极显著抑制INS-1增殖(P<0.01)。选取25、50 μg/mL虎杖苷用于后续四氧嘧啶诱导损伤模型。

表2 虎杖苷对INS-1细胞增殖的影响(x±s)Table 2 Effect of polydatin treatment in different concentrations on the cell viability of INS-1 cells(x±s)
注:与空白组比较,##P<0.01。
2.3 虎杖苷对四氧嘧啶诱导损伤INS-1细胞存活率的影响
与空白组比较,模型组细胞存活率极显著降低(P<0.01),说明四氧嘧啶体外损伤建模成功;与模型组比较,25 μg/mL虎杖苷组INS-1 细胞存活率极显著升高(P<0.01);50 μg/mL虎杖苷组INS-1细胞增殖率显著升高(P<0.05),其中虎杖苷剂量组间无显著差异,结果见表3。后续我们进一步研究25、50 μg/mL虎杖苷对四氧嘧啶诱导的细胞损伤保护的作用。
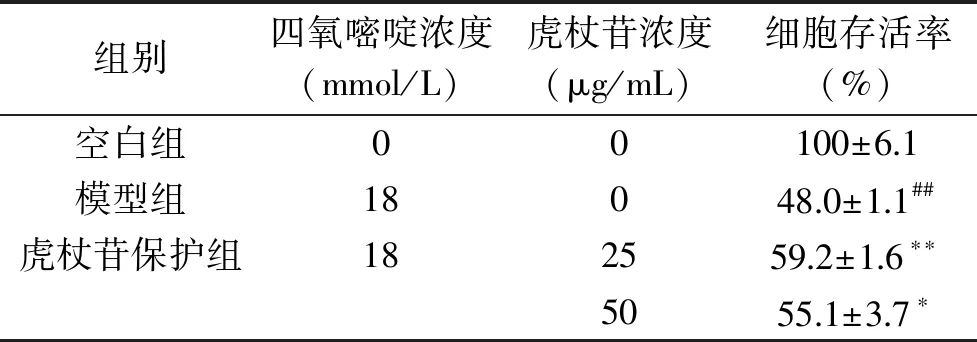
表3 虎杖苷对四氧嘧啶诱导损伤 INS-1细胞增殖的影响(x±s)Table 3 Effects of polydatin treatment on the cell viability of alloxan-induced INS-1 cells(x±s)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
2.4 虎杖苷对四氧嘧啶诱导损伤INS-1细胞形态的影响
倒置显微镜观察结果见图1。由图1可知,空白组INS-1细胞呈不规则、多角贴壁生长,排列紧密,边界清楚。模型组细胞数目明显减少,排列稀疏,多见细胞变圆。25、50 μg/mL虎杖苷保护组细胞数目较模型组增多,贴壁情况也有明显好转,与上文中虎杖苷对四氧嘧啶诱导损伤INS-1细胞存活率的结果一致。
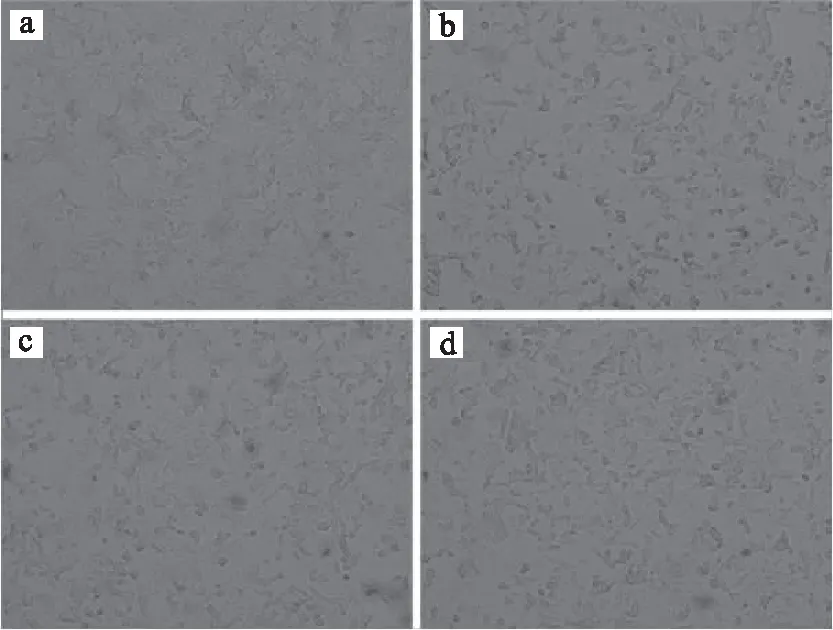
图1 虎杖苷对四氧嘧啶诱导损伤 INS-1细胞形态的影响(100×)Fig.1 Effects of polydatin on morphological characteristics of alloxan-induced INS-1 cells(100×) 注:a.空白组;b.模型组;c.四氧嘧啶+25 μg/mL 虎杖苷;d. 四氧嘧啶+50 μg/mL虎杖苷。
2.5 虎杖苷对四氧嘧啶诱导损伤INS-1细胞LDH释放的影响
LDH作为存在于机体所有组织细胞胞质内的酶,细胞损伤后膜通透性改变,LDH渗出细胞外,LDH增加可反映细胞膜的损伤,其外漏的程度也可间接反映细胞受损程度。
试剂盒检测得知,空白组、模型组LDH释放量分别为(106.4±11.6)和(199.5±9.7) U/L。与空白组比较,模型组细胞培养上清液中LDH释放量极显著升高(P<0.01)。25和50 μg/mL虎杖苷保护组LDH活性降低,统计学分析结果均具有显著性差异(P<0.05)(表4),说明虎杖苷可以抑制四氧嘧啶对INS-1细胞的损伤。

表5 虎杖苷对四氧嘧啶诱导损伤INS-1细胞胰岛素分泌的影响(x±s)Table 5 Effects of polydatin on alloxan-induced insulin secretion in INS-1 cells(x±s)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.05。
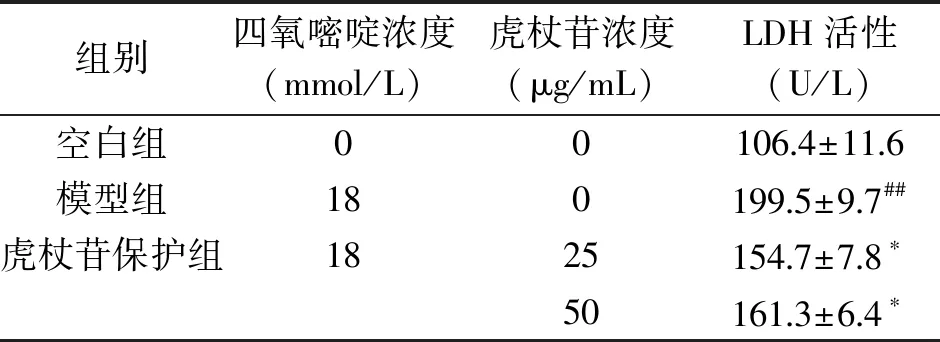
表4 虎杖苷对四氧嘧啶诱导损伤 INS-1细胞LDH活性的影响(x±s)Table 4 Effects of polydatin on alloxan-induced LDH release in INS-1 cells(x±s)
注:与空白组比较,##P<0.01;与模型组比较,*P<0.05。
2.6 虎杖苷对四氧嘧啶诱导损伤INS-1细胞胰岛素分泌量的影响
与空白组比较,模型组细胞低糖诱导胰岛素分泌量极显著降低(P<0.01),高糖诱导胰岛素分泌量明显减少(P<0.05),表明胰岛细胞功能受损。与模型组比较,结果显示低糖诱导和高糖诱导,虎杖苷共处理后低糖诱导胰岛素分泌量极显著升高,高糖诱导胰岛素分泌量增加也有统计学意义(P<0.05),其中50 μg/mL虎杖苷保护组胰岛素分泌量最高,结果详见表5。
2.7 虎杖苷对四氧嘧啶诱导损伤INS-1细胞Caspase-3、Caspase-9活性的影响
细胞发生凋亡时,活化的Caspase-9进一步激活效应性Caspase蛋白(Caspase-3,Caspase-6,Caspase-7),其中Caspase-3是细胞凋亡的主要执行者,最终细胞核破裂,核膜断裂。通过检测Caspase-3、Caspase-9活性能够间接地的反映胰岛细胞凋亡的状态。
实验结果显示,与空白组Caspase-3(0.57±0.08)、Caspase-9(4.49±0.05)比较,模型组凋亡相关的Caspase-3(6.96±0.35),Caspase-9(12.02±0.02),活性极显著升高,差异有统计学意义(P<0.01)。与模型组比较,25和50 μg/mL虎杖苷可以极显著降低Caspase-3和Caspase-9的活性(P<0.01),其中50 μg/mL虎杖苷抑制Caspase-3活性较好,结果详见图2。
2.8 虎杖苷对四氧嘧啶诱导损伤INS-1细胞氧化应激及抗氧化指标的影响
氧化应激是指细胞内活性氧和活性氮自由基产生増加,引起细胞脂质过氧化。ROS和NO可以反映细胞氧化应激水平,MDA是机体内脂质过氧化的产物。检测上述指标能够反映细胞受自由基攻击的损伤程度。
如图3所示,与空白组比较,18 mmol/L的四氧嘧啶处理INS-1细胞24 h后,细胞出现氧化损伤,表现为培养液中的NO 和细胞内的ROS、MDA含量极显著升高(P<0.01),而25和50 μg/mL虎杖苷对四氧嘧啶造成的氧化应激有明显抑制作用,氧化应激指标NO、ROS和MDA含量均显著降低(P<0.05)。
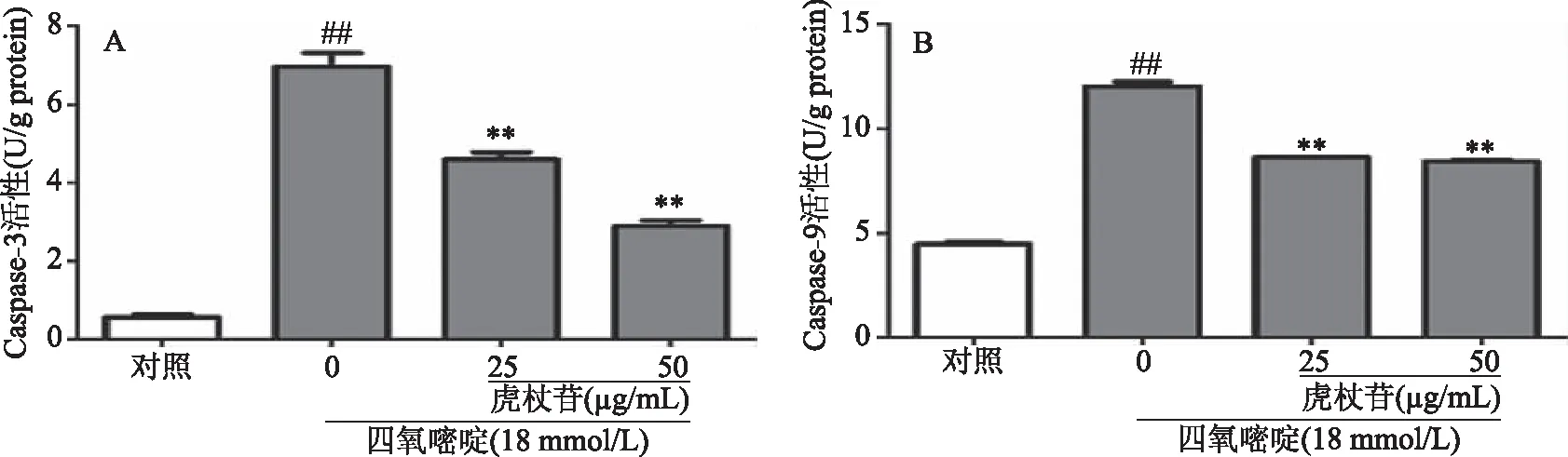
图2 虎杖苷对四氧嘧啶诱导损伤INS-1细胞Caspase-3、Caspase-9活性的影响Fig.2 Effects of polydatin on alloxan-induced caspase-3 and caspase-9 activation in INS-1 cells 注:与空白组比较,##P<0.01;与模型组比较,**P<0.01。
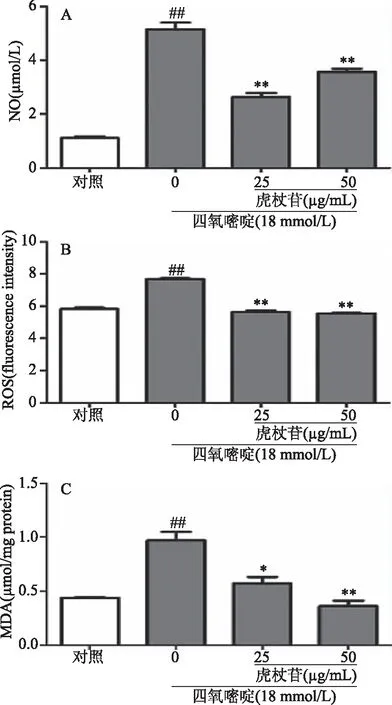
图3 虎杖苷对四氧嘧啶诱导损伤INS-1 细胞上清NO、胞内ROS及MDA水平的影响Fig.3 Effects of polydatin on alloxan-induced NO, intracellular ROS and MDA levels in INS-1 cells 注:与空白组比较,##P<0.01; 与模型组比较,*P<0.05,**P<0.01。
SOD能够促进氧自由基的还原,并通过GSH-Px的催化,将氧自由基分解成水和氧气,维持细胞内氧化和抗氧化平衡,SOD活力的高低反映的是机体抗氧化应激的能力。GSH是机体内最重要的非酶性抗氧化物,具有清除自由基的重要生理功能,GSH的含量可以作为衡量细胞抗氧化水平的一个重要指标。检测上述指标能够反映细胞对于自由基的清除能力。
如图4所示,与空白组比较,18 mmol/L的四氧嘧啶处理INS-1细胞24 h后,细胞抗氧化相关SOD活性和GSH含量极显著降低(P<0.01)。而25和50 μg/mL虎杖苷能提高INS-1细胞抗氧化能力,SOD酶活力升高极显著(P<0.01),GSH水平升高也有统计学差异(P<0.05),结果详见图4。
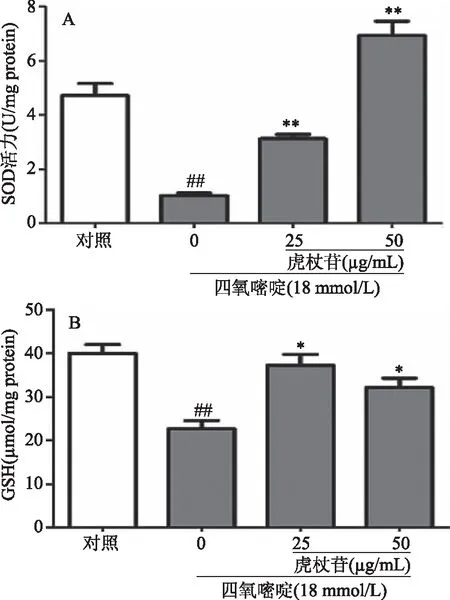
图4 虎杖苷对四氧嘧啶诱导损伤INS-1 细胞SOD活力和GSH含量的影响Fig.4 Effects of polydatin on alloxan-induced SOD activities and GSH content in INS-1 cells 注:与空白组比较,##P<0.01; 与模型组比较,*P<0.05,**P<0.01。
3 讨论与结论
有研究表明,氧化应激是2型糖尿病发生发展的重要原因,与机体其他组织细胞相比,胰岛β细胞清除自由基的酶的含量及活性相对较低,最易受到自由基损伤[13]。氧化应激会导致胰岛β细胞功能损伤及外周胰岛素抵抗,诱发糖尿病及多种并发症的形成。糖尿病的抗氧化治疗作为一种辅助疗法,已经应用于临床[14]。目前植物提取物的抗氧化活性的研究大多集中在中草药、水果、蔬菜、谷物等,天然植物提取物具有作用温和持久、无毒副作用等优势。虎杖苷是从传统中药虎杖中提取的有效成分,现代药理学研究表明,虎杖苷具有抗氧化作用[15];同时也具有良好的降血糖效果和改善糖尿病心肌肥厚、糖尿病肾病并发症作用[16-17]。
本研究结果显示,虎杖苷可显著增加由四氧嘧啶损伤细胞存活率(P<0.05);降低细胞毒性LDH水平(P<0.05);改善细胞形态;提高低糖和高糖诱导的胰岛素分泌量(P<0.05)。通过检测细胞内Caspase-3、Caspase-9活性可知,虎杖苷极显著抑制四氧嘧啶诱导的细胞凋亡(P<0.01)。25、50 μg/mL虎杖苷组NO和ROS水平极显著下降(P<0.01),MDA含量显著降低(P<0.05),说明了虎杖苷能够显著降低自由基引发的脂质过氧化反应。此外,25、50 μg/mL虎杖苷与四氧嘧啶共处理后,INS-1细胞的SOD活性和GSH含量显著升高(P<0.05),说明虎杖苷能够显著提高INS-1细胞的抗氧化能力。因此,推论虎杖苷可以有效缓解由四氧嘧啶引起的凋亡和氧化应激从而对胰岛β细胞损伤具有保护作用。综上,虎杖苷可能通过增强胰岛细胞清除自由基能力、降低氧化应激损伤及抑制胰岛β细胞凋亡保护四氧嘧啶损伤,具体分子机制仍需进一步研究。

