海参体壁自溶机制及其控制技术的研究进展
(青岛科技大学化工学院,山东青岛 266042)
海参是一种海洋棘皮动物,其体内含有多种生物活性物质,如岩藻糖基硫酸软骨素、岩藻聚糖、皂苷、脑苷脂、糖基鞘磷脂和胶原蛋白等[1-2],具有抗癌[3]、抗凝血[4]、抗氧化[5]的作用。因此海参具有较高的商业价值,是中国、日本、韩国、越南、印度等许多亚洲国家重要的养殖水产物种之一,也是澳洲以及美国、加拿大、墨西哥等欧美国家亟待开发的水产资源。鲜活海参如仿刺参(Stichopusjaponicus)的体态一般呈平圆筒状,表皮整体完好,有弹性;背部略隆起,具有圆锥状肉刺,海参的主要食用部分为海参体壁组织,然而,海参在收货、运输、贮藏和加工过程中极易发生自溶。自溶时海参会发生“吐肠”现象,这是一种自我保护的条件反射;海参体表松弛,白色真皮外露,出现脱皮现象;海参体壁的可变结缔组织中的胶原蛋白纤维、微纤维间的间隙加大,胶原纤维分解为胶原原纤维和胶原纤维束,纤维间的蛋白聚糖桥消失,纤维网络解体,继而胶原纤维的形态和轮廓变模糊,部分原本坚固的体壁形成粘稠团,局部发生“溶解”,甚至最终“融化”为液态,其成分主要为蛋白、多糖等[6-7]。海参自溶速度极其迅速,快者可在几分钟内致使海参体壁发生局部液化,从而导致海参品质严重下降,进而造成极大的经济损失。为此,本文针对海参自溶,综述了海参体壁的组成、海参自溶机制和自溶控制技术,为进一步研究海参自溶机制和控制技术提供理论依据。
1 海参体壁的组成及其自溶过程中的变化
海参体壁由角质层、皮层、肌肉层组成,其中皮层中的真皮占比最大,为可变结缔组织。该组织是由胶原纤维和微纤维网络构成的纤维网络结构。如图1所示,胶原纤维呈草绳状平行紧密排列,通过蛋白聚糖桥连接[6-8],被微纤维网络包围,微纤维网络维持组织并提供远程恢复力[9]。胶原纤维的主要结构单元是胶原原纤维和胶原纤维束。胶原纤维及其网络结构的主要组成是海参多糖和胶原蛋白。
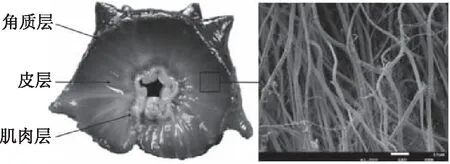
图1 海参体壁剖面图及其体壁胶原纤维Fig.1 Contraverse section and collagen fibers of body wall of sea cucumber
海参多糖主要由海参硫酸软骨素和岩藻聚糖构成,其相对分子质量分别为4×104~5×104、8×104~10×104[10]。Chen[11]等得到了岩藻硫酸软骨素的结构,如图2(a)所示;Yu[12]等在刺参体壁中得到了海参岩藻多糖,其结构如图2(b)所示。目前发现的海参多糖的单糖组成为N-乙酰半乳糖胺、半乳糖胺、半乳糖、岩藻糖、葡萄糖胺、葡萄糖醛酸、甘露糖等[13-14],糖苷键的连接方式为α-1,3、α-1,4[12-15]。硫酸基团在糖单元中的结合位点(2、3、4、6位)和数量(19.54%~29.95%)因海参种类而异[16]。海参多糖在自溶过程中可以释放68%的硫酸多糖,被分解并转化成脱氧半乳聚糖[17],其结构如图2(c)所示。
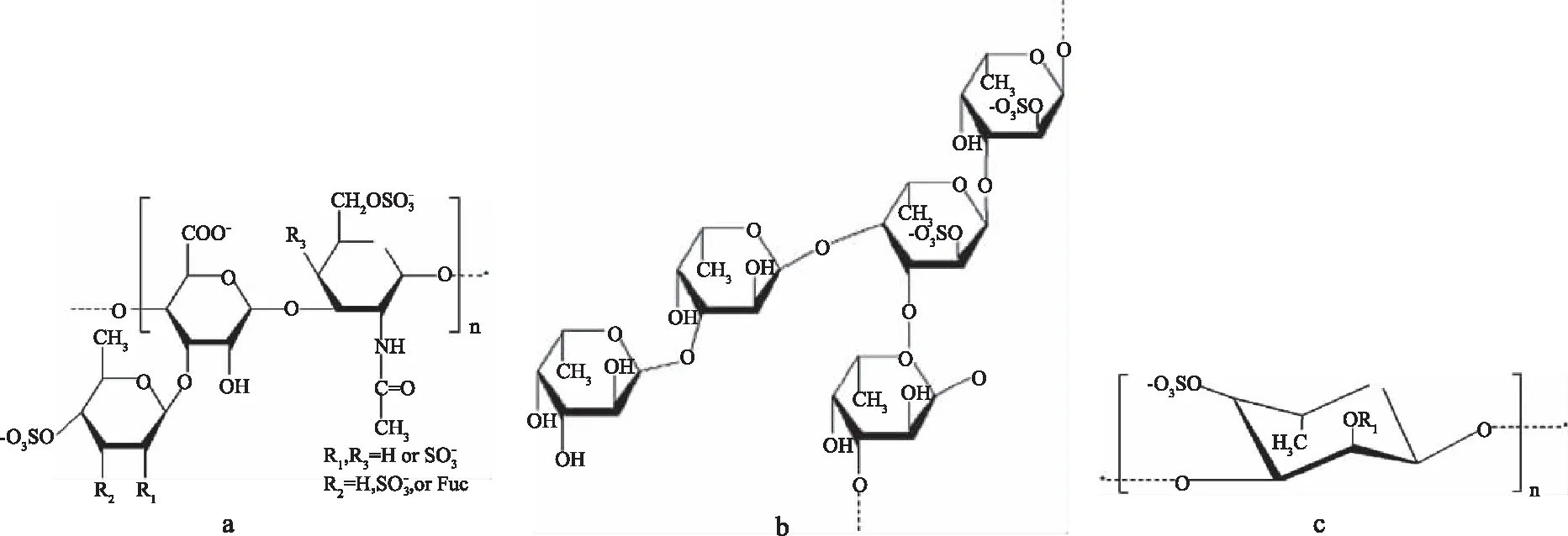
图2 海参体壁中的岩藻硫酸软骨素(a)和海参岩藻多糖(b)以及自溶产物脱氧半乳聚糖(c)Fig.2 Chondroitin sulfate(a)and polysaccharide(b)in the body wall of sea cucumber and the resultant deoxygalactosan(c)after autolysis
海参胶原蛋白是结缔组织中的主要组成成分。每个胶原蛋白分子由三条肽链(三条肽链可以彼此相同,也可以彼此不同)相互缠绕成草绳状而成,呈右手超螺旋结构。胶原蛋白的相对分子质量约为300 kDa,长300 nm,直径1.5 nm,其中每条肽链约有1000个氨基酸残基,相对分子质量为95~100 kDa[18]。在自溶过程中,海参体壁中TCA可溶性寡肽的溶出率随之逐渐增大[19],说明体壁中的蛋白结构可能发生酶促降解。
2 海参自溶的机制
海参体壁自溶过程极其迅速,基本上可归因于海参体壁内源酶。当然,外源微生物的存在也受到关注。
2.1 海参内源酶
2.1.1 海参体壁酶 海参体壁自溶与即食海参的体壁失稳与海参体壁中海参多糖和胶原蛋白降解有关,而这些降解与海参体壁中的多糖酶和蛋白酶有关[20-21]。
目前已发现的多糖水解酶有α-糖苷键水解酶,如以α-淀粉和果胶等为底物可探知其具有淀粉酶和果胶酶等活性[22-23]。张杰[22]等通过从海参体壁中分离纯化并得到了α-1,4淀粉酶,其分子质量约为420 kDa。刘征东[23]等从海参体壁中分离纯化了果胶酶,并发现该酶是一种耐强热酶,在90 ℃条件下保温20 min后活力无显著性变化,可水解高温处理的海参体壁组织,产生更多的还原端。海参经过煮沸或者高压蒸汽灭菌后,其体壁中的果胶酶仍有较高的活力[24],即具有较高的热稳定性。
海参体壁蛋白酶主要有组织蛋白酶L、半胱天冬酶、基质金属蛋白酶和组织蛋白酶K。Zhou[25]等从海参体壁中分离得到的组织蛋白酶L可催化水解酰胺键(以Z-Phe-Arg-MCA为底物)。该酶存在于细胞液泡内表面,在紫外照射下液泡膜与细胞膜融合,使该酶从细胞中释放出来,并扩散到组织中,与细胞外基质如胶原纤维接触并降解[6]。Qi[26]等发现,细胞凋亡可诱导增强该酶活性,加剧海参的自溶。可能的原因是,丝裂原活化蛋白激酶与应激诱导凋亡信号通路密切相关,调控细胞因子产生、炎症、生长、分化、存活、凋亡等关键下游基因的转录。紫外照射会增强海参中自由基的形成,激活丝裂原活化蛋白激酶家族中的应激活化蛋白激酶通路和p-38丝裂原活化蛋白激酶通路,从而导致降解胶原蛋白,并激活半胱天冬酶-3,而后者激活组织蛋白酶L进一步降解胶原蛋白。此外,该通路也可直接导致DNA的损伤。因此,最终导致海参自溶。基质金属蛋白酶是一类广泛存在于动物体内的含钙锌内肽酶,主要包括胶原酶和明胶酶。胶原酶降解胶原蛋白,明胶酶降解明胶和一些基底膜蛋白。基质金属蛋白酶在海参可变结缔组织的合成和水解中发挥着重要作用,Sun[27]等发现基质金属蛋白酶是海参自溶过程中的关键酶,参与了海参自溶过程中蛋白质的降解,其作用集中在胶原纤维的高级结构[28]。海参体壁中组织蛋白酶K也参与了海参自溶,组织蛋白酶在酸性条件下可降解胶原蛋白,海参组织的碱性环境可随着自溶的进行,溶酶体的溶解和组织蛋白酶的释放,变为酸性环境,从而使组织蛋白酶K发挥活性。组织蛋白酶K能够对具有稳定三螺旋结构的胶原进行多位点降解,可降解Ⅰ和Ⅱ型胶原蛋白以及非胶原蛋白[29]。总之,海参体壁自溶与其体内的蛋白酶关系密切。
2.1.2 海参肠道酶 半胱天冬酶可在紫外照射下被激活,参与自溶。Su[30]等发现紫外刺激海参可使线粒体膜功能障碍,细胞色素c从线粒体释放到胞浆中激活半胱天冬酶并参与海参自溶。半胱天冬酶抑制剂可以不可逆地结合到蛋白酶的催化位点,抑制蛋白酶的活化,从而降低海参自溶。海参肠壁多糖水解酶可以作用于α-1,4糖苷键和β-1,3糖苷键,其中淀粉酶活力最高,是一种金属蛋白酶,在60 ℃内活力稳定[31]。然而,由于海参体壁自溶极其迅速,其与海参内脏酶的相关性尚需进一步研究。
2.2 外源微生物
除了海参自身能够产生多种多糖酶和蛋白酶外,海参肠道中的多种微生物也可以产生多糖酶和蛋白酶。海参肠道微生物已被分离和鉴定,如芽孢杆菌和枝芽孢杆菌[32]、放线菌[33]和立克次氏体[34],可产生多种外源性消化酶,如淀粉酶、蛋白酶、纤维素酶,对海参的食物消化有贡献。采用分类器对海参消化道中微生物进行分类,得到10个细菌门,23纲44目83科127属[32,35]。但是,没有相关文献报道这些外源微生物是否参与海参自溶。Bakunina[36]等从海洋柠檬假单胞菌(Pseudoalteromonascitrea)中分离得到三种可以产生岩藻聚糖酶的枸橼酸菌株。Chang[37]等分离出了一种新的黄杆菌科菌株-CZ1127,该菌株可以产生多种岩藻聚糖降解酶来利用海参岩藻多糖。由于海参体壁自溶发生于体壁内部,且自溶速度极快,因此,很难将海参体壁外源微生物与海参体壁自溶联系起来。
3 自溶的控制技术
3.1 热力灭酶
热力灭酶包括高温热力灭酶和真空热力灭酶。在高温热处理(121 ℃ 15 min)过程中,海参中的微生物和内源蛋白酶会完全失活,胶原纤维束的结构被破坏和断裂,胶原蛋白的三螺旋结构也逐渐解旋和降解。在贮藏过程中,胶原纤维束和胶原蛋白的结构被进一步破坏和降解,且被破坏的程度与贮藏温度呈正相关,其中,硬度和咀嚼性下降极为明显,弹性、凝聚性和恢复性均有所下降,胶原纤维最初紧密交错排列,之后结构断裂,排列混乱[38-39]。这种变化有可能来源于海参体壁中的多糖酶,高温处理后,该类酶活力不降反升[23-24]。采用真空热力灭酶法时,设置加热温度为95 ℃,真空锅真空压力为0.04 MPa,加热时间为3 h,虽然得到的海参有较高含量的蛋白质、脂肪、多糖、矿物质、氨基酸和微量元素,但仍会造成部分营养流失[40-41]。采用热力灭酶,虽然抑制了酶对海参的自溶,但也明显破坏海参的组织结构并使其外部结构大幅度缩小,而影响其商业价值。
3.2 超高压技术
为了进一步提高自溶酶的灭酶力度,超高压(200 MPa以上)技术应运而生。该条件会使微生物细胞壁和细胞膜的结构遭到破坏,蛋白质降解,酶活性降低,几乎会杀死所有细菌、霉菌和酵母,但不会像高温灭菌一样造成营养流失和风味变化[42]。
超高压处理海参后,能够有效钝化海参体内自溶酶活性,其中蛋白酶和淀粉酶活力被明显抑制。如在600 MPa、保压时间30 min、处理温度15 ℃条件下制作的超高压海参软罐头,其室温贮藏期为60 d,冷藏贮藏期为90 d[25];在300 MPa、保压时间10 min、处理温度60 ℃的条件下,处理得到的刺参持水力大,且该工艺能够很好的改善刺参的质构,并有效地保留了刺参中的功能成分[43]。把该灭酶技术应用于海参加工工艺中,如果在海参的风味方面有进一步的改善,将有望获得消费者乐于接受的即食海参产品。
3.3 超声波辅助电解水
电解水是将食盐、盐酸等含有氯离子的溶液电解,生成含有次氯酸的溶液,其中,微酸性电解水的pH维持在5.0~6.5。在微酸性电解水中主要起杀菌作用的物质为次氯酸。次氯酸能损害细胞膜,致使细胞内的蛋白酶、RNA和DNA无法发挥正常的生化活性,导致微生物死亡,且与微生物及有机物接触后立即还原为水。然而,电解水只能杀灭海参表面的微生物,因此,需联合超声波技术抑制海参自溶酶活性[44]。
3.4 高压电场干燥
高压电场可增加细胞膜的跨膜电压,使其变薄并形成微孔甚至崩解,导致细胞死亡,其胞内酶的二级和三级结构也相应遭到破坏[45],从而达到抑制海参体壁自溶的目的。利用该法干燥海参,其复水率、蛋白质和酸性粘多糖含量、质地、颜色、外观和风味虽然略逊于真空冷冻干燥法[46],但解决了海参体壁自溶问题,且使干燥成本明显降低。
3.5 酶抑制剂
目前产业中对捕捞海参的加工前都进行灭酶处理,大部分采用酶抑制剂。金属蛋白酶抑制剂EDTA Na2和1,10-菲罗啉可以抑制基质金属蛋白酶的活力,在EDTA Na2或1,10-菲罗啉存在下,蛋白降解几乎完全被抑制[27-28]。半胱氨酸蛋白酶抑制剂包括反环氧琥珀酰-l-l-亮氨酸-氨基(4-胍基)丁烷、碘乙酸、乳清蛋白浓缩物,对肌动蛋白和肌动蛋白的水解均有部分抑制作用,对组织蛋白酶K的抑制率均可达到90%以上[47-48]。使用食品级金属蛋白酶抑制剂和半胱氨酸蛋白酶抑制剂,有利于减少海参在储运过程中的自溶,具有成本低、操作简单等特点。
3.6 交联
为增强海参体壁的稳定性,可以采用交联方法延长海参的保质期。交联方法可以分为化学交联、生物交联和固化交联。化学交联可利用五倍子提取物和诃子提取物作为交联剂,它们含有多元酚的结构,能与蛋白质、多糖和生物碱发生化学反应。该交联剂与胶原蛋白发生的共价结合作用使胶原蛋白结构稳定不容易降解,能够保持海参的微观结构,没有难以接受的异味,海参表面能保持刺的完整性和海参完整的形状和外观[49]。生物交联可以采用转谷氨酰胺酶交联海参,其制作方法为:将海参去内脏,清洗,预煮;在中性水溶性壳聚糖溶液中真空浸渍,取出再转入转谷氨酰胺酶液中固化;调味;真空充氮包装;高压蒸汽灭菌等。采用该方法后,胶原蛋白稳定,海参具有较长的保藏期,0~4 ℃条件下为一年[50]。固化交联可以采用海藻酸钠与海参交联,该方法可以保持海参的完整性和弹性,将海参进行原料处理、海藻酸钠固化处理、灌汤封口、杀菌加工成即食罐头产品,更好地解决了海参在贮藏过程中参体弹性差,体壁破裂,汤汁浑浊,保质期短的问题[51]。生物交联法具有无毒、无异物、不影响海参品质等特点,可有效保持海参的营养成分和物理外观。
4 展望
海参体壁组成成分复杂,相互关联紧密,由此所构成的组织结构错综而有致,但极易发生自溶,其自溶机制和控制自溶的技术一直是研究的热点。从目前研究进展来看,海参自溶主要与海参内源酶有关,目前控制海参自溶的技术,如真空热力灭酶、超高压技术、超声波辅助电解水、高压电场干燥、酶抑制剂和交联技术,主要是基于控制海参内源酶而建立的。由于海参体壁自溶的发生极其迅速,因此,很难将海参体壁自溶与其内脏和体表及体内寄生的微生物联系起来。有关鲜活海参自溶机制的问题仍有待于进一步研究,如自溶启动机制、参与自溶的酶系、酶攻击的关键靶点、靶点对于海参体壁构架稳定性的关系以及胶原蛋白与糖类分子及其它分子之间的键合方式等。另外,控制海参自溶的技术也有待不断优化和更新,既要避免海参结构破坏和营养成分流失,又能够保证安全有效地抑制海参自溶,得到高质量海参。总之,自溶的研究方法以及海参自溶的控制技术仍是当前解决自溶问题的关键。

