暗灰链霉菌CGMCC 13662降解苯甲腈和苯甲酸的研究
郭 铃,方文婉,葛 峰,戴亦军
(1.南京师范大学生命科学学院/ 江苏省微生物与功能基因组学重点实验室/ 江苏省微生物资源产业化工程技术研究中心,江苏 南京 210023;2.生态环境部南京环境科学研究所,江苏 南京 210042)
腈类物质是一类含有氰基基团的有机化合物,天然存在于在土壤、植物和微生物中,也可以通过人工合成应用于工业生产,但大多数腈类化合物具有高毒性[1]。苯甲腈因其在工业生产中的广泛应用被认为是最重要的腈类物质之一,它可以作为溶剂和中间体广泛应用于药物、香水、染料、橡胶、纺织品、树脂等,用于干燥丙烯酸纤维和生产三聚氰胺。除此以外,苯甲腈还是广泛使用的除草剂如二氯苯腈、溴苯腈和碘苯腈的主要成分。但是苯甲腈会对人体带来严重危害,如运动能力下降和高铁血红蛋白血症,还可通过皮肤直接吸收造成神经麻痹和动物组织痉挛,一旦经由工业生产进入环境后,将对人体健康和环境保护带来严重的危害[2]。
生物降解苯甲腈因为其温和、价格低廉、对环境危害小的特点受到广泛关注[3]。微生物降解腈类物质有2条途径:一是在腈水合酶(Nitrile hydratase,EC 4.2.1.84)作用下生成苯甲酰胺,再在酰胺酶(Amidase,EC 3.5.1.4)作用下生成苯甲酸和氨[4-5]。二是苯甲腈直接通过腈水解酶(Nitrilase, EC 3.5.5.1)水解生成苯甲酸和氨[6]。目前报道很多菌株可以通过腈水合酶/酰胺酶途径进行腈类降解,MicrobacteriumimperialeCBS 498-74、Rhodococcussp. MTB5、Rhodococcussp. BX2和RhodococcusequiTG 328的基因组中存在腈水合酶和酰胺酶,两者共表达转化腈类[7]。BradyrhizobiumjaponicumUSDA 110 中有2个腈水解酶基因(blr3397和bll6402),两者都对苯乙腈表现出活性,其中blr3397同时对肉桂腈表现出高活性[8]。同时已经在一些菌中发现多酶代谢系统,如BacillussubtilisZJB-063含有2条代谢途径,腈水解酶是组成型酶,腈水合酶/酰胺酶是诱导型酶[9]。RhodococcusrhodochrousJ1 也含有2条腈类代谢途径,分别由尿素和环己烷-卡波沙酰胺-巴豆酰胺诱导表达[10-11]。
在被腈转化酶(腈水合酶/酰胺酶和腈水解酶)代谢的过程中,苯甲腈会降解为另一种常见污染物苯甲酸。苯甲酸可用作抑菌剂,还可用作药物的助溶剂随工厂废水排出[12]。多种芳香族化合物苯甲基脂肪酸、甲苯、酚等在降解过程中也会生成苯甲酸中间体,这一过程又增加了苯甲酸在环境中的危害程度[13]。苯甲酸类化合物的代谢主要可以分成好氧降解和厌氧降解[14]。好氧降解途径又可分为邻位途径、间位途径、龙胆酸途径和原儿茶酸途径[15],有些细菌可以同时有多种代谢途径。一些光合细菌、反硝化细菌和硫铁还原细菌等通过厌氧途径对苯甲酸进行降解[16]。因此开展苯甲酸的微生物降解途径及机理的研究,对于阐明很多环境污染物的降解、治理环境污染有重要的指导作用。
笔者实验室筛选到一株可降解腈类化合物的暗灰链霉菌(Streptomycescanus)CGMCC 13662,该菌株有很强的苯甲腈降解能力,但目前尚无相关研究的报道。因此笔者进一步开展了暗灰链霉菌降解苯甲腈和苯甲酸的降解特性和降解途径研究。
1 材料与方法
1.1 试验材料
1.1.1试剂
试验所用药品苯甲腈、苯甲酰胺、苯甲酸、儿茶酚、原儿茶酸购买自上海Sigma-Aldrich公司,高效液相色谱(HPLC)所使用的试剂乙腈购买自TEDIA公司(Fairfield, OH, USA),其他试剂为分析纯。
1.1.2菌株与培养基
暗灰链霉菌(Streptomycescanus)CGMCC 13662从土壤中筛选获得,菌株保藏在中国普通微生物菌种保藏管理中心(CGMCC,北京)。
LB培养基:NaCl 10 g·L-1,胰蛋白胨10 g·L-1,酵母粉5 g·L-1,pH值为7.2。
高氏一号培养基:可溶性淀粉10 g·L-1,NaCl 0.5 g·L-1,KNO31 g·L-1,K2HPO4·3H2O 1 g·L-1,MgSO4·7H2O 0.5 g·L-1,FeSO4·7H2O 0.01 g·L-1,pH值为7.0。
ISP4改良培养基:可溶性淀粉10 g·L-1,K2HPO4·3H2O 1 g·L-1,MgSO41 g·L-1,NaCl 1 g·L-1,(NH4)2SO42 g·L-1,CaCl22 g·L-1, FeSO40.001 g·L-1,MnCl20.001 g·L-1,ZnSO4·7H2O 0.001 g·L-1,CoCl20.013 g·L-1,pH值为7.2。
YEME:酵母提取物 3 g·L-1,胰蛋白胨 5 g·L-1,麦芽提取物3 g·L-1,葡萄糖10 g·L-1,蔗糖 340 g·L-1,pH值保持自然状态。
TSDY培养基:葡萄糖10 g·L-1,酸水解酪蛋白2 g·L-1,牛肉膏1 g·L-1,酵母粉 1 g·L-1。
1.2 试验方法
1.2.1暗灰链霉菌 CGMCC 13662孢子悬液的制备、菌体培养与静息细胞的制备
暗灰链霉菌CGMCC 13662在高氏一号固体培养基平板30 ℃生长7 d,用无菌水收集孢子并用无菌尼龙过滤网去除培养基中的杂质,4 ℃条件下以6 000 r·min-1的转速离心5 min(离心半径为10.8 cm),弃上清液,在沉淀孢子中加入含φ=20%甘油的无菌水,轻轻混匀后置于-80 ℃冰箱中保存。
为探究暗灰链霉菌CGMCC 13662在高氏一号、ISP4、YEME和TSDY培养基中的生长情况,首先调节孢子悬液到600 nm波长处的光密度值(OD600)为0.1,按φ=1%接种到含有100 mL不同培养基的500 mL三角瓶中,三角瓶置于30 ℃、220 r·min-1的摇床中振荡培养,每隔6~12 h取样测量菌体生长量。测量方法为:取20 mL发酵液用布氏漏斗抽滤收集菌丝体。将收集菌丝体的滤纸在100 ℃的烘箱中干燥至恒重,记录菌丝体的干重,计算菌体生长量(菌丝体干重/发酵液体积)。
制备静息细胞(resting cell)的方法为:先将OD600为0.1的孢子悬液按φ=1%接种到含有100 mL ISP4种子培养液的500 mL三角瓶中,于30 ℃、220 r·min-1摇床中振荡培养4 d;取50 mL菌液(菌丝体干重约为0.5 g),4 ℃条件下以10 000 r·min-1的转速离心10 min(离心半径为10.8 cm),弃上清液,菌体收集于50 mL离心管中,用20 mL浓度为50 mmol·L-1磷酸盐缓冲液(pH=7.5)洗涤2次后得到静息细胞。
1.2.2苯甲腈的降解
(1)生长细胞降解苯甲腈:把OD600为0.1的孢子悬液按φ=1%接种到上述ISP4 改良液体培养基中,加入0.5 g·L-1苯甲腈。三角瓶于30 ℃、220 r·min-1的摇床中振荡培养,同时设置菌体对照组和底物对照组,每12 h取样,样品以10 000 r·min-1的转速离心10 min (离心半径为10.8 cm),上清液稀释5倍,用0.22 μm孔径的微孔滤膜过滤后进行HPLC分析。
(2)静息细胞降解苯甲腈:将上述制备的静息细胞悬浮于10 mL(含0.5 g·L-1苯甲腈)转化液中,取出1 mL作为0 d样品,剩余样品按每管3 mL分装于3个50 mL的尖底离心管内,称重、封口并戳孔通气,于30 ℃、220 r·min-1条件下转化,定时取样进行HPLC鉴定。试验过程中设置菌体对照和底物对照。每次取样前需先用无菌水补足蒸发水分,样品处理方式同生长细胞降解苯甲腈。
在静息细胞降解苯甲腈的过程中,为探究钴离子对苯甲腈代谢的影响,在ISP4改良培养基中去除CoCl2;探究pH值对苯甲腈代谢过程的影响,静息转化液的pH值分别设置为5、6、7、7.5和8;探究不同共代谢基质对苯甲腈代谢过程的影响,在转化液中分别加入w=2%的葡萄糖、蔗糖、琥珀酸钠和苹果酸钠,同时设置不添加共代谢基质的对照组。
1.2.3苯甲腈中间产物降解
分别以苯甲酰胺、苯甲酸、儿茶酚、原儿茶酸为底物进行暗灰链霉菌CGMCC 13662降解,方法与苯甲腈降解相同。
1.2.4HPLC分析
HPLC分析采用安捷伦1200型高效液相色谱仪,分析条件为:安捷伦HC-C18反相柱(4.6 mm×250 mm×5 μm);检测器为Agilent G1314A可变紫外检测器,紫外吸收波长设定为231 nm;进样器为安捷伦7725i手动进样器;进样体积为20 μL;柱温为30 ℃;流动相A为经0.22 μm微孔过滤膜过滤的双蒸水(含φ=1‰色谱级乙酸),流动相B为色谱级乙腈,V(A)∶V(B)=45∶55;流速为1 mL·min-1。 HPLC数据在Agilent ChemStation工作站上进行分析。苯甲腈和苯甲酸的定量方法为外标法。
1.2.5半衰期的计算
苯甲腈降解半衰期方程式为
ln (I/I0)=-kt。
(1)
式(1)中,I为苯甲腈残余质量浓度,g·L-1;I0为苯甲腈起始质量浓度,g·L-1;k为表观常数;t为时间, h。
降解半衰期(t1/2)的计算公式为
t1/2=(ln 2)/k。
(2)
式(2)中,k为表观常数,R2>0.9。
1.2.6试验的重复数以及检验方法
相关试验均开展3次独立重复实验,使用IBM SPSS Statistics 25.0软件对数据进行统计及单因素方差分析。
2 结果与讨论
2.1 暗灰链霉菌CGMCC 13662在不同培养基中的生长及其对苯甲腈的耐受性
暗灰链霉菌CGMCC 13662 在ISP4、高氏一号、YEME和TSDY这4种培养基中的生长如图1所示,在ISP4培养基中菌体生长最好,培养120 h后的菌体干重达到10 g·L-1;在YEME和TSDY中菌体生长情况相仿,但与在ISP4培养基中生长相比,这2种培养基培养的菌丝的最大生物量仅为6 g·L-1。暗灰链霉菌CGMCC 13662在高氏一号培养液中生长缓慢,培养120 h的生物量仅为4 g·L-1。
暗灰链霉菌CGMCC 13662的生长过程分为迟缓期、对数生长期和稳定期,按φ=1%接种量接种后,在30 ℃、220 r·min-1条件下培养,50 h内菌体生长缓慢处于迟缓期,之后进入对数期,100 h以后菌体进入稳定期。因为菌体在ISP4中生物量最大,因此选其作为暗灰链霉菌CGMCC 13662后续研究的生长培养基。
在ρ(苯甲腈)为1~10 g·L-1的ISP4液体培养基中研究其对暗灰链霉菌CGMCC 13662菌体生长的影响,结果发现在ρ(苯甲腈)为3 g·L-1时菌体生长量最高,达(10.16±1.71) g·L-1,当苯甲腈浓度大于此值时菌体的生长逐渐受到抑制,当苯甲腈浓度到达8 g·L-1时菌体生长被完全抑制。
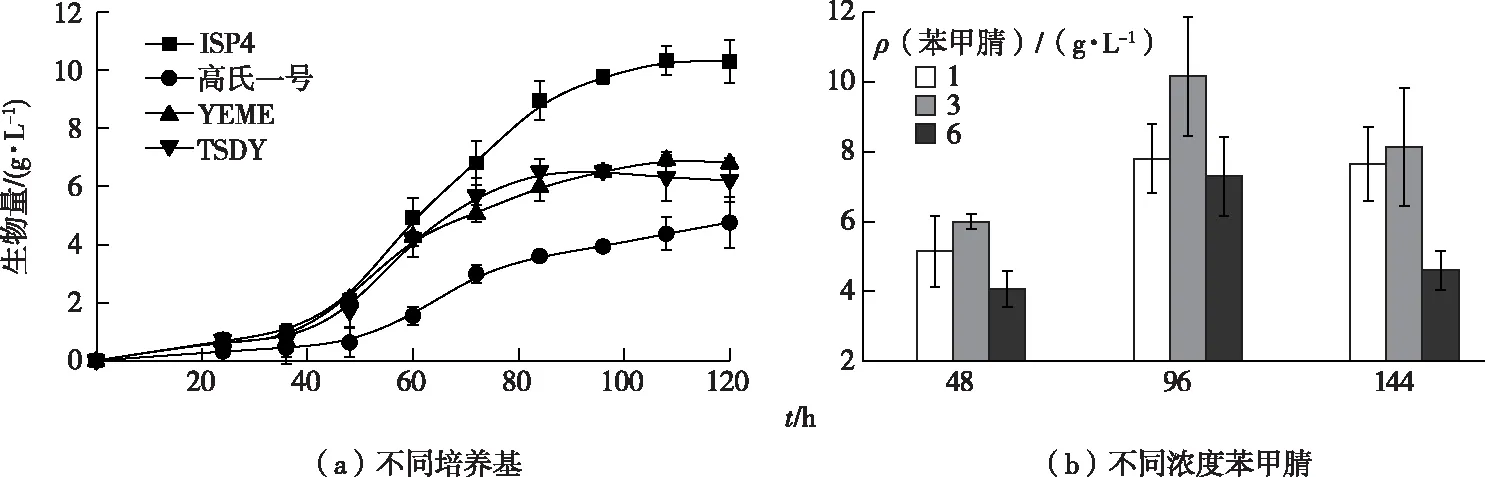
直方柱上方英文字母不同表示不同培养时间和苯甲腈浓度下暗灰链霉菌的生物量差异显著(P<0.05)。
2.2 暗灰链霉菌CGMCC 13662生长细胞和静息细胞降解苯甲腈
暗灰链霉菌 CGMCC 13662的生长细胞和与静息细胞均可降解苯甲腈,HPLC分析结果如图2所示。降解过程中产生2个新产物P1和P2,菌体对照与苯甲腈底物对照均无这2个峰出现。P1和P2的出峰时间分别为3.25和4.27 min,P1和P2出峰时间与标准品苯甲酰胺和苯甲酸出峰时间相同,因而P1和P2产物分别是苯甲酰胺和苯甲酸。
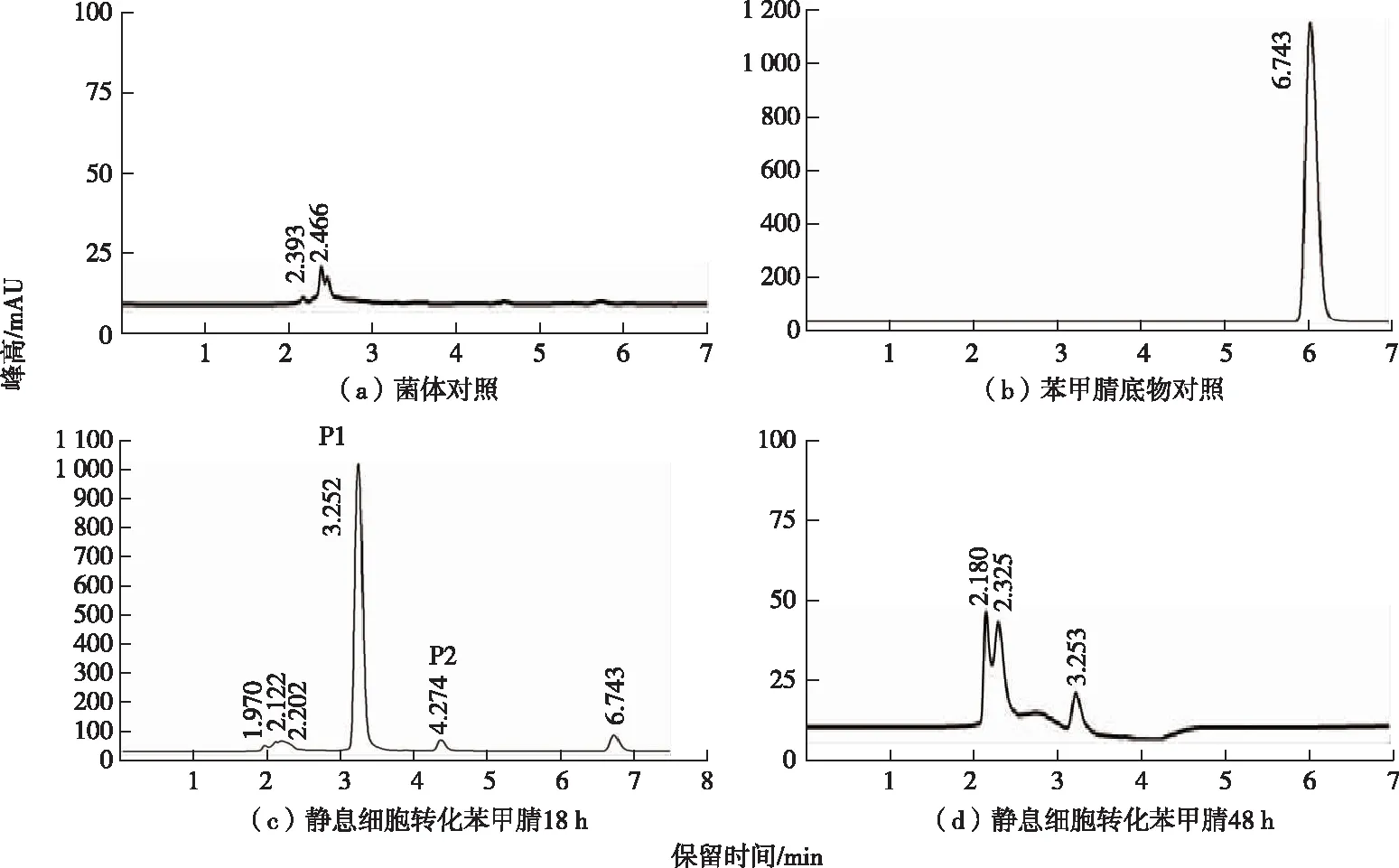
图2 暗灰链霉菌CGMCC 13662降解苯甲腈的HPLC分析
暗灰链霉菌CGMCC 13662的生长细胞与静息细胞对苯甲腈的代谢能力不同,生长细胞在ISP4液体培养基中完全降解0.5 g·L-1苯甲腈需要120 h,生成的ρ(苯甲酰胺)达到最高〔(0.47±0.02) g·L-1〕后不再降解〔图3(a)〕。静息细胞能在20 h内完全降解0.5 g·L-1苯甲腈,ρ(苯甲酰胺)在20 h达到最高值〔(0.42±0.02) g·L-1〕后则不断被降解,在45 h被完全降解〔图3(b)〕。无论生长细胞还是静息细胞在降解苯甲腈的过程中产生的苯甲酸质量浓度均很低(<10 mg·L-1)。
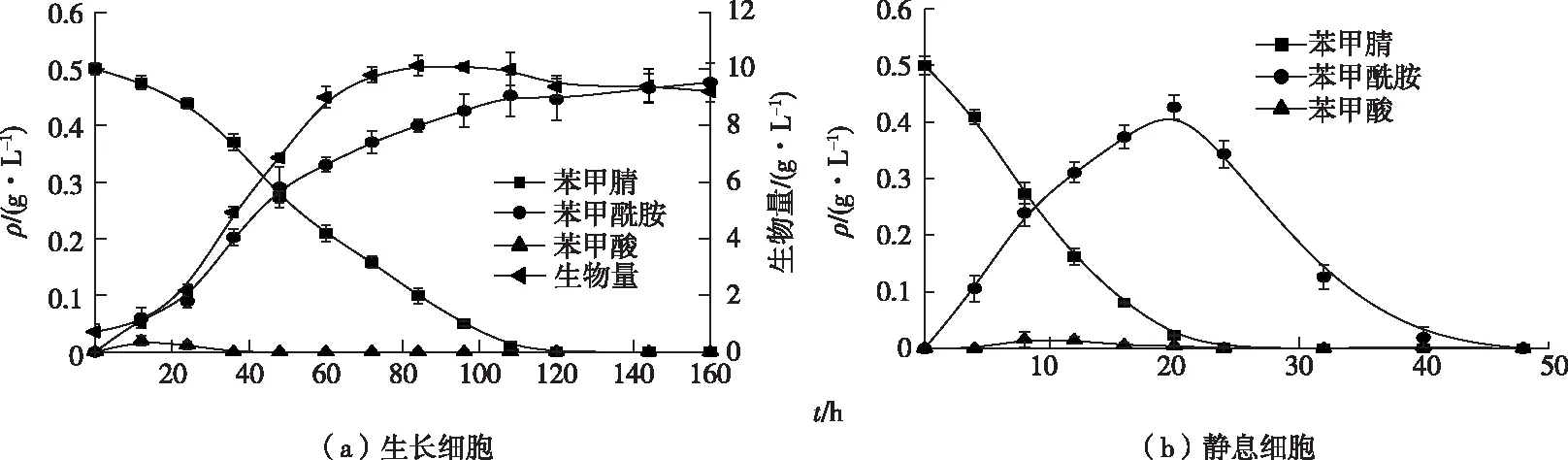
图3 暗灰链霉菌 CGMCC 13662 生长细胞和静息细胞降解苯甲腈
2.3 暗灰链霉菌CGMCC 13662对苯甲腈中间代谢产物的降解
分别以苯甲酰胺〔图4(a)〕和苯甲酸〔图4(b)〕为底物进行静息细胞转化,结果表明暗灰链霉菌CGMCC 13662对苯甲酰胺和苯甲酸有较高的降解能力。不同浓度苯甲酰胺在暗灰链霉菌CGMCC 13662转化下初期降解缓慢,0.2 g·L-1苯甲酰胺在18 h后才开始快速降解,30 h左右完全降解。ρ(苯甲酰胺)为5 g·L-1时60 h的降解率仅为19.5%。暗灰链霉菌CGMCC 13662能快速降解苯甲酸,0.2 g·L-1苯甲酸能在10 h内被完全降解,其对高浓度苯甲酸也有高效降解能力,5 g·L-1苯甲酸在48 h内能完全降解。暗灰链霉菌CGMCC 13662在代谢苯甲腈过程中能快速利用掉生成的苯甲酸,因此检测到的苯甲酸浓度始终处于较低水平。

图4 暗灰链霉菌CGMCC 13662降解苯甲腈中间代谢产物苯甲酰胺和苯甲酸
分别以苯甲酸代谢途径中的中间物原儿茶酸和儿茶酚为底物,发现暗灰链霉菌CGMCC 13662能完全降解原儿茶酸和儿茶酚(图5),因而推测暗灰链霉菌CGMCC 13662 可能同时通过儿茶酚途径、原儿茶酸途径进行苯甲酸代谢。儿茶酚降解途径包括邻位途径和间位途径,有报道发现这2条途径同时存在且受底物浓度调控,恶臭假单胞菌(Pseudomonasputida)P8在ρ(苯甲酸)较低时(<200 mg·L-1)代谢通过临位降解途径,当ρ(苯甲酸)高于300 mg·L-1时2种途径同时进行[17]。某些生物体中还同时存在其他多种代谢通路,如伯克霍尔德菌(Burkholderiaxenovorans)LB400同时存在儿茶酚途径中的邻位途径以及2条不同的苯甲酸-CoA途径[18],解鸟氨酸拉乌尔菌(Raoultellaornithinolytica)S12存在邻位途径和原儿茶酸途径[19];红球菌(Rhodococcussp.)R04代谢主要通过儿茶酚邻位途径、间位途径以及原儿茶酸途径共同完成[20]。暗灰链霉菌CGMCC 13662可以同时降解儿茶酚和原儿茶酸,但确定其代谢通路还需结合基因组测序和相关基因簇分析。
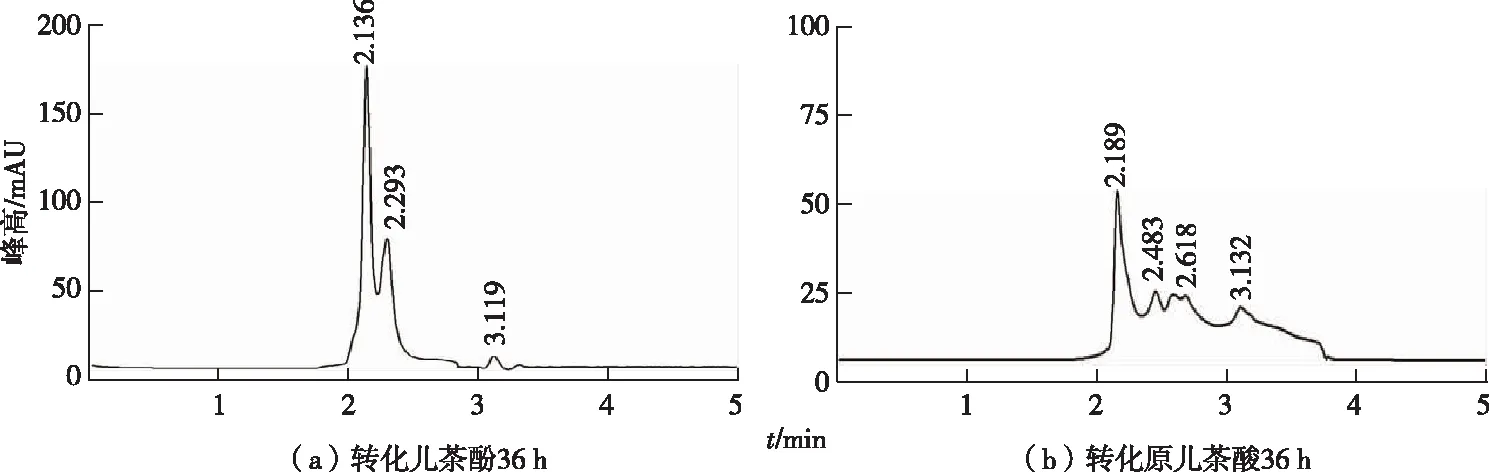
图5 暗灰链霉菌CGMCC 13662静息细胞降解苯甲酸的中间代谢产物儿茶酚和原儿茶酸
2.4 钴离子对暗灰链霉菌CGMCC 13662静息细胞降解苯甲腈的影响
暗灰链霉菌CGMCC 13662代谢苯甲腈过程中产生苯甲酰胺,表明菌体中存在腈水合酶。腈水合酶是金属离子酶,根据结合在金属活性中心的辅助因子,腈水合酶可分为钴离子型和铁离子型。经腈水合酶基因克隆、诱导表达以及腈水合酶活性分析,暗灰链霉菌CGMCC 13662腈水合酶是钴离子型腈水合酶,即钴离子能调控腈水合酶代谢途径。因此研究钴离子对暗灰链霉菌CGMCC 13662静息细胞降解苯甲腈的影响能有效反映相关酶代谢系统代谢苯甲腈的情况。图6是CoCl2对菌体代谢苯甲腈的影响。添加CoCl2培养的菌体静息细胞降解ρ(苯甲腈)在20 h时为(0.042±0.012) g·L-1,而未添加CoCl2的对照组为(0.081±0.001) g·L-1,初始ρ(苯甲腈)为0.55 g·L-1,结果表明CoCl2能提高腈水合酶活性。CoCl2除了改变苯甲酰胺生成速率,还对代谢过程中苯甲酸的生成有显著影响。不加CoCl2时在8 h内最高ρ(苯甲酸)可达0.094 g·L-1,而加入CoCl2后12 h仅生成0.016 g·L-1苯甲酸。但CoCl2对苯甲腈的降解速率影响不大,添加CoCl2与不添加时的降解半衰期分别为5.8 和6.7 h。
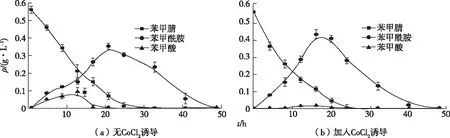
图6 添加CoCl2对暗灰链霉菌CGMCC 13662静息转化苯甲腈的影响
这是由于暗灰链霉菌CGMCC 13662测序的基因组(全长10 656 045 bp)中同时含有腈水合酶/酰胺酶、腈水解酶2条途径,钴离子能激活腈水合酶活性,增强了腈水合酶/酰胺酶代谢途径,因而苯甲酰胺的最高浓度高于不加钴离子的对照组;反之,在不加钴离子的对照组,苯甲腈经由腈水解酶途径的代谢流比例增加,因此苯甲酸浓度随之升高。
2.5 pH值对暗灰链霉菌CGMCC 13662 静息细胞代谢苯甲腈的影响
pH值对暗灰链霉菌CGMCC 13662降解苯甲腈和产物苯甲酰胺的影响如图7所示。pH值为7.5时苯甲腈降解速率最高,降解半衰期为5.4 h;pH值为7和8时苯甲腈降解半衰期分别为6.4 和9.9 h;当pH值为6时苯甲腈降解能力开始显著下降,降解半衰期延长为13.0 h;pH值为5时降解半衰期达15.6 h,结果表明腈水合酶在酸性条件下活性受到抑制。pH值为7.5时苯甲酰胺降解速率达到最大,在50 h以内完全降解;pH值为7和8时生成的苯甲酰胺要在60 h以后才可完全降解;然而当pH值为6时苯甲酰胺达到最高值的时间延长至50 h左右,然后才被降解,70 h的降解率仅为50%。当pH值为5时苯甲酰胺缓慢生成且不发生降解。上述结果表明产物苯甲酰胺的进一步降解对pH值的变化非常敏感,仅在pH值为7.5时达到最佳水平,偏酸偏碱都会抑制苯甲酰胺的降解。
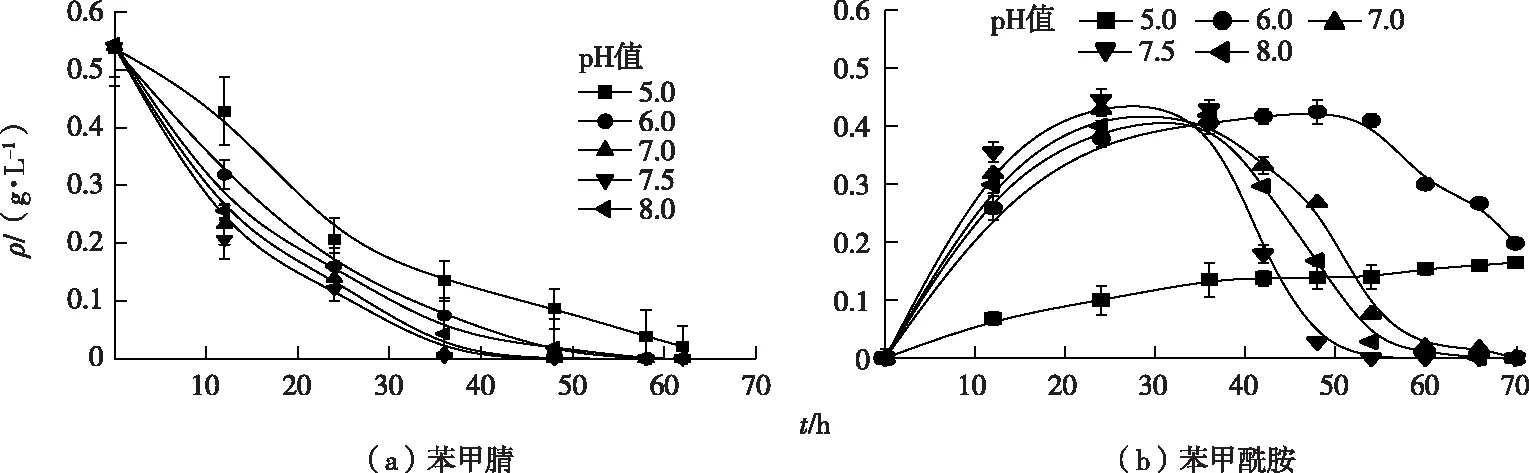
图7 pH值对暗灰链霉菌CGMCC 13662静息转化苯甲腈的影响
2.6 共代谢基质对暗灰链霉菌CGMCC 13662代谢苯甲腈的影响
共代谢基质(co-substrate)通常能促进有机污染物的降解,因而在静息细胞转化液中分别加入苹果酸钠、琥珀酸钠、葡萄糖、蔗糖来研究其对苯甲腈降解的影响。苯甲腈和产物苯甲酰胺的变化如图8所示。未添加其代谢基质的对照组的苯甲腈降解半衰期为5.4 h,苯甲酰胺生成量在25 h达到最高后在50 h内完全降解。添加苹果酸钠后,苯甲腈代谢速率明显加快,降解半衰期减少到3.8 h,同时苯甲酰胺含量在12 h达到最高,在40 h内完全降解。葡萄糖、蔗糖、琥珀酸钠对苯甲腈代谢速率几乎没有影响,苯甲酰胺都在25 h达到最高,但共代谢基质对之后苯甲酰胺降解的影响不同。葡萄糖、蔗糖减缓了苯甲酰胺的降解速度,苯甲酰胺在60 h后才完全降解,但添加琥珀酸钠后苯甲酰胺的降解与对照组没有差别。上述结果中苹果酸盐能显著促进腈水合酶的活性,加速苯甲酰胺的生成,但对苯甲酰胺代谢没有影响;葡萄糖和蔗糖对腈水合酶活性没有影响,但却抑制苯甲酰胺的代谢,其降解机制需进一步深入研究。
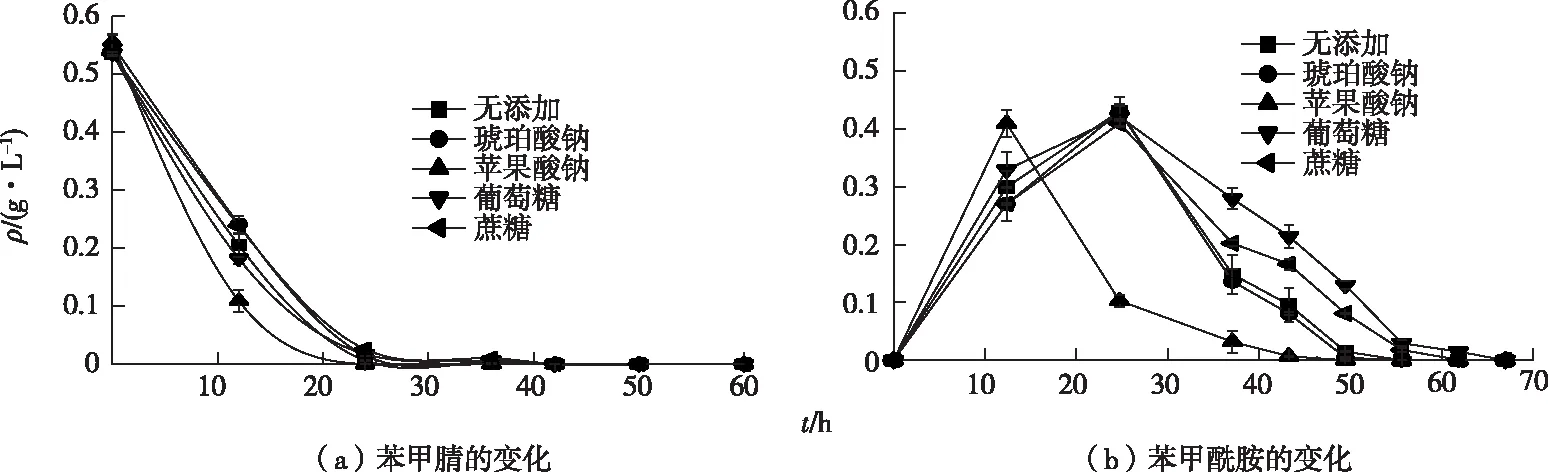
图8 共代谢基质对暗灰链霉菌CGMCC 13662静息转化苯甲腈的影响
3 结论
通过暗灰链霉菌CGMCC 13662代谢苯甲腈及其中间产物确定其代谢通路,并探究钴离子、pH值和共代谢物质对代谢途径的影响,得到以下结论:
(1)暗灰链霉菌CGMCC 13662同时通过腈水合酶/酰胺酶、腈水解酶2条代谢途径对苯甲腈进行降解,生成的苯甲酸可通过儿茶酚途径和原儿茶酸途径进一步代谢。
(2)CoCl2激活暗灰链霉菌 CGMCC 13662中腈水合酶活性,增强了腈水合酶/酰胺酶代谢途径;在无CoCl2时通过腈水解酶代谢苯甲腈的途径增加。
(3)酸性条件下苯甲腈降解减慢,腈水合酶活性受到抑制;苯甲酰胺的降解对pH值变化敏感,仅在pH值为7.5时降解速率最快,偏酸偏碱条件下都会被抑制。
(4)苹果酸盐促进苯甲腈的降解和加速苯甲酰胺的生成,对腈水合酶活性有促进作用,葡萄糖和蔗糖抑制苯甲酰胺的进一步降解。

