贝莱斯芽孢杆菌总RNA提取的Trizol改良法①
王 松 龚禹瑞 袁亚男 尚静静 张树竹 陈本佳 秦世雯
(云南大学农学院/云南省多年生稻工程技术研究中心 云南昆明650500)
贝莱斯芽孢杆菌(Bacillus velezensis)是芽孢杆菌属的一个新种,属于革兰氏阳性菌,存在于土壤、水体、动植物体内[1]。近年来,国内外研究人员相继分离到不同的B.velezensis菌株,发现其在促进植物生长、拮抗病原菌及食品发酵等方面发挥良好作用,且对环境友好、易于人工培养,在农业、食品、环保、工业和医药等领域具有重要的理论和应用研究价值[2-5]。获得高质量总RNA 是进行RT-PCR、qRT-PCR、cDNA 文库构建、Northern 杂交、转录组和翻译组测序等研究的基础[6-8]。因此,高效、简便的B.velezensis总RNA提取方法对该菌的深入研究和利用至关重要。
目前常见的细菌总RNA 提取方法有CTAB 法、强变性剂法、SDS-Phenol法及热硼酸法等[7,9],这些方法各有优缺点,并根据菌体特性适用于不同细菌类型。有效的细胞裂解是提取高产量细菌总RNA 的关键步骤。目前细菌细胞壁破碎的方法有酶解法、玻璃珠法和超声波法[10-11]。相对于真核生物,细菌的RNA含量少,半衰期短,易降解;内外环境以及操作体系无处不在的RNA 酶(RNase)会导致细菌总RNA提取效果不理想[7]。此外,破碎的细胞内含物常与RNA 形成难溶的物质,导致RNA 难以分离。而国内关于高质量总RNA提取研究多集中于真核生物,尚缺乏高效、简便和经济的细菌高质量总RNA提取方法。
Trizol 法能够快速高效分离不同的生物来源样品的总RNA,所提取的总RNA 浓度和纯度高,不需要超速离心或多步酚—氯仿进行抽提[7]。然而,常规Trizol 法不能够有效裂解细菌细胞壁,且对RNase 的抑制效果并不理想,无法获得高质量的细菌总RNA[9]。因此,针对B.velezensis分泌蛋白量大且种类多、细胞壁厚等特点,本研究通过优化菌体培养条件、洗涤菌体次数、溶菌酶裂解细胞、液氮冷冻处理等方法,对传统Trizol法进行改良,获得了高质量的B.velezensis总RNA,为该菌的分子生物学研究提供了一种高效、简便和经济的总RNA提取技术。
1 材料与方法
1.1 材料
1.1.1 供试菌株
B.velezensis YQ1菌株由云南大学农学院植物病理研究室分离鉴定并于-80℃中保存。
1.1.2 主要试剂及仪器
Trizol 试剂(Invitrogen,美国),0.1% DEPC水,溶菌酶(200 mg/mL)(Solarbio,北京),D 2 000 DNA Marker(天根,北京),RibopureTMBacteria kit(Invitrogen,美国),台式高速冷冻离心机(Thermofisher,美国)等。
1.2 方法
1.2.1 常规Trizol法
(1)菌体培养及收集:将保存于-80℃的B.velezensis YQ1 菌株接种于LB 液体培养基中进行活化培养,30℃,180 r/min 振荡培养16 h。①固体培养条件菌体培养与收集:用接种环蘸取上述活化菌液在LB 固体培养基上划线,30℃恒温倒置培养24 h 后,取50 mg 菌体至1.5 mL 离心管中。②液体培养条件菌体培养与收集培养:将1 mL上述活化菌液加入200 mL LB 培养基中,30℃,180 r/min振荡培养,待OD600值达到1.0,8 000 g,4℃离心5 min,弃上清后取50 mg菌体至1.5 mL离心管中。
(2)总RNA 提取步骤:①往上述离心管加入0.75 mL Trizol 试剂,移液器吸打混匀菌体,以最大转速涡旋振荡3~5 min;②室温孵育5~10 min。加入0.2 mL 氯仿,上下颠倒混匀,室温孵育2~3 min;③4℃、12 000 g 离心10 min;④吸取上清,加入等体积的异丙醇,上下颠倒混匀,置于20℃中冰冻10 min;⑤4℃、12 000 g 离心10 min;弃上清,加1 mL 75%乙醇,温和振荡5~10 s;⑥4℃、7 500 g 离心5 min;⑦弃上清,超级工作台中晾置5~10 min 至乙醇完全挥发;⑧加入30~50 μL DEPC水溶解,获得的总RNA于-80℃冰箱保存。
1.2.2 Trizol改良法
(1)菌体培养条件优化:①固体培养条件下菌体培养时间优化:将活化菌液划线至LB固体培养基上,30℃倒置培养24、36和48 h,分别取50 mg菌体至1.5 mL离心管中。②液体培养条件下菌液OD600值优化:1 mL 活化的菌体加入200 mL LB 培养基中,30℃振荡培养至菌液OD600值为0.5、1.0、1.5 和2.0 时,8 000 g,4℃离心5 min,弃上清后取50 mg菌体至1.5 mL 离心管中。
(2)菌体DEPC 水处理:用25 mL 0.1%DEPC 水洗涤菌体,洗涤次数分别设置为1、2、3、4 次,充分混匀菌体后,4℃,8 000 g离心5 min,弃上清后取50 mg菌体至1.5 mL离心管中。
(3)溶菌酶处理:向最适DEPC 水处理后的菌体中加1 mL DEPC 水,混匀后分别加入20、30、40 μL 的溶菌酶,37℃静置30 min,4℃、10 000 g 离心1 min,收集菌体。
(4)液氮处理:将最适溶菌酶处理后的菌体置于1.5 mL离心管中,液氮冷冻2~3 min,未进行液氮处理的菌体设置为对照。加入Trizol 试剂前将上述离心管取出后置于冰上融化。
(5)总RNA 的提取:总RNA 提取步骤同上述常规Trizol法总RNA提取步骤。
1.2.3 改良Trizol法与试剂盒法的比较
RibopureTMBacteria Kit 试剂盒总RNA 提 取 方法如下:取1 mL 菌液(OD600为1.0),将250 μL 氧化锆珠滴入0.5 mL 的螺旋盖中;离心收集样品,加入350 μL RNAWTZ,涡旋振荡均匀,将RNAWTZ中的细胞转移到250 μL 的氧化锆珠,拧紧盖子,涡旋器中最大转速振荡10 min,充分溶解;4℃,14 000 g离心5 min;溶菌产物转移到新的1.5 mL 离心管,加入0.2 倍体积的氯仿,混匀,室温孵育10 min;4℃、14 000 g 离心5 min;水相转移到新的1.5 mL离心管,加0.5倍体积的无水乙醇,完全混合,将滤器放入2 mL 的收集管,将样品转移到滤器中;4℃、14 000 g 离心1 min;弃滤筒,滤器转入新的 滤 筒,加700 μL Wash Solution 1;4℃、14 000 g 离心1 min;丢弃滤筒,过滤器放入收集管,加500 μL Wash Solution 2/3;4℃、14 000 g离心1 min;弃滤筒,过滤器放入收集管,重复上述步骤一次;4℃、14 000 g 离心1 min,转移到2 mL的收集管;将预热至95℃的25~50 μL洗脱液加到滤池中心;4℃、14 000 g 离心1 min;重复上述两步一次,获得的总RNA于-80℃冰箱保存。
1.2.4 总RNA质量及完整性检测
(1)1%琼脂糖凝胶电泳检测:取总RNA 样品4~5 μL,于1%的琼脂糖凝胶电泳检测。200 V恒压,16 min。凝胶成像仪上观察条带,并记录结果。
(2)RNA 纯度和浓度检测:取2 μL 总RNA 样品,用超微量紫外分光光度计(Thermofisher,美国)分别检测A260/A280、A260/A230及浓度(ng/μL)。总RNA 的A260/A280值为2.0 且A260/A230值 为2.0~2.5时为高纯度总RNA。
(3)cDNA 的合成和扩增质量鉴定:利用RTPCR 法对Trizol 改良法提取的总RNA 进行反转录扩增质量鉴定,以常规法提取的总RNA作为对照。根据Takara AMV (V 3.0) Reverse Transcriptase(Takara,大连)的说明进行cDNA 第一链的合成和RT-PCR 扩增。RT-PCR 扩增片段为B.velezensis16S rRNA片段,所用引物为(F:5’-CTTCGGGTGTTACAAACTCTCG-3’;R:5’-TAAGCCAATCCCACAAATCTG-3’),利用1%的琼脂糖凝胶电泳进行检测。
2 结果与分析
2.1 常规Trizol法提取
如图1 所示, 常规Trizol 法提取的B.velezensis总RNA 存在明显的降解,且A260/A280和A260/A230值均小于2.0(表1),说明有杂质污染。推测培养基残留,B.velezensis培养过程中分泌物多,菌体细胞壁未完全破裂,造成常规Trizol 法无法提取到该菌完整的总RNA。
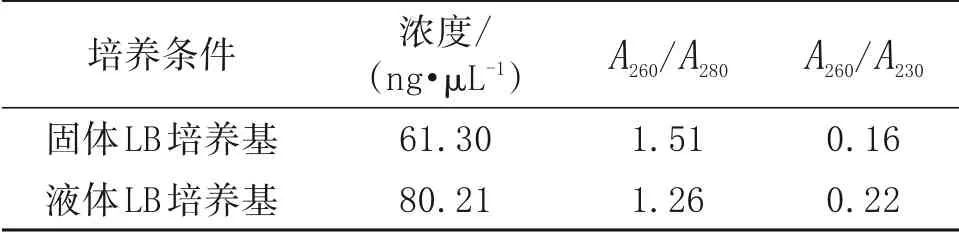
表1 常规Trizol法提取Bacillus velezensis总RNA的浓度和质量
2.2 Trizol改良法提取
2.2.1B.velezensis培养条件的优化
在进行菌体培养时,若B.velezensis生长对数期之前收集菌体,菌体量少;而进入对数生长期后,B.velezensis分泌大量的胞外酶(包括RNase),严重影响总RNA提取质量。为明确菌体培养环境及培养时间对B.velezensis总RNA 提取的影响,分别取LB 固体和液体培养基条件下不同培养时间的菌体进行总RNA提取。如图2和表2所示,在LB固体培养基条件下,24 h的总RNA浓度和纯度相对较高,说明在LB 固体培养基条件下,应尽量选取24 h(对数生长早期)的菌体进行总RNA 抽提。但24、36、48 h 总RNA 均有不同程度的降解,且A260/A280和A260/A230值均小于2.0(表2),说明有蛋白、酚类、多糖等杂质污染。

表2 LB固体培养基条件下不同培养时间B.velezensis总RNA的浓度和质量
如图3 所示,在LB 液体培养基条件下当菌体OD600值为1.0 和1.5 时能够提取质量较高的总RNA,但存在降解,且A260/A280和A260/A230值均小于2.0(表3),说明有蛋白、酚类、多糖等杂质污染;而OD600值为0.5 和2.0 时总RNA 严重降解。说明在LB 液体培养基条件下,菌体培养至OD600值为1.0~1.5 时是最佳的总RNA提取时间。
2.2.2 不同洗涤次数预处理对B.velezensis总RNA提取的影响
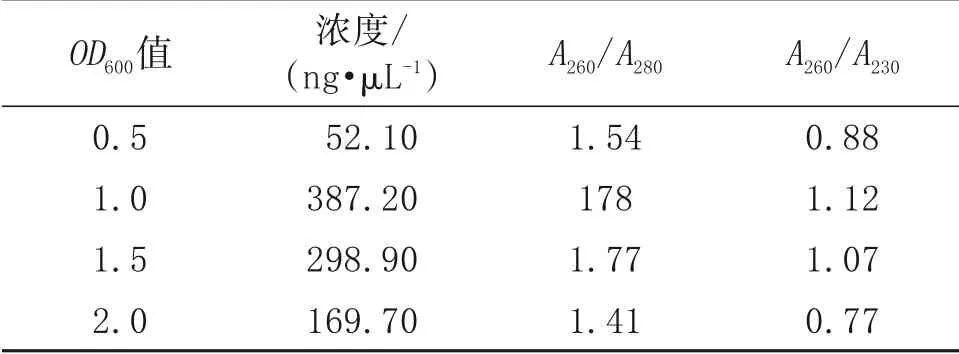
表3 LB液体培养基条件下不同B.velezensis菌体OD600值的总RNA浓度和质量
收集菌体时,残留的培养基和菌体分泌物等对总RNA提取存在严重影响,因此本研究采用DEPC水洗涤菌体的方法来减少杂质和RNase影响。为明确洗涤次数对减少杂质和菌体分泌物的效果,分别对LB 液体培养基条件下收集的菌体(OD600值为1.0)进行1、2、3、4次洗涤。如图4和表4所示,洗涤2 次的B.velezensis总RNA 质量较高,但均存在一定程度的降解。另外,DEPC 水洗涤处理后,总RNA浓度较低,不利于后续进行RNA纯化处理。
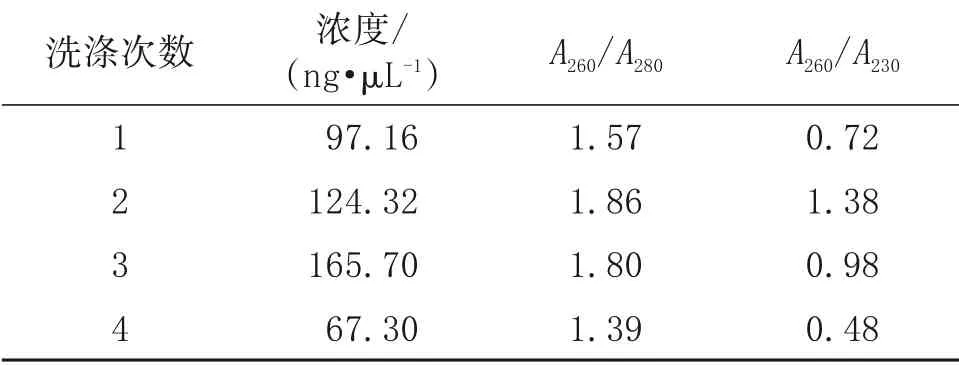
表4 DEPC水洗涤处理后B.velezensis 总RNA的浓度和质量
2.2.3 溶菌酶处理对B.velezensis总RNA提取的影响
为提高B.velezensis总RNA 提取量,需完全裂解菌体细胞壁,释放核酸。本研究将上述DEPC水洗涤2次后的菌体,分别用20 μL(20 mg)、30 μL(30 mg)、40 μL(40 mg)溶菌酶处理菌体。如图5和表5 所示,溶菌酶处理后,总RNA 浓度得到了明显提高,30 μL(30 mg)溶菌酶处理后提取的总RNA质量和浓度最高,但仍存在一定程度降解(表5)。说 明30 μL(30 mg) 溶 菌 酶 能 够 完 全 裂 解B.velezensis(OD600值为1.0)细胞壁,保证高浓度的总RNA提取量。

表5 溶菌酶处理后B.velezensis总RNA浓度和质量
2.2.4 液氮冷冻处理菌体对B.velezensis总RNA 提取的影响
通过DEPC 水洗涤和溶菌酶处理后,提取的总RNA仍存在降解情况,说明B.velezensis体内或提取过程中仍有RNAase 的影响。为抑制RNAase 活性,本研究对上述30 μL(30 mg)溶菌酶处理的菌体进行液氮冷冻。如图6 所示,提取菌体的总RNA可以清晰的看到23S、16S 和5S 条带。相较于未进行液氮处理的样品,液氮处理后提取的总RNA降解程度少,并且浓度和纯度高(表6),说明液氮处理能够有效降低B.velezensis内源性和提取过程中RNAase活性。
2.3 Trizol改良法和试剂盒法比较

表6 液氮冷冻处理提取B.velezensis总RNA的质量和浓度比较
由以上结果确定了B.velezensis总RNA Trizol改良法。为比较其与试剂盒法提取的总RNA效果,选取革兰氏阳性菌总RNA提取试剂盒RibopureTMBacteria Kit。如图7 所示,2 种方法均能获得完整和高纯度的总RNA,而Trizol法改良法提取的总RNA浓度更高,但相对于试剂盒法提取时间较长(表7)。另外,试剂盒法提取的单个样本总RNA价格比Trizol 改良法昂贵。因此Trizol 改良法适用于B.velezensis大批量样本的总RNA 提取,而试剂盒法适用于小批量样本的总RNA快速提取。
2.4 RT-PCR扩增检测

表7 Trizol改良法和试剂盒法提取的B.velezensis总RNA浓度和质量
以Trizol 常规法和改良法所提取的总RNA 为模板进行反转录合成cDNA 第一链。随后以其为模板,利用B.velezensis16S rRNA的荧光定量PCR引物进行PCR扩增。结果表明,Trizol常规法提取的总RNA 无法扩增出16S rRNA 片段,而Trizol 改良法提取的总RNA 能够扩增出明显的16S rRNA 片段,且片段大小与预期相符(163 bp),说明Trizol 改良法提取的总RNA能够满足RT-PCR要求。
3 讨论与结论
B.velezensis不仅具有富含肽聚糖的细胞壁,还具有强大的胞外酶分泌系统,同时易产生内源性RNase,这些特点加大了其总RNA提取难度[10-11]。贝莱斯芽孢杆菌在对数生长早期,细胞分裂旺盛,胞内活动主要以细胞分裂相关为主,细胞壁积累较少,分泌物较少,易于破碎细胞并获得高质量的总RNA。由于常规Trizol 法无法提取到B.velezensis完整的总RNA,因此,本研究比较了不同培养条件下,不同生长时期对B.velezensis总RNA提取的影响,结果表明,LB液体培养条件下的B.velezensis总RNA 提取质 量 较好,且OD600值 为1.0~1.5 是最佳提取时期。针对B.velezensis具有较强的胞外酶分泌系统特性,本研究通过DEPC水洗涤处理,在一定程度上减少了分泌物和残留培养基的影响,与枯草芽孢杆菌总RNA提取方法的研究结果相符[12]。本研究通过加入适量溶菌酶裂解菌体,提高了总RNA浓度,但该方法并不适用于粪肠球菌和金黄色葡萄球菌[13-14],推测溶菌酶对不同革兰氏阳性菌的裂解效率存在差异。另外,本研究通过对菌体液氮冷冻处理后发现,液氮能够抑制菌体破裂后的RNAase 活性,防止总RNA 在提取过程中的降解[10]。本研究还比较了Trizol 改良法与试剂盒提取B.velezensis总RNA 浓度效果,结果表明Trizol 改良法更加适合于大批量B.velezensis总RNA提取。
本研究提供了一种简便有效的B.velezensis总RNA 提取方法,为满足B.velezensis相关分子生物学研究提供了重要的技术支撑。

