雷公藤红素诱导多发性骨髓瘤H929细胞凋亡*
柯 波, 万才水▲, 李安娜, 刘婷婷, 邓秀英, 孔春芳, 金成豪△
(1南昌大学附属人民医院血液内科, 2江西省血液肿瘤细胞生物学重点实验室, 江西 南昌 330006)
多发性骨髓瘤(multiple myeloma,MM)是一种常见的恶性血液肿瘤,是血液系统第2位常见恶性肿瘤,发病率有逐年上升的趋势[1]。MM大约占血液恶性肿瘤中10%,好发于老年人,其中位发病年龄为69岁[2],主要表现为骨髓中浆细胞恶性增生,导致骨破坏、骨髓造血衰竭和多个器官组织损伤。MM至今仍无法治愈,并且复发和耐药仍不可避免,存在复发率高、药物耐受和疾病进展等临床问题,这提示MM细胞具有生物学异质性,可能存在一小部分细胞耐药并导致肿瘤复发。
雷公藤红素(celastrol)是传统中药雷公藤中的一种单体,又名南蛇藤素,是从雷公藤属及南蛇藤属植物中分离出的五环三萜类色素,具有较强的抗炎、免疫抑制、抑制血管形成[3]以及抗肿瘤等药理活性[4]。雷公藤红素可以通过抑制NF-κB和STAT3的持续活化,下调细胞增殖和抗凋亡基因的表达,从而抑制多发性骨髓瘤细胞株的增殖,联合沙利度胺和硼替佐米可增强对细胞凋亡的诱导作用[5]。本研究通过雷公藤红素处理人多发性骨髓瘤H929细胞,流式细胞术检测细胞凋亡和线粒体膜电位,彗星电泳实验检测DNA损伤,探讨雷公藤红素对H929细胞凋亡的诱导作用和分子机制。
材 料 和 方 法
1 实验材料
H929细胞株购于南京凯基公司,由本实验室传代和保存。雷公藤红素购于上海源叶公司;胎牛血清购于杭州四季青公司;RPMI-1640培养基和青链霉素购于北京索莱宝公司;CCK8试剂盒购于AbMole;罗丹明123荧光染料和彗星法DNA损伤检测试剂盒购于南京凯基公司;caspase-9抑制剂Z-LE(OMe)HD(OMe)-FMK购于南京凯基公司;annexin V-PE/7-AAD细胞凋亡检测试剂盒购于BD;兔抗人GAPDH、P53、XIAP、BAX、cytochrome C、COX IV、caspase-8和cleaved caspase-3抗体及羊抗兔HRP标记的II抗购于Abcam;抗体稀释液和封闭液购于上海碧云天公司;ECL化学发光试剂盒购于CST。倒置光学显微镜购于OLYMPUS;CO2细胞恒温培养箱购于日本三洋公司;RT6100 酶标仪购于深圳雷杜公司;垂直电泳槽和转移电泳槽购于Bio-Rad;FACSCalibur流式细胞仪购于BD。
2 实验方法
2.1细胞系及细胞培养 H929细胞株用含10%胎牛血清的RPMI-1640培养液悬浮培养,待细胞生长至对数期,用新鲜培养液悬浮细胞,并铺种于细胞培养板用于后续实验。
2.2CCK8法检测细胞活力抑制率 选取对数生长期的H929细胞并用10%胎牛血清的RPMI-1640培养液悬浮,细胞计数后调整细胞密度至1×109/L,加入0.5、1、5和10 mg/L的雷公藤红素(DMSO溶解),对照组加入等体积DMSO,置于37 ℃、5% CO2细胞培养箱中常规培养24 h和48 h,加入CCK8孵育2 h后检测A450,比较不同浓度雷公藤红素对H929细胞的抑制率,每组设置3个复孔。细胞活力抑制率(%)=(1-实验组A值均值/对照组A值均值)×100%。
2.3流式细胞术检测细胞凋亡 取对数生长期的H929细胞,按1×109/L的细胞密度接种于12孔细胞培养板中,分组加入不同浓度的雷公藤红素(1 mg/L和5 mg/L),37 ℃、5% CO2细胞培养箱中继续培养24 h后,收集细胞并用PBS溶液清洗1次,加入预冷的1×binding buffer并悬浮细胞,调整细胞密度,取0.2 mL细胞悬液并加入5 μL annexin V-PE和10 μL 7-AAD,室温避光孵育15 min后加入0.3 mL 预冷的1×binding buffer混匀,用流式细胞仪上机检测。
2.4细胞线粒体膜电位的检测 取对数生长期的H929细胞,按1×109/L的细胞密度接种于12孔细胞培养板中,分组加入不同浓度的雷公藤红素(1、5和10 mg/L),37 ℃、5% CO2细胞培养箱中继续培养24 h后,收集细胞并用PBS溶液清洗1次,加入罗丹明123使终浓度为10 mg/L,37 ℃、5% CO2细胞培养箱中继续避光孵育20 min后,用培养基清洗2次,继续培养60 min后,用流式细胞仪上机检测。
2.5彗星电泳实验检测DNA损伤 取对数生长期的H929细胞,按5×108个/L的细胞密度接种于6孔细胞培养板中,按实验分为对照组和1、5 和10 mg/L的雷公藤红素处理组,37 ℃、5% CO2细胞24 h后,收集细胞并用PBS制成单细胞悬液,取10 μL 细胞悬液加入到75 μL 0.7% 低熔点琼脂糖凝胶中,混匀后铺第2层胶。按照彗星实验DNA检测试剂盒说明书进行铺胶、细胞裂解和DNA碱解旋,将载玻片放置于碱性电泳中,25 V电泳30 min后,用0.4 mmol/L Tris-HCL缓冲液中和染色,并加入20 μL PI避光染色10 min,荧光显微镜下拍照。应用Comet Assay Software Project (CASP)软件分析彗星电泳图中细胞的尾部DNA比例。
2.6Western blot检测蛋白水平 取对数生长期的H929细胞,按5×108/L的细胞密度接种于6孔细胞培养板中,按实验分为对照组、1 mg/L 和5 mg/L的雷公藤红素处理组和干预组,对照组加入等体积的DMSO,干预组中加入终浓度为5 μmol/L caspase 9抑制剂,37 ℃、5% CO2细胞培养箱中处理24 h再加入雷公藤红素,常规培养24 h后收集细胞并加入RAPI(含有磷酸酶抑制剂和蛋白酶抑制剂cocktail)冰上裂解2 h,用BCA法对蛋白浓度进行定量。取20 μg的蛋白进行SDS-PAGE,然后转印至PVDF膜上,于5%的BSA中室温封闭2 h;4 ℃条件下 I 抗孵育过夜,用PBST漂洗4次,每次6 min;用HPR标记的II 抗室温振荡孵育2 h,PBST漂洗4次;配置化学发光反应反应液并于室温条件下孵育NC膜、暗室中曝光、显影; Western blot结果用ImageJ图像分析软件分析目的蛋白条带与内参条带吸光度比值,得出目的蛋白的相对表达量。
3 统计学处理
数据采用GraphPad Prism 7软件进行统计分析,实验结果以均数±标准差(mean±SD)表示,多组比较采用单因素方差分析,两组间的差异比较采用非配对t检验,以P<0.05 表示差异具有统计学意义。
结 果
1 雷公藤红素抑制H929细胞的活力
采用CCK8法对H929细胞的活力进行检测,结果显示,不同浓度雷公藤红素处理H929细胞24 h和48 h均对H929细胞的活力产生明显的抑制作用,该抑制作用随着雷公藤红素浓度增加抑制效应也随之增强,雷公藤红素处理H929细胞48 h后的抑制率明显高于24 h组(P<0.05),见图1。
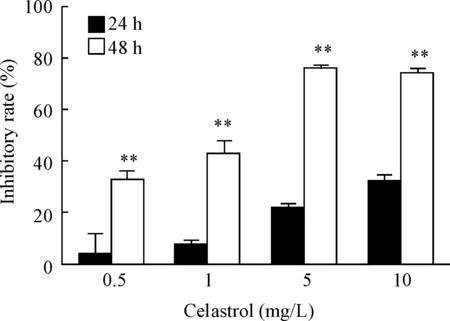
Figure 1.The effects of different concentrations of celastrol for different time on the viability inhibitory rate of H929 cells. Mean±SD.n=3.**P<0.01vs24 h group.
图1 不同浓度雷公藤红素作用不同时间对H929细胞活力抑制率的影响
2 雷公藤红素诱导H929细胞凋亡
流式细胞术结果显示,1 mg/L和5 mg/L雷公藤红素处理H929细胞24 h后,测得的凋亡率分别为(30.24±3.81)%和(76.75±1.51)%,明显高于对照组[(6.52±0.80)%,P<0.05]。这一结果提示雷公藤红素对H929细胞的凋亡有明显的促进作用,随着雷公藤红素浓度增加,促进H929细胞凋亡作用明显增强,见图2。

Figure 2.The effect of celastrol on the apoptosis of H929 cells detected by flow cytometry. Mean±SD.n=3.**P<0.01vs0 mg/L group.
图2 雷公藤红素诱导H929细胞凋亡
3 雷公藤红素诱导H929细胞中线粒体膜电位下降
不同浓度的雷公藤红素处理H929细胞后细胞线粒体膜电位均出现下降,应用FlowJo软件分析平均荧光强度(MFI),结果显示不同浓度雷公藤红素处理组的MFI值均下降,与对照组相比差异具有统计学意义(P<0.05),见图3。这一结果表明雷公藤红素诱导细胞对细胞凋亡的诱导作用可能是降低线粒体膜电位所介导的。

Figure 3.Decreased mitochondrial membrane potential in H929 cells induced by celastrol treatment. A: detection of the mitochondrial membrane potential of H929 cells by flow cytometry; B: decreased mean fluorescence intensity (MFI) was observed in celastrol treatment group. Mean±SD.n=3.**P<0.01vs0 mg/L group.
图3 雷公藤红素诱导H929细胞线粒体膜电位下降
4 雷公藤红素诱导H929细胞DNA损伤
不同浓度的雷公藤红素处理24 h均对H929细胞具有DNA损伤诱导作用。在10 mg/L雷公藤红素处理组中,彗星电泳实验显示细胞核DNA完全裂解,提示已经处于晚期凋亡状态,应用CASP软件分析彗星电泳图中细胞的尾部DNA比例,结果显示不同浓度雷公藤红素处理组尾部DNA比例升高,与对照组相比差异具有统计学意义(P<0.05),见图4。这一结果表明雷公藤红素可以诱导H929细胞DNA损伤,可能是诱导细胞凋亡的主要原因之一。
5 雷公藤红素诱导H929细胞P53及凋亡相关蛋白的表达
H929细胞经雷公藤红素处理24后,Western blot检测细胞中凋亡相关蛋白表达水平,结果显示,不同浓度的雷公藤红素(1 mg/L和5 mg/L)处理后,参与DNA损伤应答以及细胞凋亡途径的P53蛋白水平明显上调,同时NF-κB途径下游蛋白XIAP的表达水平降低,细胞凋亡执行者cleaved PARP-1和cleaved caspase-3均上调表达,与对照组相比差异具有统计学意义(P<0.05),见图5。
6 雷公藤红素通过caspase-9依赖性的线粒体途径诱导H929细胞凋亡
1 mg/L和5 mg/L雷公藤红素处理后细胞浆中cytochrome C含量明显上升,对照组细胞浆中仅检测出微量cytochrome C,同时1 mg/L和5 mg/L雷公藤红素处理组细胞线粒体内cytochrome C水平明显下降,见图6A。
caspase-9抑制剂提前干预后,cleaved caspase-3的蛋白水平与处理组相比明显下降,但是caspase-8的蛋白水平没有变化,提示雷公藤红素对H929细胞凋亡的诱导依赖于caspase-9的活性,见图6B。
讨 论
MM是一种目前尚未能治愈的恶性血液肿瘤,MM的显著特征为疾病的克隆性进展,疾病进程中发生的基因组事件可以分为原发性和继发性基因组事件,即“双打击”学说。虽然以大剂量化疗和造血干细胞移植为代表的治疗策略能提高缓解率,但仍会出现复发以及药物耐受,导致治疗失败。在恶性血液肿瘤中,尤其是淋巴系统血液肿瘤中,NF-κB信号途径出现的异常活化[6]。在几乎所有的原发性MM中,均发现NF-κB有异常的活化并与化疗不敏感有关[7]。

Figure 4.DNA damage in H929 cells induced by celastrol. The DNA damage of H929 cells was detected by comet assay. Mean±SD.n=5.**P<0.01vs0 mg/L group.
图4 雷公藤红素诱导H929细胞DNA损伤

Figure 5.The effect of celastrol on the protein levels of P53 and apoptosis-related molecules in the H929 cells. Mean±SD.n=3.**P<0.01vs0 mg/L group.
图5 雷公藤红素对H929细胞中P53和凋亡相关蛋白表达的影响

Figure 6.Celastrol activated mitochondrial apoptosis pathway in a caspase-9-dependent manner. A: detection of the protein levels of cytochrome C located in mitochondrion and cytoplasm of H929 cells by Western blot; B: caspase-9 inhibitor reversed the increase in the protein level of cleaved caspase-3 induced by celastrol. Mean±SD.n=3.*P<0.05,**P<0.01vs0 mg/L group;△△P<0.01vscontrol group;##P<0.01vscelastrol group.
图6 雷公藤红素依赖于caspase-9激活细胞线粒体凋亡途径
本研究应用CCK8法和细胞凋亡实验分析雷公藤红素对H929细胞是否具有生长抑制及诱导细胞凋亡的作用。结果显示0.5~10 mg/L浓度的雷公藤红素呈浓度依赖性地抑制细胞活力;有研究指出,雷公藤红素可通过诱导A549细胞于G1期阻滞,导致了细胞生长抑制和凋亡增加[8]。细胞凋亡实验结果显示1 mg/L和5 mg/L的雷公藤红素处理组中annexin V阳性细胞比例明显高于对照组,提示雷公藤红素对H929细胞具有明显的细胞凋亡诱导作用。雷公藤红素可以诱导细胞凋亡,但是其作用机制仍未阐明。本研究通过罗丹明123荧光探针加载细胞,流式细胞术分析H929细胞线粒体膜电位水平,实验结果显示雷公藤红素处理后线粒体膜电位均出现下降,并呈浓度依赖性。有报道指出,雷公藤红素可以诱导非小细胞肺癌A549细胞线粒体膜电位下降,以及细胞色素C释放[9]。然而,雷公藤红素对棕榈酸盐诱导的C2C12肌管细胞线粒体损伤具有保护作用,其机制是通过激活PI3K-AKT信号途径增强细胞对葡萄糖的摄取以及三羧酸循环中间产物水平[10]。本研究的Western blot实验结果显示,雷公藤红素明显诱导H929细胞线粒体中的细胞色素C释放,提示雷公藤红素可能通过线粒体途径诱导H929细胞凋亡。
从线粒体中释放的cytochrome C通过激活caspase-9启动细胞凋亡联级反应,是线粒体凋亡途径中重要的机制。caspase-9是线粒体凋亡的关键蛋白, caspase-8是死亡受体凋亡途径中关键的半胱天冬酶。为了确定雷公藤红素是否依赖于caspase-9诱导细胞凋亡,本研究通过caspase-9抑制剂提前干预,分析雷公藤红素对细胞凋亡关键蛋白caspase-3的活性,结果提示雷公藤红素依赖于caspase-9促进细胞凋亡,而对caspase-8的表达无明显作用。
P53作为维持基因组稳定性的监护者,在50%的人类肿瘤中发生突变[11]。MM患者中P53突变或缺失发生率分别为3%和10%,且与治疗的耐药有关,特别是在疾病进展后期[12-14]。正常情况下,P53与E3泛素化蛋白连接酶MDM2相互作用,保持较低的表达水平。当细胞在应激状态下发生磷酸化,抑制与MDM2的相互作用所介导的蛋白降解,并通过其转录因子活性启动下游基因的表达,参与细胞周期调控并诱导细胞凋亡[15]。然而,NF-κB途径的活化可以抑制P53的转录以及P53介导的细胞凋亡[16-17]。本研究中的彗星实验结果显示雷公藤红素处理的H929细胞彗尾DNA比例明显上升,且呈浓度依赖性,结果提示雷公藤红素具有诱导DNA损伤的作用,同时也可能是诱导P53表达的主要原因之一。
本研究的Western blot实验结果显示,经雷公藤红素处理的H929细胞中P53表达水平明显上调。有文献报道雷公藤红素处理后的非小细胞肺癌细胞株中,P53的mRNA和蛋白表达水平均上调表达[18]。有文献报道雷公藤红素具有增强前列腺癌细胞对放疗的敏感性,其机制可能是通过抑制DNA损伤应答,增强细胞凋亡[19]。雷公藤红素还可以诱导成纤维样滑膜细胞DNA损伤,促进细胞凋亡,提示可能为类风湿性关节炎的治疗提供新的思路[20]。还有报道显示雷公藤红素可以抑制范可尼贫血症(Fanconi anemia,FA)通路,并且是一种FANCD2抑制剂,通过干扰其泛素化修饰及蛋白的稳定性,抑制肿瘤细胞内DNA损伤修复途径,增强对化疗药物的敏感性[21]。因此,雷公藤红素可能通过诱导DNA损伤激活P53的表达,并影响细胞凋亡进程。
雷公藤红素作为一种蛋白酶体抑制剂,对NF-κB途径的活化具有抑制作用,并参与炎症调节,发挥抗炎作用。研究表明雷公藤红素具有抑制肿瘤细胞增殖,促进细胞凋亡的生物学作用,发挥抗肿瘤作用,其主要分子机制为抑制IκBα亚基的磷酸化降解,抑制NF-κB途径的活化,从而影响下游Bcl-2家族蛋白的表达[22-23]。本研究的Western blot实验结果也显示雷公藤红素处理后的H929细胞中XIAP蛋白下调表达。XIAP是NF-κB的下游蛋白,对caspase-9以及下游的caspase-3的活性具有抑制作用,表现出抗凋亡作用[24]。因此,雷公藤红素促进H929细胞凋亡,可能与NF-κB的活化及其下游蛋白表达受抑有关。
综上所述,雷公藤红素对多发性骨髓瘤H929细胞的活力具有抑制作用,并诱导细胞凋亡,可能与抑制NF-κB的活化、促进P53的表达以及诱导线粒体凋亡途径有关。同时,雷公藤红素具有诱导DNA损伤的作用,也是其诱导细胞凋亡的主要机制之一。雷公藤红素抗肿瘤作用机制的研究为MM的临床治疗提供理论基础,可能成为MM患者潜在的治疗选择。

