棘胸蛙白内障病症的致病菌鉴定及其敏感药物筛选
杨滢 张雪萍 吴锐琼 黄其锻 李达谅 陆永树 耿宝荣 陈友铃 黄镇


摘 要:棘胸蛙Quasipaa spinosa是福建省特色有藥用和食用价值的蛙类品种,目前棘胸蛙的养殖已经逐步实现规模化,但是养殖中的疾病问题随着养殖密度的增加逐年加重。白内障病症是常见的棘胸蛙细菌性疾病之一,为解析棘胸蛙白内障的致病菌以及对该病的防治,对患白内障病棘胸蛙的器官进行病原菌的分离纯化并进行鉴定,同时进行了人工感染确定其致病性,最后通过抑菌圈法检测该菌株对20种抗生素的敏感性。人工感染试验结果显示,从患白内障病的棘胸蛙内脏中分离的细菌进行人工感染后,可导致正常蛙出现白内障病的病征,通过16S rDNA序列鉴定为彭氏变形杆菌Proteus penneri。药敏试验结果显示该菌株对氯霉素、多粘菌素B、环丙沙星、氧氟沙星、诺氟沙星、米诺环素、新霉素、卡那霉素、庆大霉素、丁胺卡那、头孢哌酮、头孢曲松、头孢他啶、头孢呋辛、哌拉西林、羧苄西林、氨苄西林敏感,而对其他多种药物耐受。本研究表明彭氏变形杆菌可导致棘胸蛙出现白内障的病征,为棘胸蛙养殖过程中白内障病的诊断及防治提供了理论基础。
关键词:棘胸蛙;白内障病;致病菌;彭氏变形杆菌;药敏试验
中图分类号:S947.2 文献标志码:A 文章编号:0253-2301(2020)12-0009-06
DOI: 10.13651/j.cnki.fjnykj.2020.12.002
Identification of Pathogenic Bacteria of Cataract in Quasipaa Spinosaand the Screening of Its Sensitive Drugs
YANG Ying1, ZHANG Xueping1, WU Ruiqiong1, HUANG Qiduan2,3, LI Daliang4,LU Yongshu5, GENG Baorong1, CHEN Youling1, HUANG zhen1*
(1. Fujian Key Laboratory of Developmental and Neural Biology/College of Life Science, Fujian Normal University,
Fuzhou, Fujian350117, China; 2. Fujian Jianfeng Biotechnology Co. Ltd, Quanzhou, Fujian 362500, China;
3. Fujian Shidongwang Biotechnology Research and Development Center Co. Ltd, Quanzhou, Fujian362500, China
4. Southern Center for Biomedical Research, Fujian Normal University,Fuzhou, Fujian350117, China;
5. Tianfuying Agricultural Professional Cooperative, Nanping Fujian353602, China)
Abstract: Quasipaa spinosa is a typical breed of frog with medicinal and edible value in Fujian Province. At present, the breeding of Quasipaa spinosa has been gradually realized on a large scale, but the problems of diseases in the breeding process are increasing year by year with the increase of breeding density. Cataract is one of the common bacterial diseases of Quasipaa spinosa. In order to analyze the pathogenic bacteria of cataract and to prevent and treat the disease, the pathogenic bacteria were isolated, purified and identified from the organs of Quasipaa spinosa infected with cataract, and then the pathogenicity was determined by artificial infection. Finally, the sensitivity of this strain to 20 kinds of antibiotics was tested by using the inhibition zone method. The results of the artificial infection test showed that after the artificial infection, the bacteria isolated from Quasipaa spinosa infected with cataract could cause the symptoms of cataract in the normal frogs, and the pathogenic bacteria was identified as Proteus penneri by the 16S rDNA sequence analysis. The results of drug sensitive test showed that the strain was sensitive to chlorampenicol, Polymyxin B, ciprofloxacin, ofloxacin, norfloxacin, minocycline, neomycin, kanamycin, gentamicin, amikacin, cefoperazone, ceftriaxone, ceftazidime, cefuroxime, piperacillin, carbenicillin and ampicillin, while was resistant to many other drugs. This study indicated that Proteus penneri could cause the symptoms of cataract in Quasipaa spinosa, which would provide a theoretical basis for the diagnosis and prevention of cataract in the breeding process of Quasipaa spinosa.
Key words: Quasipaa spinosa; Cataract; Pathogenic bacteria; Proteus penneri; Drug sensitive test
棘胸蛙Quasipaa spinosa俗称石蛙、石鸡等,隶属于两栖纲无尾目蛙属,是我国特有的珍贵物种,在我国主要分布在福建、浙江、江西和湖南一带。由于棘胸蛙肉质鲜美,具有较高的营养价值,广受人们的喜爱,同时它在中医药学方面具有较高的药用价值,是近几年来福建和浙江地区蛙类养殖的主要品种之一。2020年以来,受新冠疫情影响,棘胸蛙一度被划为野生动物禁养,2020年5月28日《农业农村部、国家林业和草原局关于进一步规范蛙类保护管理的通知》颁布,文件中明确了养殖历史悠久、技术成熟的黑斑蛙、棘胸蛙、棘腹蛙、中国林蛙、黑龙江林蛙等品种按水生动物管理,可以进行人工饲养和食用,为整个棘胸蛙养殖行业发展明确方向。目前棘胸蛙的人工养殖技术已经日趋成熟,但是随着其养殖规模和密度的不断扩大,在养殖过程中常爆发细菌性的感染疾病,成为棘胸蛙养殖行业发展中面临的重大难题,因此解析棘胸蛙的病原菌对于疾病的治疗和预防有重要的意义。
烂皮病、歪头病、出血病及白内障是棘胸蛙养殖过程中较为常见的细菌性疾病。吕耀平等[1]从患烂皮病的棘胸蛙中分离出蜡样芽孢杆菌Bacillus cereus,并发现蜡样芽孢杆菌对棘胸蛙的肝、肺、舌和肌肉都造成了严重的损伤;王瑞君等[2]发现奇异变形杆菌Proteus vulgaris可使健康的棘胸蛙患烂皮病;宋婷婷等[3]从患病的棘胸蛙中分离出嗜水气单胞菌Aeromonas hydrophila经人工感染后发现该菌可使棘胸蛙的肝脏发生病变甚至可导致棘胸蛙发病死亡;李明等[4]从患有歪头病的棘胸蛙中分离出脑膜炎败血金黄杆菌Chryseobacterium meningosepticum,并发现通过注射该菌液或浸泡该菌液均可使棘胸蛙患病死亡;郑卫军等[5]发现鲍曼不动杆菌Acinetobacter baumannii可引起棘胸蛙患出血病并使其发病死亡;程晓云等[6]研究发现布氏柠檬酸杆菌Citrobacter braakii可引起棘胸蛙发生白内障的病症。
白内障病是棘胸蛙常见的细菌性疫病之一,表现为病蛙眼睑灰白,食欲减退,易死亡,并且有很强的传染性,给棘胸蛙的生产养殖造成极大的损失[6]。同时白内障病的病原菌存在多样性,不同的养殖环境下有不同的致病菌。本研究对福建省棘胸蛙养殖场爆发的患白内障病棘胸蛙进行采样,从病蛙的心、肝、脾、肌肉组织中分离到了1株病原菌,鉴定其为彭氏变形杆菌P.penneri,并通过人工感染试验确定该病原菌对棘胸蛙的致病性,最后对该菌株进行药敏试验,以期为患病棘胸蛙的治疗以及日常疾病的监测提供理论指导,降低棘胸蛙白内障的发生。
1 材料与方法
1.1 试验材料
患白内障病和健康的棘胸蛙均来自永定县某养殖场,病蛙平均体重为163 g,健康蛙平均体重为170 g。
1.2 试验方法
1.2.1 患病棘胸蛙剖检和组织病理学观察 取患病棘胸蛙的心、肝、脾、肌肉组织,用4%的PFA(多聚甲醛)溶液于4℃下將组织固定24 h。固定完成后,将样品放在30%、50%、70%的酒精中进行梯度脱水,之后试验样品可放在70%的酒精中保存于-20℃冰箱。开展包埋切片试验前,将样品从90%、100%酒精中进行梯度脱水,充分脱水后的组织经二甲苯透明和石蜡包埋,制备成为蜡块,之后进行石蜡切片,切片厚度为8 μm。经过伊红苏木精染色,中性树脂胶封片,在光学显微镜下观察组织形态特征并拍照。
1.2.2 患病棘胸蛙中病原菌的分离与纯化 对患病的棘胸蛙进行解剖,取心、肝、脾、肌肉组织将其研磨,取少许研磨液涂布于固体脑心浸液肉汤培养基中,在28℃恒温培养48 h,挑取单菌落进行纯化并培养,用于后续试验。
1.2.3 人工感染试验 将分离到的细菌液体脑心浸液肉汤培养基中,28℃下恒温振荡培养24 h,用0.45%的生理盐水对菌液进行稀释,取稀释后的菌液1 mL涂布于健康棘胸蛙的体表进行感染,同时设置无菌生理盐水对照组,每组健康棘胸蛙数量为5只,每天观察健康棘胸蛙的生命体征,观察白内障病征的出现。
1.2.4 病原菌的16S rDNA基因测序鉴定 对导致健康棘胸蛙出现白内障病征的病原菌进行扩大培养后,取1 mL菌液提取DNA,采用16S rDNA基因的通用引物[7]扩增基因片段,将扩增后的PCR产物送到测序公司进行测序。测序结果与NCBI数据库进行比对分析。
1.2.5 分离菌药敏试验 根据KB纸片扩散法[8],将分离到的致病菌置于脑心浸液液体培养基中,在28℃下震荡培养24 h,调整菌液浓度,涂布于固体培养基中,将药敏纸片放入其中,在28℃培养箱中倒置培养48 h,测量抑菌圈大小。
2 结果与分析
2.1 患白内障棘胸蛙组织剖检观察
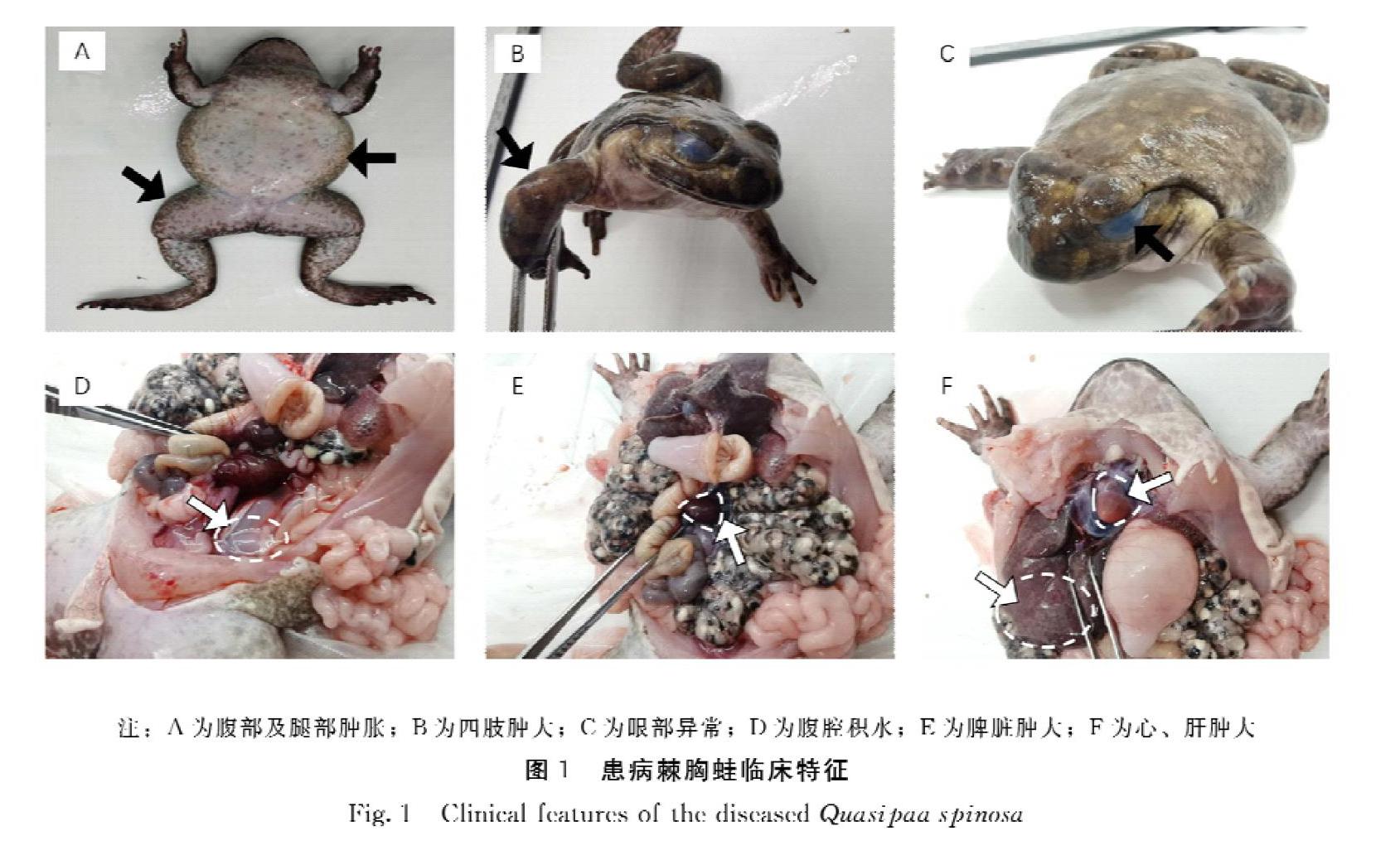
在外观上,患病的棘胸蛙与正常的棘胸蛙相比,其腹部膨胀(图1A),四肢肿大(图1B),眼部异常,其眼角膜呈现乳白色,有“白内障”的特征(图1C)。解剖后发现病蛙腹腔内部存在大量的积水(图1D)。对病蛙的各个脏器进行观察,发现脾脏肿大且呈现黑紫色(图1E);肝脏膨大并出现一定量的花斑;心脏与正常的棘胸蛙对比也出现肿大(图1F)。
2.2 患白内障病棘胸蛙主要脏器的病理学观察
对患病棘胸蛙的肌肉、肝脏、脾脏和心脏组织进行石蜡包埋切片和伊红苏木精(H&E)染色,结果如图2患病蛙的骨骼肌纤维严重变形,部分横纹消失,部分细胞发生溶解,呈条状或圆团状(图2A)。肝组织坏死严重,肝细胞排列松散,肿胀,无具体的细胞形态,甚至部分发生溶解(图2B)。脾脏出现淤血现象,胞间隙增大,淋巴细胞数量减少(图2C)。心肌细胞肿胀,细胞溶解或坏死,细胞间的空泡变性,部分肌间隙出现淤血(图2D)。
[7]JENSEN SIGMUND,BERGH OIVIND,ENGER OIVIND,et al.Use of PCRRFLP for genotyping 16S rRNA and characterizing bacteria cultured from halibut fry[J].Canadian journal of microbiology,2002,48(5):379-386.
[8]ANDREWS J M.BSAC standardized disc susceptibility testing method(version 4)[J].The Journal of antimicrobial chemotherapy,2005,56(1):60-76.
[9]刘子明,金晶,胡则辉,等.棘胸蛙白内障病原鉴定及病理组织观察[J].浙江农业学报,2018,30(11):1811-1818.
[10]雷雪平,耿毅,余泽辉,等.棘胸蛙脑膜炎败血伊丽莎白菌的分离鉴定及其感染的病理损伤[J].浙江农业学报,2018,30(3):371-377.
[11]廖冰洁,樊汶樵,周莉,等.一例棘腹蛙“白内障”的病原分离鉴定[J].湖北畜牧兽医,2014,35(8):8-11.
[12]SIWI'NSKA MAGORZATA,LEVINA EVGENIYA A,OVCHINNIKOVA OLGA G,et al.Classification of a Proteus penneri clinical isolate with a unique Oantigen structure to a new Proteus serogroup, O80[J].Carbohydrate research,2015,407:131-136.
[13]趙成坚.蛇源细菌的分离与鉴定[D].南宁:广西大学,2013.
[14]李剑静,植枝林,李军,等.猪源彭氏变形杆菌分离鉴定及药敏试验[J].中国畜禽种业,2016,12(9):72-74.
[15]曾晨爔,林茂,李忠琴,等.暹罗鳄食道结节病病原彭氏变形杆菌的分离与鉴定[J].微生物学通报,2019,46(7):1629-1635.
(责任编辑:陈文静)

