CDCP1基因重组慢病毒表达载体的构建及其对宫颈癌细胞增殖与迁移的影响
戚晓瑜, 王青霞, 李婉, 卢春
(南京医科大学病原微生物学系, 江苏 南京 211166)
CUB结构域包含蛋白1(CDCP1)是一种细胞表面糖蛋白[1],可以在造血干细胞、间充质干细胞和神经元祖细胞中表达[2]。研究表明,CDCP1在多种癌症细胞中高表达,包括黑色素瘤[3]、肺癌[4]、胰腺癌[5]、肾细胞癌[6]和前列腺癌[7]等。CDCP1的异常表达与细胞的存活、迁移和侵袭能力密切相关[4-5,8],但其在宫颈癌发病过程中是否发挥作用目前并不清楚。
宫颈癌为女性子宫颈部形成的恶性肿瘤,是继乳腺癌和结直肠癌后全球女性中第三大常见癌症,由宫颈癌诱发的死亡病例中有86%发生在发展中国家。目前针对宫颈癌的治疗方案主要包括手术治疗、放射治疗和化学治疗[9]。基因靶向治疗因为效果显著且不良反应小等优势,已成为目前研究的重点,其在宫颈癌治疗领域也具有广泛应用前景[10],因此,鉴定宫颈癌发病过程中异常表达的基因在宫颈癌的预防、诊断和治疗中具有重要的意义。
本研究中我们将CDCP1基因序列构建到pHAGE-CMV-MCS-IzsGreen慢病毒载体上,通过慢病毒包装系统获得pHAGE-CDCP1重组慢病毒,进一步感染宫颈癌HeLa细胞,获得稳定高表达CDCP1的HeLa细胞系,并通过CCK-8实验、划痕实验和Transwell细胞迁移实验评估CDCP1对宫颈癌细胞增殖和迁移能力的影响。
1 材料与方法
1.1 材料
1.1.1 细胞和质粒 慢病毒包装系统,包括包膜质粒pMD2.G、包装质粒psPAX2以及慢病毒表达载体pHAGE-CMV-MCS-IzsGreen均为本实验室保存。人胚肾上皮293 T细胞、人宫颈癌HeLa细胞和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVECs)购于中国科学院细胞库,均于37 ℃、5% CO2培养箱中培养,所用培养基为含有10%或20%的灭活胎牛血清(美国 Gibco公司)的DMEM(美国Hyclone公司),其中分别加入100 μg/mL链霉素和100 U/mL氨苄西林。
1.1.2 试剂 本研究中所用PCR引物由生工生物工程(上海)股份有限公司合成;总RNA 提取试剂盒、RNA反转录试剂盒、PCR高保真酶(phanta酶)、质粒小提试剂盒及凝胶纯化试剂盒购自南京诺唯赞科技有限公司;限制性内切酶购自日本TaKaRa公司;T4DNA连接酶、质粒转染试剂LipofectamineTM2000购自美国Thermo Scientific公司;感受态大肠埃希菌DH5α、琼脂粉购自南京擎科生物科技有限公司;CCK-8试剂为日本Dojindo公司产品;基因组DNA提取试剂盒购自天根生化科技有限公司;Flag标签抗体、辣根过氧化物酶标记的羊抗鼠IgG为南京巴傲得生物科技有限公司产品;Transwell小室购于Millipore公司。
1.2 方法
1.2.1 cDNA的提取 以HUVECs的cDNA作为CDCP1 编码序列PCR扩增的模板。首先,选取汇合度为90%的HUVECs,经胰蛋白酶消化后,使用含有20%血清的完全DMEM终止消化,离心后弃去上清,PBS重悬洗涤后再次离心弃去上清液,根据总RNA提取试剂盒说明书提取293 T细胞中的总RNA,之后根据RNA反转录试剂盒说明书获得HUVECs的cDNA。
1.2.2 PCR扩增CDCP1编码序列 在NCBI数据库中查找CDCP1 编码序列,并设计PCR引物。上游引物:5′-CGGAATTCATGGCCGGCCTGAACTGCG-GGGTCTCTATCGCACTGCTAGGGGTTCTGCTGCTGG-GT-3′(波浪线部分为保护性碱基,横线部分为EcoR Ⅰ限制性核酸内切酶识别序列),下游引物:5′-TT-GCGGCCGCTTATTTGTCGTCGTCATCCTTGTAGTCTT-CTGCTGGCTCCATGGGCTCCTGAGTGTTTTGCGGCCGC-TTATTTGTCGTCGTCATCCTTGTAGTCTTCTGCTGGC-TCCATGGGCTCCTGAGTGTT-3′(波浪线部分为保护性碱基,横线部分为NotⅠ限制性核酸内切酶识别序列,虚线部分为Flag标签序列)。以HUVECs cDNA为模版,PCR扩增CDCP1 编码序列,通过1%琼脂糖凝胶电泳确定PCR产物条带在位置正确后进行切胶回收纯化。
1.2.3 pHAGE-CDCP1质粒的构建及鉴定 将上述切胶回收产物和pHAGE-CMV-MCS-IzsGreen载体分别用EcoR Ⅰ和NotⅠ双酶切后,进行琼脂糖凝胶电泳分离、切胶回收纯化和T4DNA连接酶连接。将连接产物转化感受态大肠埃希菌DH5α,涂布于含有氨苄西林的LB平板,37 ℃倒置培养过夜。次日,随机挑选单克隆菌落于具有氨苄西林的LB培养基中振荡培养12~16 h,大量扩增并提取质粒。将提取的重组质粒进行双酶切鉴定,同时进行核酸序列测定,并利用ApE软件比对测序结果。
1.2.4 慢病毒pHAGE-CDCP1的包装及滴度测定 将293T细胞铺入直径为10 cm的细胞培养皿中,于37 ℃、5% CO2培养箱内培养过夜。次日当细胞汇合度为70%~80%时,利用LipofectamineTM2000将包装质粒psPAX2、包膜质粒 pMD2.G与目的质粒pHAGE-CDCP1共转染入293T细胞,转染8 h后更换10%新鲜完全培养基,收取48~72 h的病毒液,经0.45 μm滤器过滤,将包装好的重组慢病毒命名为Lv-CDCP1。同时包装对照质粒pHAGE的病毒液,命名为Lv-Mock。采用梯度稀释法稀释Lv-CDCP1和对照Lv-Mock病毒液,感染293T细胞。48 h 后于荧光显微镜下观察绿色荧光蛋白(GFP)的表达,并统计发出绿色荧光的细胞个数,采用以下公式计算病毒滴度: 病毒滴度(pfu/mL)=(绿色荧光细胞数/视野)×(视野数/孔数)×病毒稀释倍数÷病毒液体积。
1.2.5 重组慢病毒Lv-CDCP1感染宫颈癌HeLa细胞及免疫印迹检测Flag标签蛋白 将HeLa细胞铺入6孔板中,于37℃、5% CO2培养箱内培养过夜。第2天当细胞汇合度约50%时,用相同滴度的Lv-Mock和Lv-CDCP1慢病毒分别感染HeLa细胞,4~6 h后,将病毒液更换为10%完全培养基。感染48 h后,于荧光显微镜下观察GFP的表达。SDS-PAGE提取总蛋白,取100 μg样品进行电泳并转膜于PVDF膜上;5%脱脂牛奶封闭1 h后,将PVDF膜孵育在Flag(1 ∶1 000)和α-微管蛋白(1 ∶1 000)一抗中,4℃孵育过夜;次日,TBST洗膜3次,每次5 min,用相应二抗于37℃孵育1 h后,TBST 洗膜3次,每次5 min,于化学发光仪下显影。
1.2.6 CCK-8实验检测过表达CDCP1对HeLa细胞增殖的影响 分别将 Mock-HeLa与CDCP1-HeLa以每孔2 000个细胞接种于96孔板中(每组3个重复孔),共铺7块。分别在培养1、2、3、4、5、6及7 d后,取出一块检测。吸弃原培养基,向每孔加入100 μL纯DMEM和10 μL CCK-8液,于37℃、5% CO2培养箱孵育 1 h,以纯DMEM调零,波长为450 nm,用全自动酶标读数仪测出每孔D值。
1.2.7 划痕实验检测过表达CDCP1对HeLa细胞迁移的影响 取Mock-HeLa和CDCP1-HeLa两组细胞,接种于6孔板,每孔1×105个细胞,第2天长至70%~80%汇合度。用直径为5 mm的枪头垂直于背后的横线划痕,用PBS洗涤细胞3次,去除划下的细胞,加入无血清的培养基置于37℃、5% CO2培养箱中培养,24 h后取样拍照。
1.2.8 Transwell迁移实验检测过表达CDCP1对HeLa细胞迁移影响 取24孔板每孔加入500 μL细胞完全培养基,将Transwell小室置于24孔板中,小室内接种1×104个细胞,置于37℃、5% CO2培养箱培养,6 h与12 h将小室置于一个新的24孔板中,浸泡于甲醇中固定15 min,再用结晶紫染色15 min。用棉签搅去小室内部底部多余细胞,将小室倒置晾干后,于显微镜下拍摄小室上、下、左、右、中5个视野,进行计数统计。
1.3 统计学方法
应用统计学软件SPSS 19.0对数据进行,各组间差异比较采用两样本t检验,P<0.05为差异有统计学意义。所有实验结果均独立重复3次。
2 结果
2.1 重组质粒pHAGE-CDCP1的构建与鉴定
通过查询NCBI数据库,获得CDCP1 编码序列,根据该序列设计扩增引物,以HUVECs的cDNA为模板进行PCR扩增,1%琼脂糖凝胶电泳结果显示,扩增片段约2 549 bp且条带单一,与预期相符(图1A)。以EcoR Ⅰ和NotⅠ双酶切重组质粒pHAGE-CDCP1,酶切产物经1%琼脂糖凝胶电泳验证,在7 742 bp和2 549 bp处有明显条带(图1B),分别为慢病毒载体 pHAGE-CMV-MCS-IzsGreen和CDCP1基因。对重组质粒pHAGE-CDCP1进行核酸序列测定,经ApE软件比对,插入的CDCP1基因片段与理论序列一致(图1C),表明 pHAGE-CDCP1重组质粒构建成功。
2.2 重组慢病毒Lv-CDCP1的包装及感染
利用LipofectamineTM2000将包装质粒、包膜质粒与目的质粒pHAGE-CDCP1共转染293T细胞,获得重组慢病毒Lv-CDCP1及其对照病毒Lv-Mock。采用梯度稀释法测定病毒滴度后,以相同病毒滴度分别感染宫颈癌细胞HeLa。48 h后观察到约95%细胞表达GFP,且细胞状态良好(图2A)。蛋白免疫印迹实验结果表明,过表达CDCP1的宫颈癌HeLa细胞构建成功(图2B)。


A:CDCP1基因的扩增;B:重组质粒pHAGE-CDCP1的双酶切鉴定;C:重组质粒测序结果
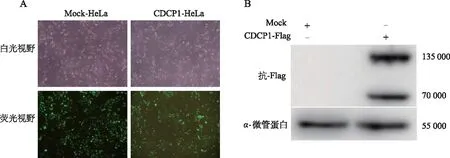
A:Lv-Mock和Lv-CDCP1分别感染HeLa细胞后GFP的表达(×200);B:蛋白印迹检测重组慢病毒CDCP1感染HeLa细胞后相关蛋白的表达
2.3 CCK-8实验检测过表达CDCP1基因对宫颈癌HeLa细胞增殖的影响
实验结果显示,从第4天起,CDCP1-HeLa组细胞在450 nm处D值明显高于Mock-HeLa组(P<0.05或P<0.01),见图3。提示宫颈癌HeLa细胞中过表达CDCP1可以促进细胞的增殖。
2.4 划痕实验检测重组慢病毒CDCP1感染对HeLa细胞迁移能力的影响
采用划痕实验法评价过表达CDCP1对HeLa细胞迁移的影响。结果显示,第24小时,感染CDCP1病毒液组的HeLa细胞的迁移能力显著高于对照病毒液感染组(P<0.01),见图4。结果提示,过表达CDCP1能够促进HeLa细胞的迁移。
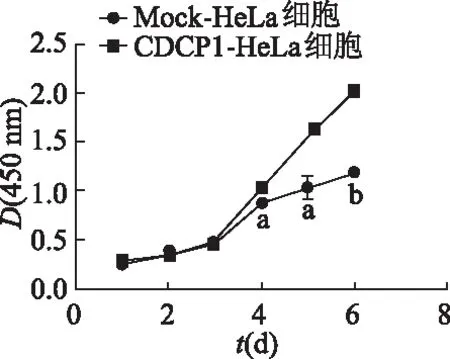
a: P<0.05, b: P<0.01,与Mock-HeLa细胞比较
2.5 Transwell迁移实验检测过表达CDCP1对HeLa细胞的迁移能力的影响
Transwell迁移实验结果显示,过表达CDCP1组的HeLa细胞,6 h和12 h迁移数量明显多于对照组(P<0.05或P<0.01),见图5。该结果表明CDCP1表达水平的提高可以增强HeLa细胞的迁移能力。

图4 划痕实验法检测过表达CDCP1对HeLa细胞迁移的影响(×200)
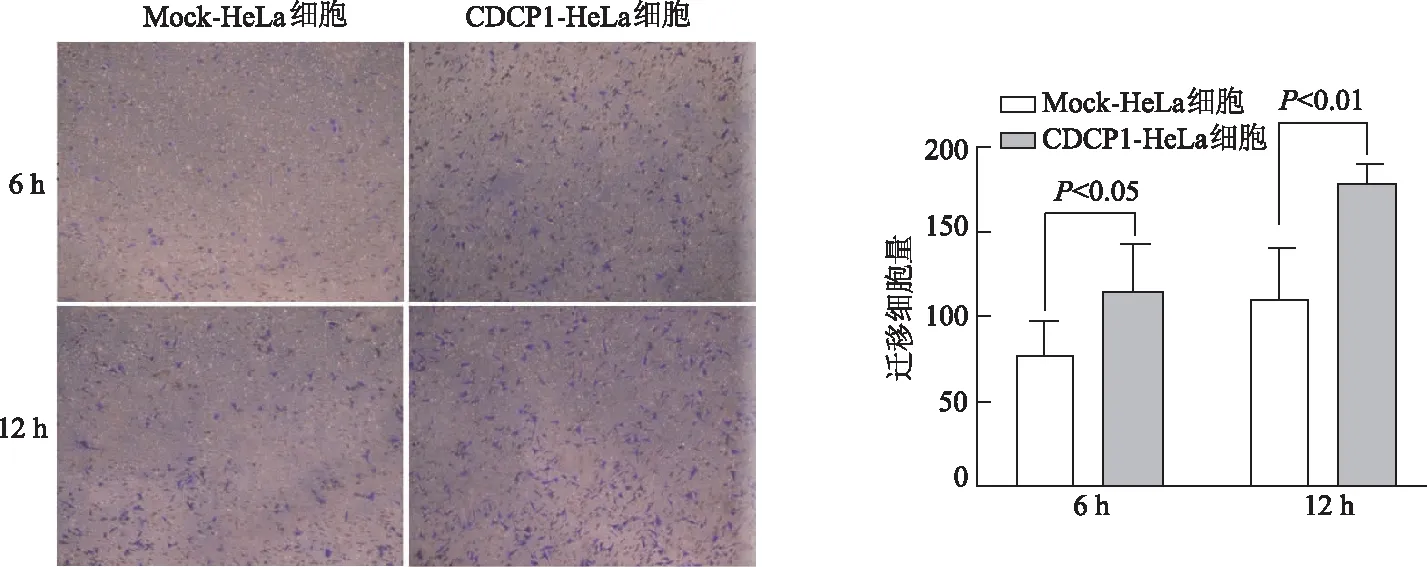
图5 Transwell迁移实验检测过表达CDCP1对HeLa细胞迁移的影响
3 讨论
作为女性第三大常发癌症,宫颈癌仍然是重要的全球性公共卫生问题[10]。大多数发展中国家妇女确诊宫颈癌时已是晚期,通常无法治疗或仅可进行姑息治疗,5年生存率很低[9]。因此,深入研究宫颈癌发生、发展过程中的分子机制,寻找差异表达的基因,可为宫颈癌诊断提供新的生物标志物,为其治疗提供特异性靶点。
CDCP1是包含836个氨基酸的蛋白质,由29个残基的氨基末端信号肽、细胞外结构域、跨膜结构域和含有150个氨基酸的细胞质结构域组成[11]。已有研究表明[12],表达异常的CDCP1与多种癌症有关,其在肾癌、肺腺癌中的异常表达与疾病进展指标(肿瘤分期,组织学分级和转移等)显著相关。CDCP1高表达可促进肿瘤淋巴转移和复发,CDCP1高表达患者总体生存率明显降低。
本研究中,我们通过分子克隆技术获得pHAGE-CDCP1重组质粒,经慢病毒包装系统获取Lv-CDCP1重组慢病毒并感染宫颈癌HeLa细胞,构建了稳定过表达CDCP1的HeLa细胞系。进一步功能学CCK-8结果表明,CDCP1可以促进宫颈癌HeLa细胞的增殖,细胞划痕实验和细胞迁移实验结果均显示,CDCP1可以促进宫颈癌HeLa细胞的迁移能力,提示CDCP1在宫颈癌中可能是促癌基因。本研究为后续进一步研究CDCP1在宫颈癌等相关肿瘤发生中的作用奠定了基础,有望为探索和治疗宫颈癌发生机制提供潜在的药物靶点。

