草果总黄酮的大孔吸附树脂纯化工艺优化研究
赵雨鸿 沈华 代双亿 蒲忠慧 谢子锐 肖灵 况敏 代敏
摘 要 目的:建立草果总黄酮的含量测定方法,并对其大孔吸附树脂纯化工艺进行优化。方法:采用高效液相色谱法测定草果中总黄酮的含量。色谱柱为Eclipse Plus C18,流动相为乙腈-1%醋酸水溶液(15 ∶ 85,V/V),柱温为40 ℃,流速为0.8 mL/min,检测波长为256 nm,进样量为10 μL。以吸附、解吸性能为考察指标,采用靜态吸附和解吸试验对6种大孔吸附树脂进行筛选,采用静态吸附和解吸动力学试验考察吸附和解吸时间。在单因素试验的基础上,以总黄酮含量(以芦丁计)为评价指标,以上样液质量浓度、上样液pH、乙醇体积分数及洗脱用量为考察因素,采用正交设计优化草果总黄酮的纯化工艺并进行验证试验。结果:芦丁检测质量浓度的线性范围为0.028~0.281 mg/mL(r=0.999 9);定量限为437.5 ng/mL,检测限为109.4 ng/mL;精密度、稳定性、重复性试验的RSD均小于2%,加样回收率为96.24%~99.75%(RSD<2%,n=6)。HPD450型大孔吸附树脂对草果总黄酮的静态吸附和解吸综合能力最适中,最佳静态吸附与解吸时间均为12 h。最优纯化工艺为上样质量浓度1.854 4 mg/mL,上样液pH 7,乙醇体积分数60%,乙醇洗脱用量8倍柱体积。验证试验显示,按最优工艺纯化后的草果总黄酮含量由纯化前的22.556 7 mg/g上升至57.728 2 mg/g,纯化倍数为2.56(n=3)。结论:所建含量测定方法灵敏度高、稳定性好,优化的纯化工艺稳定、可行,可用于草果总黄酮的纯化。
关键词 草果;总黄酮;含量测定;大孔吸附树脂;纯化工艺
ABSTRACT OBJECTIVE: To establish a method for the content determination of total flavonoids from Amomum tsao-ko, and to optimize the purification technology by macroporous resin. METHODS: The content of total flavonoids was measured by HPLC. The determination was performed on Eclipse Plus C18 column with mobile phase consisted of acetonitrile-1% acetic acid solution (15 ∶ 85, V/V) at the flow rate of 0.8 mL/min. The column temperature was 40 ℃, and the detection wavelength was set at 256 nm. The sample size was 10 μL. Taking the adsorption and desorption performance as indexes, 6 kinds of macroporous resins were screened out by static adsorption and desorption tests; adsorption and desorption time were investigated by static adsorption and desorption kinetics tests. Using the content of total flavonoids (calculated by rutin) as index, with sample concentration, sample pH, ethanol volume fraction and elution amount as factors, based on single factor test, orthogonal design was used to optimize the purification technology of total flavonoids from A. tsao-ko, and validation test was performed. RESULTS: The linear range of rutin were 0.028-0.281 mg/mL(r=0.999 9). The limit of quantification was 437.5 ng/mL and the limit of detection was 109.4 ng/mL. RSDs of precision, stability and reproducibility tests were all lower than 2%; the recoveries were 96.24%-99.75%(RSD<2%,n=6). The comprehensive capacity of adsorption and desorption of HPD450 macroporous resin was the most suitable, and the best static adsorption and desorption time both were 12 h. The optimal purification technology was 1.854 4 mg/mL, sample pH value was 7, ethanol volume fraction was 60%, the amount of ethanol elution was 8 times of the column volume. Vertification tests show that after optimized, the content of total flavonoids from A. tsao-ko increased from 22.556 7 mg/g to 57.728 2 mg/g. The purity of was 2.56 times higher than before purification. CONCLUSIONS: Established method is sensitive and stable for the content determination. Optimal purification technology is stable and feasible, which is suitable for purifieation of total flavonoids from A. tsao-ko.
KEYWORDS Amomum tsao-ko; Total flavonoids; Content determination; Macroporous absorption resin; Purification technology
草果为姜科豆蔻属多年生常绿丛生草本植物草果(Amomum tsao-ko Crevost et Lemaire)的干燥成熟果实,主产于我国云南、广西、贵州等地,越南亦有分布。该药性温、味辛,归脾、胃经,具有燥湿温中、截疟除痰的功效[1]。草果作为一种重要的药食两用植物,常被作为调味香料用于菜肴烹饪[2];临床将其用于治疗寒湿内阻、脘腹胀痛、痞满呕吐、胃功能紊乱、消化不良等症[1]。现代药理研究证实,草果具有调节胃肠道功能紊乱、抗氧化、抗菌、抗肿瘤、降脂和降糖等多种药理作用[3-8]。草果总黄酮作为草果的有效成分群,具有抗氧化、清除自由基的作用[9]。目前,草果总黄酮的提取多采用溶剂提取法,但该法溶剂用量大,所得总黄酮含量不高,还需进一步纯化[10]。此外,草果总黄酮的纯化主要采用聚酰胺树脂和大孔吸附树脂法[11-12]。其中,聚酰胺树脂纯化存在耗时长以及处理、使用过程中容易堵塞等缺点;而大孔吸附树脂可最大限度地对中药有效部位去粗取精,具有选择性好、吸附容量大、再生处理简便等优点,在黄酮类化合物的分离纯化中应用广泛[13-14]。为此,本研究在现有提取工艺[9]的基础上,以含量(以芦丁计)为指标,采用大孔吸附树脂法纯化草果总黄酮,并对其纯化工艺进行优化,以期为草果总黄酮提取物的纯化和制备提供参考。
1 材料
1.1 仪器
LC-1260型高效液相色谱(HPLC)仪(美国Agilent公司);ME204型分析天平(梅特勒-托利多仪器上海有限公司);BJ-750A型功能粉碎机(德清拜杰电器有限公司);PHS-320型酸度计(成都世纪方舟科技有限公司);THZ-320型台式恒温振荡器(上海精宏实验设备有限公司)。
1.2 药材与试剂
草果药材(批号:20180705)购自四川新绿色药业科技发展有限公司,经成都中医药大学药学院李敏教授鉴定为姜科豆蔻属草本植物草果(A. tsao-ko Crevost et Lemaire)的干燥成熟果实。
芦丁对照品(成都曼斯特生物科技有限公司,批号:MUST-19010210,纯度:99.47%);HPD100、HPD300、HPD450、AB-8、X-5、D101型大孔吸附树脂(中山东鸿化工有限公司,批号分别为20180618、20181126、20180626、20181005、20180716、20190111,粒径:0.3~1.25 mm);甲醇、乙腈均为色谱纯,其余试剂均为市售分析纯,水为蒸馏水。
2 方法与结果
2.1 草果总黄酮的提取
称取草果药材适量,粉碎,过二号筛。精密称取一定量的草果粉末,按照文献报道的提取工艺条件[9]:乙醇体积分数60%、料液比1 ∶ 50(g/mL,下同)、提取温度60 ℃、超声(功率:160 W,频率:60 kHz)提取60 min,趁热抽滤;重复上述操作2次,合并滤液,浓缩蒸干,即得草果总黄酮粗品(每1 g粗品相当于生药73.10 g)。
2.2 总黄酮含量测定
采用HPLC法测定草果总黄酮的含量。
2.2.1 芦丁对照品溶液的制备 精密称取芦丁对照品7.02 mg,置于5 mL量瓶中,加适量甲醇超声(功率:160 W,频率:60 kHz)使溶解,放冷,再用甲醇定容,摇匀,即得质量浓度为1.404 mg/mL的芦丁对照品溶液。
2.2.2 供试品溶液的制备 取“2.1”项下所得的草果总黄酮粗品适量,用甲醇溶解,置于5 mL量瓶中,再用甲醇定容,摇匀,即得供试品溶液。
2.2.3 阴性对照溶液的制备 按“2.1”项下方法制得不含草果药材的阴性样品,再用适量甲醇溶解并定容于5 mL量瓶中,即得阴性对照溶液。
2.2.4 色谱条件 色谱柱:Eclipse Plus C18(150 mm×3.0 mm,2.7 μm);流動相:乙腈-1%醋酸水溶液(15 ∶ 85, V/V);柱温:40 ℃;流速:0.8 mL/min;检测波长:256 nm;进样量:10 μL。
2.2.5 专属性 取“2.2.1”项下对照品溶液以甲醇稀释至质量浓度为0.158 mg/mL,另取“2.2.2”“2.2.3”项下供试品溶液和阴性对照溶液各适量,按“2.2.4”项下色谱条件进样测定,记录色谱图。结果,在该色谱条件下,芦丁的分离度良好,保留时间约为5.95 min,阴性对照对测定无干扰,色谱图详见图1。
2.2.6 标准曲线的绘制 分别精密吸取“2.2.1”项下芦丁对照品溶液0.1、0.2、0.4、0.6、0.8、1 mL,分别置于不同的5 mL棕色量瓶中,加甲醇定容,摇匀,得质量浓度分别为0.028、0.056、0.112、0.168、0.225、0.281 mg/mL的系列标准溶液,经0.45 μm微孔滤膜滤过后,取续滤液10 μL,按“2.2.4”项下色谱条件进样分析,记录色谱图。以芦丁质量浓度(x,mg/mL)为横坐标、峰面积(y)为纵坐标进行线性回归,得回归方程y=7 468.1x-60.438(r=0.999 9)。结果表明,芦丁检测质量浓度的线性范围为0.028~0.281 mg/mL。
2.2.7 定量限与检测限 精密吸取“2.2.6”项下质量浓度为0.112 mg/mL的芦丁对照品标准溶液适量,以甲醇倍比稀释,按“2.2.4”项下色谱条件进样分析,分别以信噪比10 ∶ 1、3 ∶ 1计算定量限与检测限。结果,定量限和检测限分别为437.5、109.4 ng/mL。
2.2.8 精密度试验 精密吸取“2.2.6”项下质量浓度为0.112 mg/mL的芦丁对照品标准溶液适量,按“2.2.4”项下色谱条件连续测定6次,记录峰面积。结果,芦丁峰面积的RSD为1.85%(n=6),表明仪器精密度良好。
2.2.9 重复性试验 取草果总黄酮粗品粉末,共6份,按“2.2.2”项下方法制备供试品溶液,再按“2.2.4”项下色谱条件连续进样测定6次,记录峰面积,根据回归方程计算供试品溶液中总黄酮的质量浓度。结果,供试品溶液中总黄酮的平均质量浓度为0.032 3 mg/mL,RSD为0.60%(n=6),表明本法重复性良好。
2.2.10 稳定性试验 取同一供试品溶液,分别于室温下放置0、2、4、6、8、10 h时按“2.2.4”项下色谱条件进样分析,记录峰面积。结果,芦丁峰面积的RSD为0.79%(n=6),表明供试品溶液在室温放置10 h内稳定。
2.2.11 加样回收率试验 取已知含量的草果总黄酮粗品粉末,分别按已知含量的50%、100%、150%加入0.056 mg/mL芦丁对照品标准溶液,按“2.2.2”项下方法制备低、中、高质量浓度供试品溶液,再按“2.2.4”项下色谱条件进样分析,记录峰面积并计算加样回收率,每质量浓度平行操作6次。结果,低、中、高质量浓度供试品溶液的加样回收率分别为96.24%、99.75%、98.13%(平均加样回收率为98.04%),RSD分别为1.83%、1.76%、1.78%(n=6)。
2.2.12 草果总黄酮含量测定 取草果总黄酮粗品或纯化后样品粉末适量,按“2.2.2”项下方法制备供试品溶液,经0.45 μm微孔滤膜滤过后,取续滤液10 μL,再按“2.2.4”项下色谱条件进样分析,并根据回归方程计算溶液中总黄酮的质量浓度,并换算为含量(mg/g)。
2.3 大孔吸附树脂类型的筛选
2.3.1 静态吸附与解吸试验 参照文献方法[15-16]对6种大孔吸附树脂(HPD100、HPD300、HPD450、AB-8、X-5、D101)进行预处理,并采用静态吸附与解吸法[17-18]筛选纯化草果总黄酮的最佳树脂类型。
精密称取6种经预处理的大孔吸附树脂各1.0 g,平行3份,分别置于50 mL具塞磨口三角瓶中,然后分别加入草果总黄酮水溶液(“2.1”项下所得粗品用水稀释而得,按“2.2”项下方法测得质量浓度为0.463 6 mg/mL;下同)20 mL,于25 ℃恒温振荡器中振摇吸附24 h,充分吸附后,抽滤,将滤液蒸干后用甲醇定容至10 mL,即得吸附液。取上述吸附已达饱和并经洗净、滤干的树脂,加入75%乙醇20 mL,于25 ℃恒温振荡器中振摇解吸24 h,充分解吸后,抽滤,将滤液蒸干后用甲醇定容至10 mL,即得解吸液。分别吸取上述吸附液和解吸液各1.0 mL,经0.45 μm微孔滤膜滤过后,取续滤液适量,按“2.2.4”项下色谱条件进样分析,再按“2.2.12”项下方法计算各溶液中总黄酮的含量,并根据公式①~④计算6种大孔吸附树脂对草果总黄酮的比吸附量、吸附率以及比解吸量、解吸率:
式中,m为树脂质量(g),c0为上样液中总黄酮的质量浓度(mg/mL),V0为上样液的体积(mL),c1为吸附液中总黄酮的质量浓度(mg/mL),V1为吸附液体积(mL),c2为乙醇洗脱液中总黄酮的质量浓度(mg/mL),V2为乙醇洗脱液体积(mL)。静态吸附和解吸试验结果见表1。
由表1可见,6种大孔吸附树脂的吸附率由高到低依次为HPD100>AB-8>HPD300>HPD450>D101>X-5;解吸率依次为HPD450>X-5>AB-8>HPD100>HPD300>D101。尽管HPD100型树脂的吸附率最高,但解吸率相对较低;而HPD450型树脂的解吸率最高,且吸附率居中。综合考虑,选择HPD450型大孔吸附树脂作进一步考察。
2.3.2 静态吸附和解吸动力学考察 精密称取经预处理的HPD450型大孔吸附树脂2.0 g,平行3份,分别置于50 mL磨口锥形瓶中,分别加入质量浓度为0.927 2 mg/mL的草果总黄酮水溶液40 mL,于25 ℃恒温振荡器中振摇,分别于1、2、4、8、12、24 h时吸取上清液4 mL,浓缩蒸干后用甲醇定容至2 mL,即得吸附液。取吸附24 h后的大孔吸附树脂,用水洗净并滤干,加入75%乙醇40 mL,于25 ℃的恒温振荡器中振摇解吸,分别于1、2、4、8、12、24 h时吸取上清液4 mL,浓缩蒸干后用甲醇定容至2 mL,即得解吸液。分別吸取上述各个时间点的吸附液和解吸液1 mL,经0.45 μm微孔滤膜滤过后,取续滤液适量,按“2.2.4”项下色谱条件进样分析,按“2.2.12”项下方法计算各溶液中总黄酮的含量,再按“2.3.1”项下方法计算比吸附量和比解吸量。分别以比吸附量和比解吸量(mg/g)为纵坐标、时间(h)为横坐标,绘制HPD450型大孔吸附树脂的静态吸附和解吸动力学曲线,结果详见图2。
由图2A可见,在静态吸附过程中,HPD450型大孔吸附树脂的比吸附量在1~12 h内呈上升趋势,12 h后则吸附饱和;由图2B可见,在静态解吸过程中,HPD450型大孔吸附树脂的比解吸量在1~12 h内波动明显,而12 h后基本达到平衡。为此,本研究选择最佳静态吸附与解吸时间均为12 h。
2.4 草果总黄酮纯化工艺优化的单因素试验
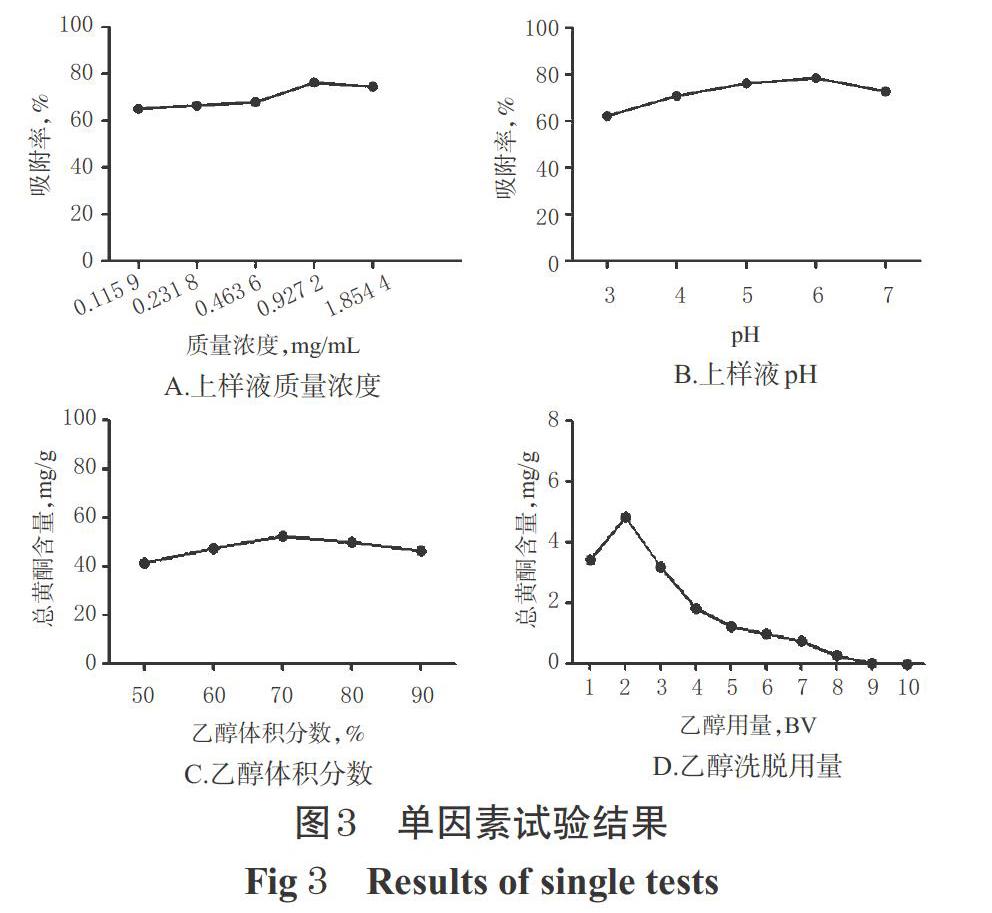
2.4.1 上样液质量浓度 精密量取5份经预处理的HPD450型大孔吸附树脂15 mL,湿法装于径高比约1 ∶ 13的玻璃柱(直径:1.5 cm、高:20 cm,下同)中,分别加入pH为6、质量浓度分别为0.115 9、0.231 8、0.463 6、0.927 2、1.854 4 mg/mL的草果总黄酮水溶液20 mL,吸附12 h后,放出吸附液,并用适量水洗脱至流出液无色。将吸附液和水洗脱液合并,浓缩蒸干后,用甲醇定容至2 mL,吸取1 mL,经0.45 μm微孔滤膜滤过后,取续滤液适量,按“2.2.4”项下色谱条件进样分析,按“2.2.12”项下方法计算各溶液中总黄酮的含量,再按“2.3.1”项下公式②计算吸附率。结果,当质量浓度≤0.927 2 mg/mL时,吸附率有随上样液质量浓度增加而上升的趋势;但当质量浓度>0.927 2 mg/mL时,吸附率不再受上样液质量浓度增加的影响,反而还略有下降,结果详见图3A。综合考虑,选择0.927 2 mg/mL为上样液的最佳质量浓度。
2.4.2 上样液pH 精密量取5份经预处理的HPD450型大孔吸附树脂15 mL,置于玻璃柱中,分别加入pH为3、4、5、6、7(pH经1 mol/L盐酸溶液或1 mol/L氢氧化钠溶液调节)的0.927 2 mg/mL草果总黄酮水溶液20 mL,吸附12 h后,放出吸附液,并用适量水洗脱至流出液无色。将吸附液和水洗脱液合并,浓缩蒸干后,用甲醇定容至2 mL,吸取1 mL,经0.45 μm微孔滤膜滤过后,取续滤液适量,按“2.2.4”项下色谱条件进样分析,按“2.2.12”项下方法计算各溶液中总黄酮的含量,再按“2.3.1”项下公式②计算吸附率。结果,当上样液pH为3~6时,吸附率有随pH升高而上升的趋势;但当pH>6时,吸附率反而有所降低,结果详见图3B。综合考虑,选择pH 6为上样液的最佳pH。
2.4.3 乙醇体积分数 精密量取5份经预处理的HPD450型大孔吸附树脂15 mL,置于玻璃柱中,分别加入pH为6的0.927 2 mg/mL草果总黄酮水溶液20 mL,吸附12 h,放出吸附液,并用适量水洗脱至流出液无色后,分别用体积分数为50%、60%、70%、80%、90%的乙醇进行动态解吸。将醇洗脱液浓缩蒸干,用甲醇定容至2 mL,吸取1 mL,经0.45 μm微孔滤膜滤过后,取续滤液适量,按“2.2.4”项下色谱条件进样分析,按“2.2.12”项下方法计算各溶液中总黄酮的含量。结果,当乙醇体积分数为50%~70%时,大孔吸附树脂洗脱下来的总黄酮含量有随乙醇体积分数升高而上升的趋势;而当乙醇体积分数>70%时,总黄酮含量反而有所降低,这可能与乙醇体积分数越高,其洗脱下来的杂质也越多有关,结果详见图3C。综合考虑,选择70%为乙醇洗脱的最佳体积分数。
2.4.4 乙醇洗脱用量 精密量取5份经预处理的HPD450型大孔吸附树脂15 mL,置于玻璃柱中,分别加入pH为6的0.927 2 mg/mL草果总黄酮水溶液20 mL,吸附12 h,放出吸附液,并用适量水洗脱至流出液无色后,再用70%乙醇以1倍柱体积(BV)/h的速度洗脱,分段收集醇洗脱液,每1 BV收集1份,洗脱液浓缩蒸干,用甲醇定容至2 mL,吸取1 mL,经0.45 μm微孔滤膜滤过后,取续滤液适量,按“2.2.4”项下色谱条件进样分析,按“2.2.12”项下方法计算每BV洗脱液中的总黄酮含量。结果,在第9个BV的洗脱液中几乎没有总黄酮,提示此时洗脱基本完成,结果详见图3D。综合考虑,选择9 BV为最佳乙醇洗脱用量。
2.5 草果总黄酮纯化工艺优化的正交试验
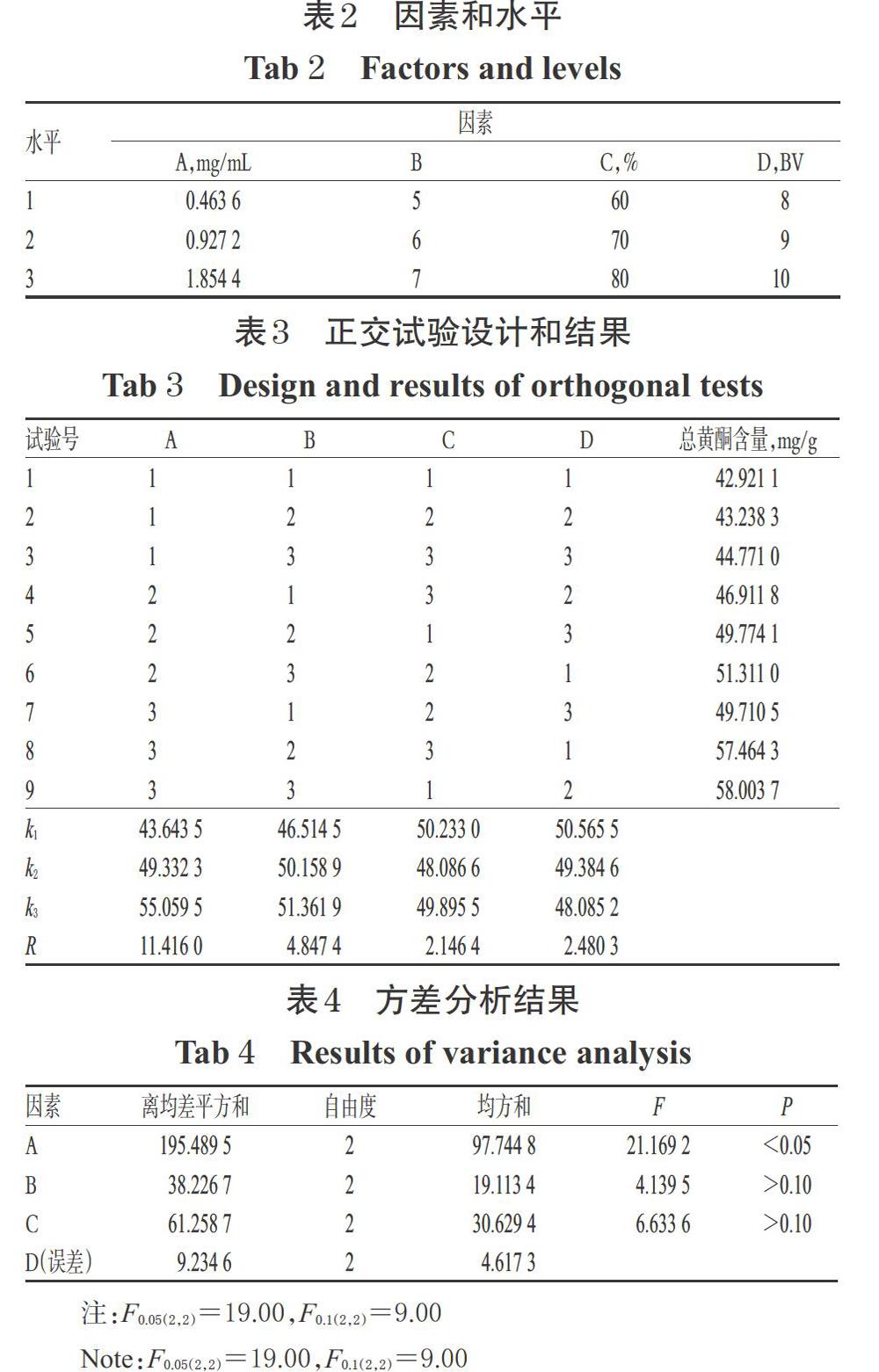
根据单因素试验结果,以上样液质量浓度(A)、上样液pH(B)、乙醇体积分数(C)、乙醇洗脱用量(D)为考察因素,以总黄酮含量为指标,采用L9(34)表设计4因素3水平的正交试验。因素和水平详见表2,正交试验设计和结果详见表3,方差分析结果见表4。
由表3可见,各因素对总黄酮含量的影响大小依次为A>B>D>C,最优方案为A3B3C1D1。由表4可见,因素A对工艺有显著影响(P<0.05);B、C对工艺无显著影响(P>0.05);因素D因离均差平方和最小,故被作为误差估计项。综合以上结果,最终确定HPD450型大孔吸附树脂纯化草果总黄酮的最佳工艺条件为A3B3C1D1,即上样液质量浓度1.854 4 mg/mL,上样液pH 7,乙醇体积分数60%,乙醇洗脱用量8 BV。
2.6 验证试验
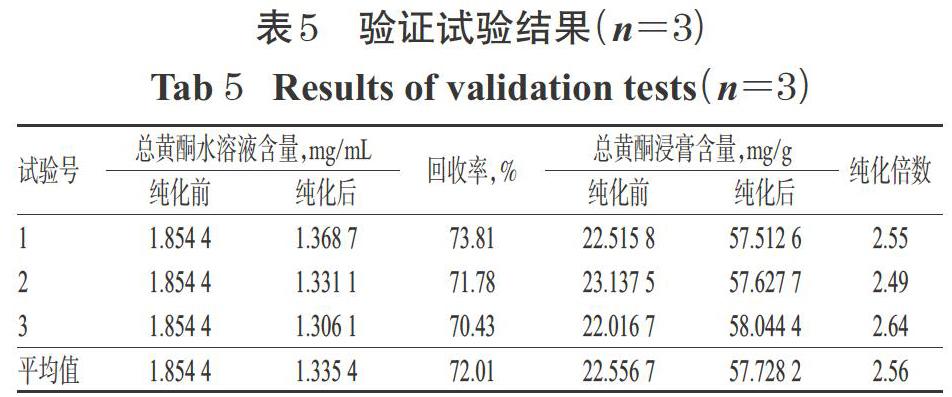
按“2.5”项下最佳纯化工艺平行操作3次,进行验证试验:精密量取经预处理的HPD450型大孔吸附树脂300 mL,湿法装柱,加入pH为7、质量浓度为1.854 4 mg/mL的草果总黄酮水溶液400 mL,吸附12 h,放出吸附液,并用适量水洗脱至流出液无色后,再用8 BV 60%乙醇进行洗脱,收集醇洗脱液,浓缩蒸干,用甲醇定容至10 mL,吸取1 mL,经0.45 μm微孔滤膜滤过后,取续滤液适量,按“2.2.4”项下色谱条件进样分析,再按“2.2.12”项下方法计算总黄酮含量。同时,取纯化前后的黄酮水溶液10 mL,置于蒸发皿中蒸干至恒质量,以适量甲醇溶解后,同法测定两种浸膏中的总黄酮含量。结果,纯化后,总黄酮水溶液中的总黄酮平均含量由纯化前1.854 4 mg/mL降至1.335 4 mg/mL,平均回收率为72.01%;总黄酮浸膏中的总黄酮平均含量由纯化前22.556 7 mg/g升至57.728 2 mg/g,纯化倍数为2.56,结果详见表5。
3 讨论
草果是药食两用中药材大宗品种之一,作为香料的用量远大于药用,挥发油是其作为香料主要成分之一,2015年版《中国药典》(一部)也把测定挥发油含量作为评价草果品质的重要指标[1]。为更好地发挥草果药食两用的功效,很有必要对其非挥发性成分进行研究。黄酮作为草果中一类重要的非挥发性成分,具有抗氧化、清除自由基的活性[9]。有学者对草果总黄酮进行了提取,但含量不高(24.2 mg/g)[9],且目前尚未见草果总黄酮纯化工艺优化的相关报道,故本课题组开展了相关研究。
目前,药材中黄酮含量的测定方法主要包括紫外分光光度法[19]、HPLC法[20-21]、毛细管电泳法[22]等。其中,HPLC法具有操作簡便、高效、快速的特点,现已被广泛应用于黄酮的定量分析中[20-21]。黄酮类化合物的分离多采用大孔吸附树脂和聚酰胺树脂。与后者相比,大孔吸附树脂具有吸附容量大、选择性好、再生简便、价格低廉等优点,在黄酮类化合物的分离纯化中应用广泛[13-14]。基于此,本研究以草果总黄酮含量为指标,以HPLC法作为定量分析手段,对大孔吸附树脂的纯化工艺进行优化。
本研究选用了非极性(HPD100、HPD300、X-5、D101型)、弱极性(AB-8型)以及极性(HPD450型)大孔吸附树脂,初步考察了不同类型树脂对草果总黄酮的富集效果。结果显示,极性树脂HPD450型树脂对草果总黄酮的静态吸附和解吸综合能力最适中,与该类成分极性特征对应。本研究在预试验基础上,对上样液质量浓度、pH以及乙醇体积分数、用量进行了单因素试验,并在单因素试验的基础上结合正交试验对HPD450型大孔吸附树脂纯化草果总黄酮的工艺条件进行了筛选。结果,草果总黄酮纯化的最佳工艺条件为上样液质量浓度1.854 4 mg/mL,上样液pH 7,水洗除杂后再用8 BV 60%乙醇进行洗脱。值得注意的是,笔者在试验过程中发现上样液质量浓度对纯化的影响最为显著,且正交试验优化所得最佳质量浓度(1.854 4 mg/mL)与单因素筛选质量浓度(0.927 2 mg/mL)相差较大,为避免试验误差,笔者曾尝试将质量浓度升至3.708 8 mg/mL,但发现上样液中总黄酮呈过饱合,其溶解性大大降低,严重影响了纯化效果。此外笔者还发现,经50%、90%乙醇洗脱后,草果总黄酮的含量较低;而经60%~80%乙醇洗脱后,总黄酮的含量相对较高,这可能与草果总黄酮极性与60%~80%乙醇更接近有关。验证试验结果显示,纯化后,总黄酮水溶液中的总黄酮平均含量由1.854 4 mg/mL降至1.335 4 mg/mL,回收率为72.01%;总黄酮浸膏中的总黄酮平均含量由纯化前22.556 7 mg/g升至57.728 2 mg/g,纯化倍数为2.56,且3次验证试验中总黄酮含量分别为57.512 6、57.627 7、58.044 4 mg/mL,可见优化后的纯化工艺稳定,并可有效提高总黄酮的含量。
综上所述,本研究所建含量测定方法灵敏度高、稳定性好;优化的总黄酮纯化工艺稳定、可行。然而,在单因素筛选过程中,草果总黄酮水溶液上样后,经水洗脱虽可除去大部分水溶性杂质,但本研究并未对水洗脱部位及水洗用量进行考察,可能会造成黄酮类成分的流失。因此,笔者将在后续研究中对此进行探讨,并深入研究草果总黄酮的药理、药效作用,为草果总黄酮的深入开发和应用提供参考依据。
参考文献
[ 1 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2015年版.北京:中国医药科技出版社,2015:239.
[ 2 ] 徐昭玺.百种调料类香料类药用植物栽培[M].北京:中国农业出版社,2002:243.
[ 3 ] ZHANG TT,LU CL,JIANG JG. Antioxidant and anti-tumour evaluation of compounds identified from fruit of Amomum tsao-ko Crevost et Lemaire[J]. J Funct Foods,2015.DOI:10.1016/j.jff.2015.08.005.
[ 4 ] 张琪,杨扬.草果挥发油对肝癌H22荷瘤小鼠的抑瘤作用[J].武汉大学学报(理学版),2015,61(2):179-182.
[ 5 ] 彭美芳.草果抑菌活性物质作用机制及分离纯化的研究[D].海口:海南大学,2014.
[ 6 ] 万红焱.滇产草果中有效成分的提取工艺及抗氧化活性研究[D].昆明:昆明理工大学,2015.
[ 7 ] 储恬予,赵敏吉,于纹婧,等.草果精油对采后草莓保鲜效果及抗氧化活性的研究[J].农产品加工,2019,5(5):24-27.
[ 8 ] ZHANG TT,LU CL,JIANG JG. Bioactivity evaluation of ingredients identified from the fruits of Amomum tsao-ko Crevost et Lemaire,a Chinese spice[J]. Food Funct,2014,5(8):1747-1754.
[ 9 ] 袁園,张潇,陈碧琼,等.草果总黄酮的提取及DPPH自由基清除活性研究[J].食品研究与开发,2017,38(15):63-67.
[10] 王婉愉,李姣,张晓峰,等.响应面法优化乙醇提取草果黄酮的工艺研究[J].中国调味品,2018,43(10):164-169.
[11] 同禄禄,李梦耀,许小英,等. HPD-100大孔吸附树脂与聚酰胺吸附黄酮的对比研究[J]. 应用化工,2016,45(5):929-932、936.
[12] 娄晓晶,李波,陆婷婷,等.大孔树脂纯化铁皮石斛叶中总黄酮的研究[J].中国现代应用药学,2019,36(11):1338-1342.
[13] REN J,ZHENG Y,LIN Z,et al. Macroporous resin purification and characterization of flavonoids from Platycladus orientalis(L.)Franco and their effects on macrophage inflammatory response[J]. Food Funct,2017,8(1):86-95.
[14] WAN P,SHENG Z,HAN Q,et al. Enrichment and purification of total flavonoids from Flos Populi extracts with macroporous resins and evaluation of antioxidant activities in vitro[J]. J Chromatogr B Analyt Technol Biomed Life Sci,2014. DOI:10.1016/j.jchromb.2013.11.033.
[15] 蒲忠慧,王力,高宇,等.大孔吸附树脂纯化富集川芎总生物碱的工艺[J].食品研究与开发,2017,38(11):85-91.
[16] 李园园,李洪娟,侯桂革,等.大孔吸附树脂纯化紫菀总黄酮工艺[J].中成药,2019,41(3):501-505.
[17] 冯宇,刘雪梅,罗伟生,等.大孔树脂纯化荔枝核总黄酮工艺研究[J].中草药,2019,50(9):2087-2093.
[18] 李俊,刘孟源,方升平,等.大孔吸附树脂分离纯化油橄榄叶总黄酮[J]. 中成药,2019,41(2):261-265.
[19] 李金洲,陈勇,陈子隽,等. 水石榴中总黄酮的提取工艺优化[J].中国药房,2019,30(20):2807-2812.
[20] 杨棣华,梁文能.高效液相色谱法测定不同产地蒲黄药材中3种黄酮苷元含量[J].中国药业,2019,28(19):27-29.
[21] 孟新涛,魏健,许铭强,等.高效液相色谱法测定不同品种石榴皮中5种类黄酮的含量[J].新疆农业科学,2019,56(9):1659-1667.
[22] 惠阳,仲佳明,武晓雪,等.高良姜黄酮类成分的毛细管电泳特征图谱分析[J].中药材,2017,40(1):69-72.
(收稿日期:2019-07-18 修回日期:2020-01-02)
(编辑:张元媛)

