糖苷水解酶GH97家族成员PspAG97A的催化机制分析
张小敏, 陈飞云, 张学成, 何 超, 肖亚中
(安徽大学 生命科学学院 现代生物制造安徽省重点实验室 安徽省微生物与生物催化工程技术研究中心, 合肥 230601)
糖苷水解酶(Glycoside hydrolases, GH, EC3.2.1)普遍分布于自然界的所有生物体中,可以依照内切或外切的方式水解各种含糖化合物的糖苷键,包括淀粉、纤维素、寡糖以及小分子糖苷等碳水化合物,也可以通过修饰相应的糖类化合物来发挥功能[1-3]。至今,已知的糖苷水解酶有2000多种,而根据氨基酸的序列比对和分析,将其分成156个不同的家族[4]。依据糖苷水解酶催化底物分子异头碳构型是否发生转变,将其分为反转和保留两种催化类型:在反转催化机制中,酶分子上的一对羧基分别作为广义酸和广义碱[5-7]。糖苷键上的氧亲核攻击广义酸上的氢;而广义碱协助水分子亲核攻击底物糖分子的异头碳,糖基从糖链上解离出来,这种催化方式使水解出的单糖产物构型发生了转变[5,8]。在保留催化机制中,酶分子上的一对羧基分别充当广义酸碱和亲核体,采用双置换机制,经过糖基化和去糖基化两步反应保持水解产物的构型不变完成催化反应[6]。
一般来说,每个家族的内部成员被认为具有共同的祖先和相似的三级结构,催化残基和催化机制是保守的[9-12]。然而GH97家族的不同寻常之处在于它同时拥有“反转”和“保留”两种催化类型的成员[13-15]。目前为止,GH97家族共有1369条基因序列,其中有1334条来自于细菌,18条则来源于古生菌,有一条基因序列属于真核生物,剩下的16条基因序列暂未被分类。在GH97家族中,结构和功能研究比较深入的仅有α-葡萄糖苷酶BtGH97a、α-半乳糖苷酶BtGH97b、β-L-阿拉伯糖吡喃糖苷/α-D-吡喃半乳糖苷双功能酶BT3661[16]和α-葡萄糖苷酶PspAG97A。其中BtGH97a和BtGH97b均来自多形拟杆菌属Bacteroidesthetaiotaomicron,拥有(β/α)8桶状折叠结构域和相似的催化结构域,却执行不同的催化机制[5,13,17]。在已解析的GH97家族成员分子结构中,活性中心都包含一个保守的钙离子,该钙离子在催化过程中发挥重要作用[13,18]。目前,GH97家族成员被深入研究的相对较少,该家族的祖先执行何种机制,“反转”和“保留”两种催化类型如何分化仍不清楚。
课题组前期从来源于北极海洋的假交替单胞菌(Pseudoalteromonassp.K8)中克隆一新型α-葡萄糖苷水解酶基因,在大肠杆菌活性表达得到重组酶PspAG97A,根据序列相似性分析将其归入GH97家族[19-20]。研究表明PspAG97A是一种嗜盐酶,具有耐受高浓度NaCl的能力,在1 mol/L NaCl/KCl存在下具有最大酶活性[19]。有文献报道,GH31家族中来源于嗜盐古菌Haloquadratumwalsbyi的α-葡萄糖苷水解酶MalH在3 mol/L NaCl或3~4 mol/L KCl存在下,酶活性值最高[21]。卤素离子依赖是古生物适应古地球高盐环境的一种体现,推测PspAG97A可能代表GH97家族中较为古老的成员。我们解析了PspAG97A的晶体结构,发现其活性中心除了保守的钙离子,还包含一个氯离子。该氯离子帮助稳定部分底物结合位点[20]。从序列和结构预测PspAG97A属于反转催化类型,但尚未实验验证。本文拟对PspAG97A进行研究,通过HPLC分析鉴定PspAG97A的催化类型,扩充人们对于GH97家族成员的认识;利用理性设计、定点突变、酶学性质分析等研究方法初步探究GH97家族两种催化机制类型的转化可能性,为GH97家族酶两种催化类型进化关系的研究奠定基础。
1 材料与方法
1.1 实验材料与试剂
pET22b (+)-PspAG97A重组质粒为本实验室在前期研究工作中所构建,其中PspAG97A基因(GenBank登录号:AMB20699.1)克隆自北极海洋细菌交替假单胞菌属(Pseudoalteromonassp.)中产α-葡萄糖苷水解酶的阳性菌P.haloplankitsK8。大肠杆菌E.coliBL21(DE3)由本实验室保存。MutanBEST Kit试剂盒购于TaKaRa公司;引物的合成与测序由通用生物系统(安徽)有限公司完成;DNA凝胶回收试剂盒、DNA质粒抽提试剂盒购于康宁生命科学(吴江)有限公司;pNPαG购于阿拉丁上海生物股份科技有限公司;其他化学试剂均为国产或进口分析纯。
1.2 PspAG97A突变体的构建与鉴定
根据PspAG97A的基因序列设计4对定点突变引物。以pET22b (+)-PspAG97A重组质粒为模板,分别采用表1中的引物克隆构建出目标突变酶基因。PCR扩增条件如下:98 ℃预变性5 min;98 ℃变性10 s,54 ℃退火15 s,72 ℃延伸7 min 30 s,30个循环数;72 ℃延伸10 min。根据TaKaRa MutanBEST Kit点突变试剂盒的原理,将导入变异点的引物进行PCR反应后,对PCR产物进行末端平滑化和5′磷酸化处理,再使用连接试剂Ligation Solution I进行环化反应,转化至大肠杆菌E.coliBL21(DE3),氨苄青霉素抗性筛选转化子并由通用生物系统(安徽)有限公司测序验证,获得目标突变菌体:G407D、E377G/G407D、G407D/E456G、E377G/G407D/E456G、G407E、E377G/G407E、G407E/E456G、E377G/G407E/E456G。
1.3 重组酶和突变酶的诱导表达和纯化
将重组酶PspAG97A及突变酶表达菌分别接种至5 mL含100 μg/mL氨苄青霉素的液体LB培养基中,37 ℃、200 r/min过夜培养。按1%(V/V)的接种量将过夜培养的菌液转接至400 mL含100 μg/mL氨苄青霉素的液体LB培养基中,37 ℃、200 r/min培养至OD600达到0.6~0.8时,加入IPTG至终浓度为0.2 mmol/L,16 ℃、200 r/min诱导表达18 h。并于4 ℃、8000 r/min条件下离心10 min收集菌体。
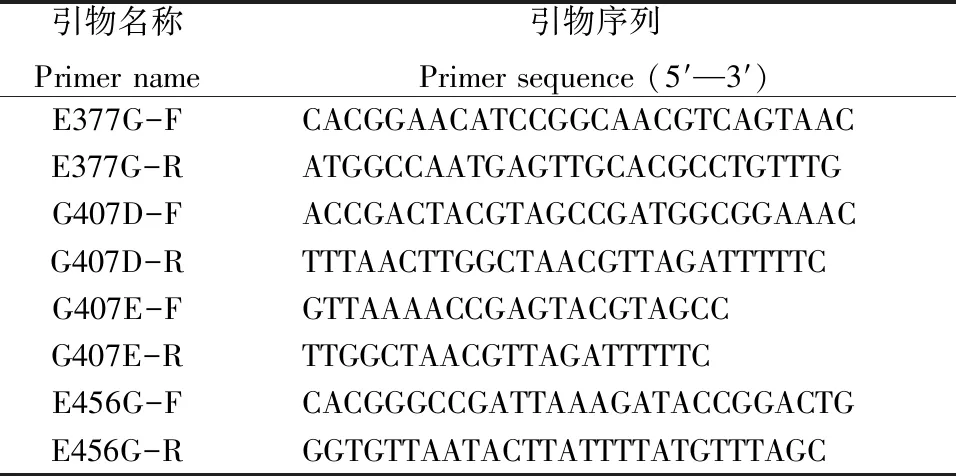
表1 构建突变菌所用引物
用20 mmol/L Tris,500 mmol/L NaCl,pH 8.5的缓冲液洗涤并重悬菌体,采用高压均质机对菌体细胞进行破碎处理,4 ℃、10 000 r/min,离心30 min收集上清液,即为重组酶与突变酶的粗酶液。
采用Ni2+-NTA亲和层析进行蛋白纯化,含200 mmol/L咪唑的洗脱液洗脱获得纯化后的目标蛋白。通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)和Bradford法分别检测重组蛋白的纯度和含量。
1.4 PspAG97A水解产物异头碳构型分析
通过HPLC检测重组酶PspAG97A水解pNPαG产物的异头形式。酶反应在1/15 mol/L Na2HPO4-KH2PO4,0.8 mol/L NaCl,pH 7.5条件下进行,酶浓度为45.6 μmol/L,在35 ℃水浴锅中分别孵育不同时间后立即冰浴终止反应。将等分反应液(10 μL)上样至正相色谱柱TSK-gel Amide 80(4.6×250 mm, Tosoh, Tokyo, Japan),用80%乙腈/水洗脱,流速为1 mL/min,室温下分析反应混合物随时间的变化。使用蒸发光散射检测器(Agilent 1260 Infinity ELSD,美国)检测产物。通过D-葡萄糖作为标准品确认α-和β-葡萄糖的保留时间。
1.5 PspAG97A与突变酶的酶活力大小测定
将缓冲液(1/15 mol/L Na2HPO4-KH2PO4,pH 7.5)、100 μL 25 mmol/LpNPαG、100 μL 4 mol/L NaCl在35 ℃条件下预热5 min后分别加入10 μL酶液,反应10 min后加入500 μL 1 mol/L Na2CO3终止反应。实验组做3个平行实验,以缓冲液代替酶液做空白对照并调零,测定405 nm下的光吸收值。3个平行样品取平均值后,依据公式计算酶活性和比酶活。一个酶活力单位(U)定义为:一定反应条件下,每分钟催化水解底物产生1 μmoLpNP所需要的酶量。
2 结果与分析
2.1 PspAG97A突变位点的选择
使用Pymol软件对PspAG97A与GH97家族中执行保留类型催化机制的α-半乳糖苷水解酶BtGH97b进行结构比对分析,仿照保留类型的催化装置,将PspAG97A催化中心的Gly407突变为对应于BtGH97b中的Asp415,使其作为亲核体。而Glu480作为广义酸碱,先后执行酸催化和碱催化的作用。并将PspAG97A的催化碱基Glu377、Glu456突变为侧链较短的Gly使其不影响G407D的侧链伸展,构建G407D单点突变体、E377G/G407D两点突变体、G407D/E456G两点突变体和E377G/G407D/E456G三点突变体。此外,也尝试将Gly407突变为有亲核基团的Glu,并与催化碱基Glu377、Glu456组合突变,构建G407E单点突变体、E377G/G407E两点突变体、G407E/E456G两点突变体、E377G/G407E/E456G三点突变体。
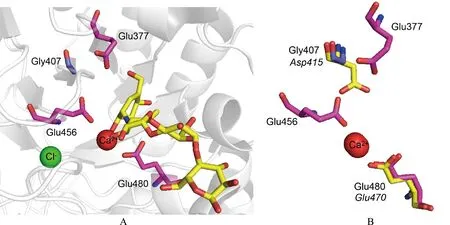
A为PspAG97A-阿卡波糖复合物的催化活性中心示意图(黄色代表阿卡波糖,品红色代表催化氨基酸,蓝色代表催化中心的氨基酸);B为PapAG97A与BtGH97b催化中心叠加示意图(正体字母代表PspAG97A的催化氨基酸,斜体字母代表BtGH97b的催化氨基酸)
图1 PspAG97A结构示意图
Figure 1 The structure diagram of PspAG97A
2.2 重组酶与突变酶的分离纯化
将表达重组酶PspAG97A和构建获得的8种突变酶(G407D、E377G/G407D、G407D/E456G、E377G/G407D/E456G、G407E、E377G/G407E、G407E/E456G、E377G/G407E/E456G)的菌株进行培养,诱导表达产物经Ni2+-NTA亲和层析纯化后的SDS-PAGE检测结果如图2所示,重组酶与突变酶的分子量约为75.6 ku,大小与理论分子质量相符。
2.3 PspAG97A催化机制的分析
α-葡萄糖苷酶PspAG97A以外切的方式水解底物非还原末端,断开α-1, 4-糖苷键释放出一分子葡萄糖。通过HPLC方法检测了PspAG97A降解pNPαG降解产物的异头碳形式。如图3所示,在反应初始阶段,酶催化底物pNPαG水解产生β-D-葡萄糖。随着酶反应时间的增加,α型:β型葡萄糖的比例逐渐增大。这表明PspAG97A酶催化底物水解出的产物为β-D-葡萄糖,随后发生变旋现象,β-D-葡萄糖的量开始下降,并产生α-D-葡萄糖直至两者达到动态平衡。此时旋光度不再变化,β-D-葡萄糖较稳定,约占64%,α-D-葡萄糖较不稳定,约占36%。证明水解的反应在异头位置进行立体化学反转,PspAG97A是一种反转型糖苷水解酶。三维结构已经暗示其活性结构中心的E480作为催化酸提供质子,E377和E456充当催化碱协助水分子亲核攻击异头碳,使水解产物单糖的构型发生了改变。
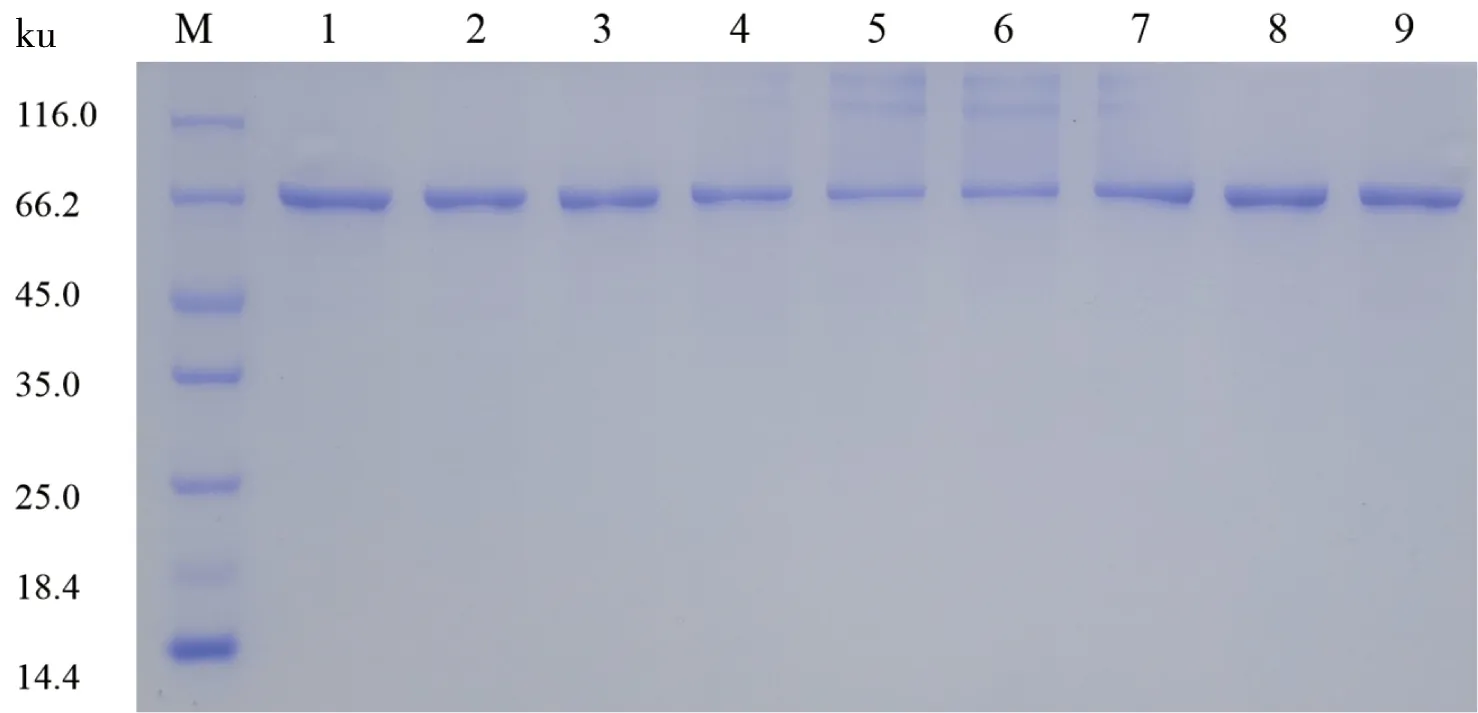
M: Marker; 泳道1:重组酶PspAG97A; 泳道2~9分别表示突变酶G407D、E377G/G407D、G407D/E456G、E377G/G407D/E456G、G407E、E377G/G407E、G407E/E456G、E377G/G407E/E456G
图2 重组酶与突变酶的SDS-PAGE检测分析
Figure 2 SDS-PAGE analysis of wild type and mutant enzymes
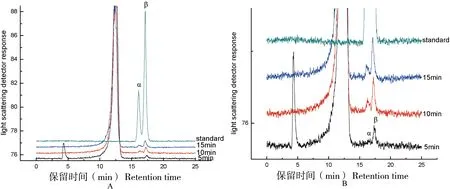
A为PspAG97A水解产物的HPLC分析,PspAG97A与pNPαG在1/15 mol/L Na2HPO4-KH2PO4,0.8 mol/L NaCl,pH 7.5条件下,于35 ℃分别反应5、10和15 min。立即冰浴终止并进行HPLC检测分析。B为A图的放大图
图3 PspAG97A水解产物异头碳构型分析
Figure 3 Analysis of anomeric carbon configuration of PspAG97A hydrolysate
2.4 PspAG97A与突变酶的酶活力分析
以pNPαG作为底物,重组酶PspAG97A作为对照,测定突变酶水解底物的活力大小,并运用统计软件SPSS 17.0对数据进行多重比较分析。从图4可以看出,突变酶的比活力与重组酶相比降低了100倍以上,差异显著(P<0.05)。而突变酶之间相比,差异不显著(P>0.05)。这说明位于活性中心的位点Glu377、Gly407和Glu456对于稳定催化口袋的空间构象起到关键作用,而催化碱残基Glu377、Glu456直接参与水解反应,对于这些位点的突变破坏了酶与底物的结合。
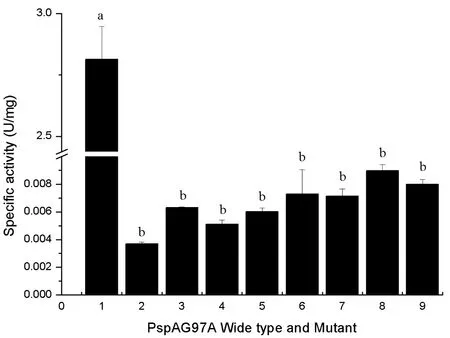
1~9分别为:PspAG97A、G407D、E377G/G407D、G407D/E456G、E377G/G407D/E456G、G407E、E377G/G407E、G407E/E456G、E377G/G407E/E456G;图中不同字母表示有显著性差异( P < 0. 05)
图4 PspAG97A与催化类型转变相关突变体的酶活力大小
Figure 4 Enzyme activity of PspAG97A and catalytic type transformation related mutants
3 讨论与结论
糖苷水解酶通过两种机制催化底物水解,导致切割位点立体化学的整体保留或倒置,该机制在每个家族是保守的,GH1、GH13、GH22、GH31等家族均采用保留机制,而GH6、GH15、GH37、GH45等家族则采用反转机制[22-23]。GH97家族是一个极为特殊的家族,已被证明其包含两个亚家族,分别对应“反转”和“保留”催化类型,这显示出GH97家族在催化机制上的进化分歧[5]。本文首次对GH97家族成员PspAG97A的催化机制进行分析,通过Ni2+-NTA亲和层析的方法纯化获得PspAG97A蛋白,采用高效液相色谱检测其催化产物的异头碳构型,结果说明PspAG97A执行反转催化机制,这与催化基团的空间分布相吻合。
为了对GH97家族两种催化机制的进化关系进行研究,本文拟根据PspAG97A晶体结构,理性改造PspAG97A的催化类型,使其从反转转变为保留。有研究报道,T4噬菌体溶菌酶催化中心的广义碱Thr26被His取代后,可实现反转机制到保留机制的转变,并赋予该酶转糖苷活性[24]。本文通过将PspAG97A分别与同一家族成员BtGH97a(反转类型)和BtGH97b(保留类型)进行结构比对,仿照保留类型的催化装置对相关位点E377、G407、E456进行单点和组合突变,尝试改造催化机制。结果显示这些突变体比酶活均降低100倍以上,说明这些位点突变后,大幅度降低了酶对底物的结合能力和催化活力。目前的检测方法还不足以鉴定出这些突变体的催化类型是否已发生转变。在催化中心,E377和E456作为催化碱,直接参与水解反应。而G407位于催化碱附近,对于维持活性口袋的空间构象起到至关重要的作用。
后续对于PspAG97A催化机制的进一步改造,一方面,将通过使用超高效液相色谱(UPLC)以增加产物分离的灵敏度和分离度,或通过核磁共振一维谱1H NMR并优化条件尝试对现有突变体进行分析。另一方面,PspAG97A保留类型催化机制的实现可能需要更小的活性中心底物结合口袋,需对其进行更为精细化的位点设计。课题组已经通过生物信息学的方法得到一条GH97家族进化上的祖先序列。此外GH97家族存在一些特殊序列,不含与保留或反转类型对应的特征基序。这些信息为我们研究GH97家族催化机制的分化提供了新的线索和思路,对于GH97家族两种催化类型机制的进化关系的研究工作具有十分重要的意义和价值。

