皂苷-蛋白质相互作用的研究进展
朱力杰 许杨杨 徐清莹 尹 鹏 刘 贺
(渤海大学食品科学与工程学院 生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心 辽宁锦州 121013)
皂苷是自然界中一类结构较为复杂的低聚糖苷类化合物,通常由疏水性皂苷苷元和亲水性糖配基(如葡萄糖、鼠李糖、半乳糖等)组成,二者通过糖苷键相连[1]。根据皂苷水解后的苷元结构,可分为三萜皂苷与甾体皂苷两大类。随着现代技术的发展,皂苷的许多活性功能被发现,如抗肿瘤、抗炎、免疫调节、抗病毒、保肝等[2-4]。此外,它们还兼具乳化性、起泡性等能够对食品的加工特性产生影响的性质。皂苷无论是作为功能性成分还是表面活性剂都具有很大的发展前景。
蛋白质是一类由氨基酸以脱水缩合的方式组成的多肽链,经过盘曲折叠形成具有空间结构的化合物,其作为生物体最基本的结构和功能单元几乎参与了所有的生命活动。氨基酸的种类、数量、排列顺序以及肽键的空间构象决定着蛋白质的结构,而蛋白质的结构又决定着蛋白质的功能。目前有研究表明,蛋白质与配体的相互作用会改变蛋白质的结构,进而影响蛋白质的功能特性,比如乳化性、凝胶性、起泡性等。
食品是多成分共存的复杂体系,而多成分之间会发生相互作用,进而影响食品的营养和品质,如蛋白质与多酚能以共价键和非共价键发生复合反应,形成的蛋白质-多酚复合物对食品体系的感官性质、安全性以及营养性等产生影响[5-6],因此研究食品组分之间的相互作用对探明食品体系的形成机制至关重要。皂苷和蛋白质都具有两亲性结构并表现出较好的表面活性,已被广泛应用于食品、药品和化妆品等领域。皂苷与蛋白质能以氢键、疏水相互作用、范德华力等方式进行结合,一方面会对蛋白质的结构和功能产生影响,如将人参皂苷Rg1 加入到胰蛋白酶中,会造成蛋白质中α-螺旋和无规则卷曲的含量下降,β-折叠和β-转角的含量增加,改变胰蛋白酶的二级结构[7];另一方面是皂苷要表达活性时需要与蛋白质相结合,如人血清白蛋白(Human serum albumin,HSA)可以提升人参皂苷Rh2 的水溶性,从而更好地发挥皂苷的各种活性[8]。Wojciechowski 等[9]也发现添加一定浓度的溶菌酶可以提高皂树皂苷的发泡性。
本文主要概述皂苷与蛋白质的相互作用机制、影响因素及分析方法,以及二者相互作用对蛋白质结构和功能特性的影响。
1 皂苷与蛋白质相互作用机理及影响因素
蛋白质与小分子之间的相互作用主要涉及共价键和非共价键。皂苷和蛋白质都是两亲性分子,就目前研究而言,皂苷与蛋白质的相互作用主要为非共价相互作用(疏水相互作用、氢键、范德华力以及离子相互作用等)。2011 年,林玉龙等[10]利用荧光光谱、紫外光谱技术研究了齐墩果酸(Oleanolic acid,OA)与牛血清白蛋白(Bovine serum albumin,BSA)的相互作用及热力学特征,结果发现OA 能使BSA 的内源荧光猝灭,并以动态猝灭为主,通过热力学参数的焓变△H>0、熵变△S>0 得出二者的相互作用主要为疏水相互作用。Böttcher 等[11]则通过荧光光谱法测定了皂树皂苷(Quillaja Saponin,QS)与β-乳球蛋白的相互作用,发现猝灭类型为静态猝灭,QS 可能通过氢键或疏水相互作用与β-乳球蛋白的两个结合位点发生非共价结合,界面剪切流变学和膨胀流变学也证实了这一相互作用。Liang 等[12]于2018 年综合多种分析技术(荧光光谱法、圆二色谱、分子对接技术)研究了柴胡皂苷D 与HSA 之间的相互作用力,结果通过Stern-Volmer 方程可知猝灭类型主要是静态猝灭,通过热力学参数(焓变△H、熵变△S 及吉布斯自由能△G 为负值)分析发现,氢键和范德华力是柴胡皂苷D 与HSA 之间的主要作用力。Reichert 等[13-15]研究了酪蛋白酸钠、豌豆蛋白与QS 的相互作用,认为疏水相互作用是主要作用力。
目前,对皂苷与蛋白质相互作用影响因素的研究主要包括蛋白质种类与浓度、皂苷结构与浓度、皂苷/蛋白质比例以及温度、pH 值、盐离子浓度等外界因素。早在1995 年,Tanaka 等[16]通过对茶籽皂苷与盐溶性蛋白的相互作用研究,发现茶籽皂苷具有抑制盐溶性蛋白热变性的能力,随着皂苷浓度的增加,抑制蛋白聚集的程度越大。随后Makoto 等[17]通过CD 光谱图发现,大豆球蛋白、β-伴大豆球蛋白与大豆皂苷结合后的复合物对胰凝乳蛋白酶的敏感性表现为:大豆球蛋白>β-伴大豆球蛋白,其原因是两种蛋白质结构的修饰能力不同。到2001 年,Morton 等[18]通过建立一种酸性饮料絮状物(Acid beverage floc,ABF)模型发现,在酸性条件(pH=2)下,单独的甜菜糖蛋白和皂苷溶液无法构成ABF,只有二者进行复合并且蛋白质浓度较低时才能形成ABF,此时测定的皂苷-蛋白质复合物的浊度增加,饮料絮状体较多,原因是蛋白质(正电荷)与皂苷具有相反的电荷,导致了静电络合物的形成。2015 年起,Kezwon 等[19]研究了溶菌酶、β-乳球蛋白、β-酪蛋白对皂树皮皂苷(Quillaja bark saponin,QBS)界面张力的影响,发现造成皂苷界面张力不同的原因可能与蛋白质的特定结合位点有关,其可以选择性识别皂苷分子的糖或羧基。Hou 等[20]采用荧光光谱、紫外吸收光谱、同步荧光光谱和三维荧光光谱等技术,研究了齐墩果烷型三萜化合物与BSA 结合的亲和性。结果表明,皂苷与蛋白质结合亲和力的顺序为甘珀酸>甘草次酸>甘草甜素,其原因是结合过程中的相互作用力不同,甘珀酸与BSA 相互作用力主要为疏水相互作用,而甘草次酸、甘草甜素主要为氢键。Reicher 等[21]研究了酪蛋白酸钠、豌豆蛋白与QS 以不同比例形成的复合乳液,结果发现只有当酪蛋白酸钠与QS 的浓度比为0.1∶0.4 时形成的乳液粒径较大,可能是因为在此比例下二者存在拮抗作用且形成的复合物的界面活性较低,而豌豆蛋白与QS 的浓度比为2.0∶0.3、3.0∶0.2 和4.0∶0.1 时,乳液发生相分离并凝胶化,可能是因为蛋白质浓度的增加使得液滴之间的静电排斥力降低。Salminen 等[22]通过研究温度、pH 值、NaCl 浓度对QS 和酪蛋白酸钠相互作用的影响,发现复合物乳液(QS∶酪蛋白酸钠=2∶3,1∶4)在pH 为2,6,7时,NaCl<200 mmol/L 时的粒径较小且较稳定,表明疏水相互作用是主要作用力,而温度对其影响较小是因为酪蛋白酸钠对温度变化不敏感。Reicher 等[14]研究了酪蛋白、豌豆蛋白、菜籽卵磷脂、鸡蛋卵磷脂在不同pH 值条件下与QS 的相互作用,发现pH 值的变化会影响二者复合体系的凝聚状态及相互作用。因此,在研究皂苷与蛋白质相互作用方式时,需要考虑皂苷和蛋白质的具体结构,因为结构决定着二者相互结合的位点及作用力类型。此外还需要考虑二者发生反应的温度、pH 值、离子强度等环境条件。
2 皂苷与蛋白质相互作用对蛋白质结构和功能特性的影响
目前,关于皂苷与蛋白质相互作用对皂苷的影响研究较少,而对蛋白质的影响研究较多。蛋白质的结构可分为一级结构、二级结构、三级结构、四级结构,其中一级结构是基本结构,二级、三级、四级属于空间结构。图1 为蛋白质与皂苷相互作用的机理图[23-26],反映了二者相互作用带来的蛋白质结构变化。目前研究这一相互作用对蛋白质结构的影响主要集中在二级和三级结构上。蛋白质二级结构主要包括α-螺旋、β-折叠、β-转角和无规则卷曲,由骨架上的羰基和酰胺基团之间形成的氢键维持这些结构。1996 年Shingo 等[27]在BSA中添加大豆皂苷,通过热稳定性和蛋白酶消化性研究了BSA 与皂苷之间的相互作用,结果表明二者复合物的α-螺旋的含量在各温度下均高于单独BSA,并且也发现添加大豆皂苷可提高BSA 的热稳定性,降低BSA 对胰凝乳蛋白酶的敏感性。随后Makoto 等[28]于2007 年通过研究发现加入单体大豆皂苷I 后,蛋白酶抑制剂(Bowman-birk inhibitor,BBI)的CD 光谱图发生的改变为波长210 nm 处的负峰向左偏移,椭圆度变大,表明添加皂苷后BBI 结构的变化,而这种结构的改变也提高了胰蛋白酶与BBI 之间的亲和性,从而增强了BBI 对胰蛋白酶的抑制活性。桑尚源等[29]2016 年研究发现,在HSA 与大豆皂苷Ⅱ的浓度比例为1∶0.5、1∶2 和1∶4 时,HSA 的α-螺旋含量增加,β-折叠含量下降,其原因是大豆皂苷Ⅱ与HSA 的结合可能改变了HSA 的氢键骨架,导致HSA 的二级结构从β-折叠转变为α-螺旋。蛋白质三级结构是指整条肽链中全部氨基酸残基的相对空间位置,即肽链中所有原子在三维空间的排布位置。皂苷与蛋白质发生相互作用会导致蛋白质三级结构的变化,其相应的蛋白质固有荧光特性也会发生变化。Hu 等[30]利用甘草酸单铵(Monoammonium glycyrrhizinate,MAG)与BSA 进行复合反应,发现随着MAG 浓度的增加,BSA 的荧光强度降低,其发射波长向长波方向移动,表明色氨酸残基周围的极性增加,疏水性降低,猝灭类型可能为动态猝灭。Zhang 等[31]研究了人参皂苷Rg3 与HSA 之间的相互作用,发现蛋白质的荧光强度增加且发生蓝移,说明色氨酸处于更加疏水的环境中,蛋白质的结构更加紧密。

图1 皂苷与蛋白质相互作用[23-26]Fig.1 Interaction between saponin and protein[23-26]
皂苷与蛋白质的相互作用使得蛋白质的结构发生了改变,影响了蛋白质分子的表面性能,改变了蛋白质表面的亲水/疏水性,从而导致蛋白质功能特性的改变。蛋白质的功能特性是指食品体系在加工贮藏过程中发生的物理或化学变化,这种变化会直接影响食品的感官和品质特性。皂苷与蛋白质相互作用对蛋白质功能特性影响主要集中在蛋白质的乳化性、起泡性、凝胶性等。Xu 等[32]利用水解谷蛋白(Hydrolyzed rice glutelin,HRG)与QS 反应形成了水包油乳液,结果表明当HRG 与QS 浓度比为1∶1 时,二者形成的乳液在高盐(NaCl)、高温及低pH 值下的稳定性高于单独体系,其原因是添加QS 可提高HRG 的乳化稳定性,形成较厚的界面层,从而产生较强的空间排斥力以及较弱的静电斥力,减少乳液的絮凝。同样,在Defaria 等[33]研究中发现将QS 与β-乳球蛋白浓度比为1∶1 混合制备的乳液在pH 7~9,NaCl 浓度0~200 mmol/L 下较单一体系稳定,说明添加QS可以提高β-乳球蛋白的乳化稳定性。Reichert等[13-14]将QS 与豌豆蛋白质进行反应,因储能模量G′大于损耗模量G″证实了复合体系凝胶网络的存在,随着QS 浓度的增加,储能模量G′、损耗模量G″增加,蛋白质凝胶网络持水性增加,其原因是QS 使得疏水相互作用增强。刘雨阳等[34]成功构建了茶皂苷-小麦醇溶蛋白复合体系,并指出茶皂苷对小麦醇溶蛋白发泡性和泡沫稳定性的影响,结果表明皂苷可使蛋白质形成尺寸更小的泡沫,提高了复合体系的发泡能力和泡沫稳定性。
3 皂苷与蛋白质相互作用研究方法
3.1 圆二色谱
圆二色谱(Circular dichroism,CD)在结构生物学中已经被广泛应用了近半个世纪,主要用于测定溶液中蛋白质的二级结构和三级结构[35-36]。蛋白质是具有光学活性的分子,由于肽键和芳香氨基酸等生色基团的存在,可以产生CD 信号。当蛋白质与小分子发生作用后,可以判断小分子对蛋白质构象的影响及蛋白质三级结构的变化[37-41]。在研究皂苷与蛋白质相互作用时,由于CD 光谱的数据能最直观的反应蛋白质结构的变化,因此被广泛应用。
Yu 等[42]利用CD 研究了5 种三萜皂苷与胰脂肪酶(Pancreatic lipase,PL)的相互作用,结果表明茶皂苷(Tea saponin,TS)的加入对PL 二级结构没有影响,说明TS 通过对底物的竞争性抑制来抑制PL 活性;而OA、人参皂苷Ro(Ginsenoside Ro,Ro)、人参皂苷Rd(Ginsenoside Rd,Rd)、白桦脂醇(Betulin,Be)的加入使得PL 中的α-螺旋含量从37%降到了25%,β-转角含量从25%降到11%,说明皂苷Ro、Rd、OA 和Be 改变了PL 二级结构进而影响了PL 活性。Chen 等[43]利用CD 研究了柴胡皂苷C 与HSA 的相互作用,发现柴胡皂苷C 与HSA 结合会导致209 nm 处的波峰蓝移,并且使得蛋白质结构中α-螺旋和β-转角的含量增加了4.9%,β-折叠和无规则卷曲的含量减少了2.3%,说明柴胡皂苷C 的添加影响了蛋白质的结构,并引发了多肽的重排现象。Su 等[44]研究发现,绞股蓝皂苷能减少肠道胆固醇的吸收,起到降血脂的作用。原因是绞股蓝皂苷的添加使得猪胰脂肪酶结构中的α-螺旋含量减少,β-折叠含量增加,而猪胰脂肪酶的活性与α-螺旋的含量成正相关。
3.2 荧光光谱法
荧光光谱法(Fluorescent spectrometry,FS)被广泛应用于研究小分子与蛋白质相互作用[45]。分子的结构变化、成键情况、发光特性可以通过测定蛋白质的荧光参数反映出来,得到蛋白质与小分子相互作用的信息及蛋白质分子在各种环境中的构象变化[46],从而进一步阐明蛋白质结构与功能的关系。目前应用较广泛的FS 法有荧光猝灭法和同步荧光光谱法。FS 法可以反应蛋白质三级结构的变化,因操作简单、数据准确而被广泛应用。除上述两种方法外,荧光光谱法还包括荧光偏振、荧光增强等方法。
Yang 等[48]利用FS 法研究了齐墩果酸及其三萜皂苷衍生物(OA、LL-4、LL-2)与血清白蛋白(BSA、HSA)的疏水相互作用。通过Stern-Volmer方程分析处理数据后,发现荧光猝灭常数随温度的升高而减小,说明二者结合的猝灭机制为静态猝灭,而皂苷及其衍生物与蛋白质的结合顺序为LL-4>LL-2>OA 且存在唯一的结合位点。Zhou等[49]研究发现甘草次酸(Glycyrrhetinic acid,GEA)与BSA 之间的相互作用为非特异性疏水相互作用并通过Stern-Volmer 方程得知二者的猝灭机制为静态猝灭,由于图形偏向Y 轴时结合常数大于1。Chen 等[50]利用同步荧光光谱研究了人参皂苷(Rg1、Rb1、Re)与k-酪蛋白的相互作用,结果表明人参皂苷单体Rg1、Rb1 与蛋白质的荧光发射峰的峰位发生了轻微蓝移,而人参皂苷Re 发生了红移,说明皂苷使得蛋白质周围微环境的疏水性减弱,极性增加。
3.3 紫外-可见吸收光谱法
紫外可见吸收光谱(UV-visible spectroscopy,UV-vis)是用来研究小分子与蛋白质相互作用的一种方法。由分子内电子的跃迁而产生,因物质结构不同,所以吸收光谱也不同[51-52]。在蛋白质中色氨酸、酪氨酸和苯丙氨酸残基的侧链基团和肽键对光存在吸收,由于氨基酸中生色基团不同而产生了不同的吸收光谱[53-54],因此通过观察小分子与蛋白质作用前、后紫外吸收光谱的变化,可以进一步了解分子间相互作用的机理、作用部位、作用程度等信息,从而进行定性定量分析。UV 常与FS 联用,利用二者的重叠光谱,按照非辐射能量转移理论计算皂苷与蛋白质相互作用的结合距离。此外,UV 吸收光谱的变化可以用于判断二者的猝灭类型。
刘媛等[55]研究了三七总皂苷中的两种单体皂苷R1、Rg1 与BSA 的相互作用,通过Lineweaver-Burk 双倒数方程曲线图可知,二者复合物的结合常数较小且BSA-R1 结合常数小于BSA-Rg1,说明二者结合相对较弱,结合力与皂苷成分也有关系。Cheng 等[56]利用紫外可见吸收光谱研究了OA与BSA 的相互作用,发现随着OA 含量的增加,二者复合体系的紫外吸收强度增加,其原因是OA与BSA 的结合导致了蛋白质中螺旋稳定性的下降,造成了蛋白质构象的变化。
3.4 傅里叶红外光谱法
蛋白质二级结构的维持主要依靠肽链上的C=O 以及酰胺-N-H 间形成的氢键,而傅里叶红外光谱(Fourier transform infrared spectroscopy,FTIR)对氢键又极其敏感,因此它可用来检测蛋白质与小分子之间是否发生相互作用[57-60]。FTIR 是一种无损检测技术,无需对蛋白质进行特殊标记,所以被广泛应用测定蛋白质结构变化,大多数情况下可以与CD 光谱联合进行分析。
Liu 等[61]利用傅立叶红外光谱法观察了三七总皂苷(Panax notoginseng saponins,TPNS)与HSA的形成过程,结果表明TPNS 能与蛋白质结构中的C=O、C-N 的基团发生亲水相互作用,而随着TPNS 浓度的增加,HSA 中的α-螺旋含量减少,β-折叠含量增加。Tang 等[62]研究发现GEA 可使HSA的酰胺Ⅰ带峰位从1656.40 cm-1移到1637.83 cm-1,通过对组分条带中积分面积计算得知,二者结合后,蛋白质的α-螺旋含量从50.93%减少到24.73%,β-转角含量从23.6%增加到25.27%并且伴随着无规则卷曲结构(13.98%)的出现。
3.5 等温滴定量热法
等温滴定量热法(Isothermal titration calorimetry,ITC)是采用功率补偿的原理,在恒定温度下记录将反应物溶液加入到样品溶液中的热量变化的方法,是研究蛋白质与小分子相互作用的新型技术[63-67]。ITC 技术因测定的焓变△H、熵变△S 及吉布斯自由能△G 值可以很直观的反应配体与蛋白质相互作用的作用力类型,所以应用广泛。
Kayukawa 等[68]利用ITC 研究了QBS 与β-半乳糖苷酶之间的相互作用,结果表明加入皂苷后所测得蛋白质的焓变△H 由(-16300±395.7)J/mol 变为(-41580±1345)J/mol,熵变由(-2223.7±18)J/mol 变为(-300.81±22)J/mol,说明皂苷使得疏水相互作用降低,而吉布斯自由能由(-18523.7±320)J/mol 变为(-41279.19±1220)J/mol,说明QBS 与β-半乳糖苷酶的结合是自发性的且皂苷的加入促进了酶的活性。
3.6 核磁共振波谱法
在原子分辨率下,核磁共振能够观察到溶液中生物大分子三维结构[69],因此在研究蛋白质与小分子相互作用中被广泛应用[70-71]。通过核磁共振波谱(Nuclear magnetic resonance,NMR)可以获得的信息包括:蛋白质与小分子发生相互作用的机理、结构特征、结合强度以及二者复合物的空间结构和动力学参数[72]。随着NMR 技术的发展,可分析的蛋白质分子量可达50 ku,甚至82 ku[73]。然而由于在水溶液中要求蛋白质能够稳定存在,有较高溶解度,不聚合,不降解,所以核磁共振对蛋白质二级结构的分析存在一定的局限性。
Shimoyamda 等[74]利用NMR 研究了大豆皂苷和α-乳清蛋白的相互作用,通过计算与皂苷相连的甲基质子的弛豫时间,发现加入蛋白质后导致皂苷的弛豫时间降低,证明二者之间存在相互作用且这种作用会加速自旋晶格弛豫。
3.7 计算机模拟分子对接技术
分子对接(Molecular docking,MD)是利用受体与配体相互作用的“锁-钥原理”,将已知三维空间结构的配体放在受体活性位点附近,然后按照几何互补、能量互补以及化学环境互补的原则,实时评价配体与受体相互作用的好坏,从而找到二者结合时能量最低、结构最稳的构象[75-76]。随着计算机技术的发展,MD 被广泛应用与研究皂苷与蛋白质相互作用中。因无法考虑pH 值、离子强度等外界环境对相互作用的影响,因此需要与其它分析技术进行联用,以确定其正确性。
Sathishkumar 等[77]利用分子对接AutoDock 程序就3 种凋亡蛋白(BCL-2、BCL-XL、MCL-1)和12 种人参单体皂苷进行了对接研究,研究发现人参单体皂苷Rg1、Rg3、Rf 与BCL-2、BCL-XL、MCL-1 能以氢键、静电相互作用发生结合,这种结合降低了凋亡蛋白的表达,从而表明人参皂苷可用于治疗癌症。Tang 等[62]通过模拟分子对接技术(FlexX 对接软件)发现了GEA 与HSA 之间的相互作用,这种相互作用为疏水相互作用,原因是GEA 的甲基与HSA 亚结构域IIA 的疏水残基(Leu 219、Leu 238、Val 241、Val 216、Trp 214等)相邻。Khan 等[78]将5 种硫酸盐皂苷与脲酶之间进行分子对接,发现与蛋白质活性位点残基His之间存在氢键,而与活性位点残基Ala 170、Ala 279、Met 318、Leu 319 等之间存在氢键和疏水相互作用。
除上述方法之外,表面等离子共振(Surface plasmon resonance,SPR)、石英晶体微技术(Quartz crystal microtechnology,QCM)等方法也可用于研究蛋白质与皂苷的相互作用。不同相互作用的分析方法都能提供一些信息,然而,由于样品及仪器自身特点的限制,任何单一方法都无法得到全面解析其相互作用机制,因此需要综合使用。从表1可以看出,在研究皂苷与蛋白质相互作用的方法中,应用较为广泛的是FS、UV、MD 及CD。研究血清蛋白质(HSA、BSA)、人参皂苷的文献较多,因此在研究皂苷与蛋白质相互作用的时候,方法、样品种类都是制约其发展的主要原因,此原因可成为未来发展的方向。
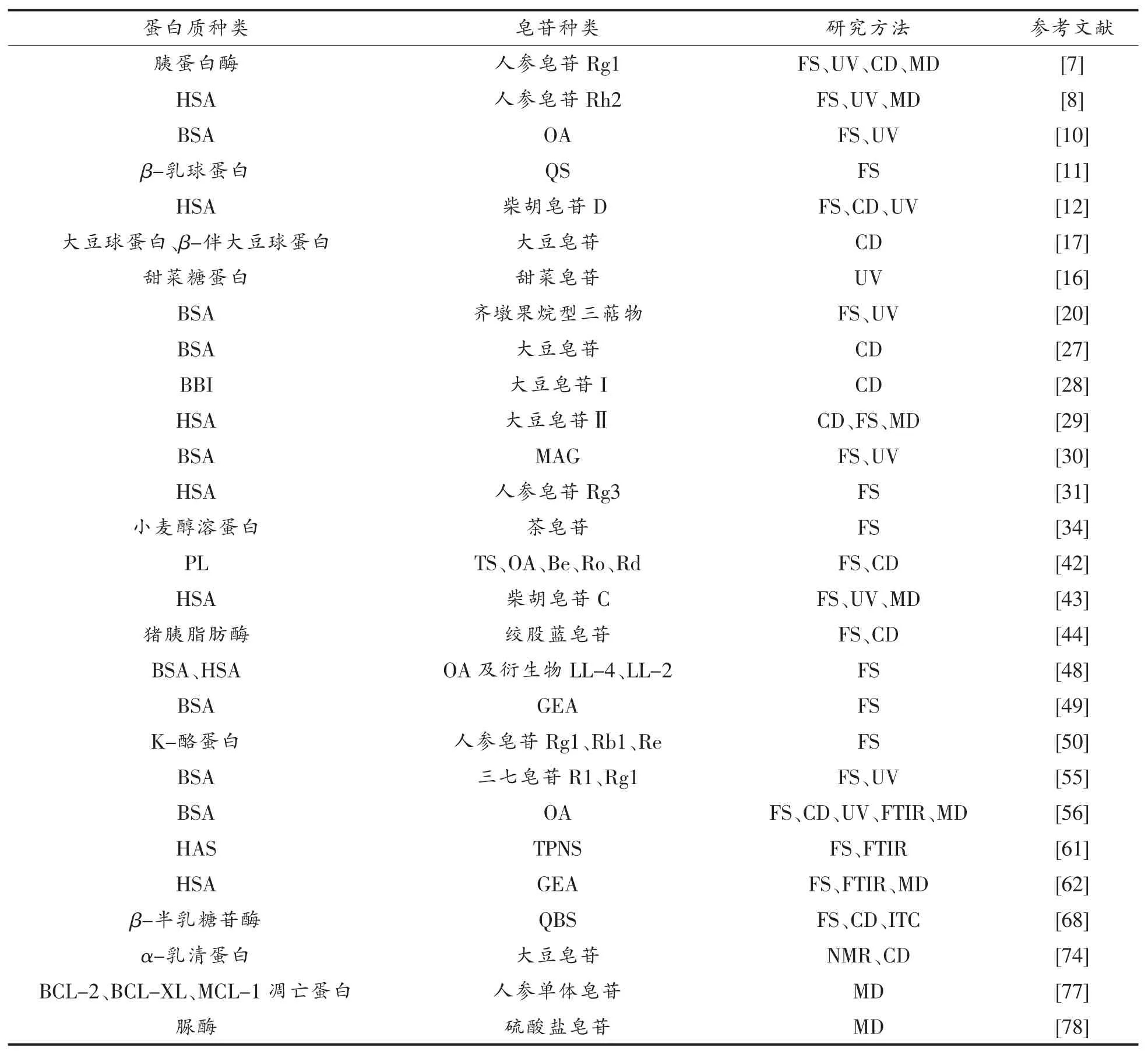
表1 皂苷与蛋白质相互作用研究文献Table 1 Research literature on interaction between saponins and proteins
4 总结与展望
皂苷作为一种功能性活性成分已被广泛研究,而对于皂苷与食品中成分的相互作用的研究仍较少。就目前研究的成果来看,皂苷与蛋白质相互作用的确切机制并不透彻,其原因主要是二者相互作用受到自身化学结构、外部环境等多方面因素的影响,需要考虑每种因素对其造成的后果,而食品体系的复杂性又提升了这些分析的难度;大多数研究仅分析了相互作用对蛋白质的影响,并没有研究对皂苷的活性和结构的变化;分析相互作用的每一种方法都有局限性,无法做到多种方法联用,仅能结合起来初步进行验证分析。进一步解决上述三方面问题,已经成为皂苷-蛋白质复合体系未来研究发展的方向。总之,随着科学技术的不断发展及研究的逐渐深入,人们将会对皂苷-蛋白质的机制有更深入的了解,为研究富含皂苷和蛋白质的新型复杂食品体系提供理论支持。

