以花生碳量子点为探针基于其荧光猝灭-恢复测定多巴胺的研究
马红燕,王靖原,张越诚,杨晓军,陈小莉
延安大学化学与化工学院,延安市分析技术与检测重点实验室,陕西 延安 716000
引 言
多巴胺(Dopamine, DA)是哺乳动物中枢神经系统中最重要的儿茶酚胺神经递质之一,在心血管、肾、激素系统的功能中起着关键作用[1],但异常的DA水平可能会引起一些脑部疾病[2]。 因此,DA的准确检测对于神经生理学、病理学及临床疾病诊断等至关重要。 目前,DA的测定方法主要有HPLC法[3]、电化学法[4]、化学发光法[5]等。 荧光法由于其特有的高灵敏度等优势,在DA的测定中也得到了应用[6-7],Chen等[6]设计了一种无机-有机网络配合物为荧光探针,利用DA可使其荧光猝灭的特性检测DA; Liu等[7]利用DA能猝灭MoS2量子点来进行DA的定量检测,但该量子点中Mo为重金属,限制了方法的广泛应用。 文献中未见将绿色发光CQDs设计为“关-开”型荧光探针测定DA的研究报道。
CQDs是粒径大小一般在10 nm左右,其形状近似为球形的一种新型荧光碳纳米功能材料。 由于其易于制备、环境友好、光学性能显著、光稳定性好、细胞毒性低,被誉为荧光生物传感、生物化学、药物递送和反应催化的新平台[8]。 目前CQDs制备所用碳源基本为含碳化合物,过程复杂且对反应仪器要求较高。 近年来,一些利用天然生物质为原料制备CQDs的方法相继出现。 本文以天然物质“花生”为原料,只加入水,无需添加其他试剂,利用一步水热法可直接合成荧光强度高、水溶性和光稳定性好、绿色无毒的花生碳量子点(PN-CQDs),并基于Ce(Ⅳ)可以明显的猝灭该PN-CQDs的荧光,加入DA后PN-CQDs的荧光可以恢复的现象,构建了“关-开”型荧光探针用于DA的高灵敏检测。 实验对PN-CQDs荧光猝灭-恢复的机理进行了探讨。 该研究为DA的检测提供了新方法,同时也拓展了CQDs在药物和分析化学领域的应用范围。
1 实验部分
1.1 仪器及试剂
FLSP920瞬态稳态荧光光谱仪(英国爱丁堡仪器有限公司); F-4500荧光光度计(日本日立仪器公司); IR Prestige-21傅里叶变换红外光谱仪(日本岛津仪器公司); HT7700透射电镜(日本日立仪器公司); 8453型紫外-可见分光光度计(美国安捷伦仪器有限公司); XRD-7000 X射线粉末衍射仪(日本岛津仪器公司)。
称取DA标准品(中国药品生物制品检定所)0.019 0 g以水溶解后定容至100 mL,配成浓度为1.0×10-3mol·L-1的DA标准溶液,4 ℃保存待用。 实验所用Ce(SO4)2溶液浓度为0.003 mol·L-1。 缓冲溶液为pH 3.80的HAc-NaAc。 实验中所有化学试剂均AR级,花生仁购于当地超市。 实验用水为UP超纯水。
1.2 方法
PN-CQDs的合成: 称取8.0 g磨碎花生仁于50 mL聚四氟乙烯水热反应釜中,加入30.0 mL水,搅拌均匀后置于真空干燥箱中,于190 ℃反应20 h,待冷却至室温后,经滤纸过滤后用0.22 μm微滤膜再次过滤并定容于100 mL容量瓶中。 PN-CQDs工作液为原液稀释200倍,备用。
在10 mL比色管中依次加入稀释200倍的 PN-CQDs工作液2.00和3.00 mL HAc-NaAc缓冲溶液(pH 3.80),Ce(SO4)2溶液0.80 mL,再加入不同浓度的DA溶液,定容。 于反应条件为80 ℃恒温水浴中加热10 min,流水冷却5 min后,在PN-CQDs最佳激发λex=326 nm下测定体系的荧光强度,激发和发射狭缝宽度均为5 nm。 当实验中激发波长λex为251 nm时,激发和发射狭缝宽度均为2.5 nm。
2 结果与讨论
2.1 CQDs的表征
通过透射电镜对PN-CQDs进行了表征,结果如图1(a)所示,所制得的PN-CQDs分散度较好,分布较为均匀,插图为PN-CQDs的粒径分布图,由图可知PN-CQDs的粒径大约在10 nm左右。

图1 PN-CQDs的TEM图(a)、紫外-可见吸收光谱(b)、XRD图(c)和红外光谱图(d)
对PN-CQDs溶液进行干燥处理,得到固态PN-CQDs,XRD表征结果如图1(c)所示,其衍射峰为2θ=21.46°,该峰是碳无定形态特征峰,因此确定该PN-CQDs的晶型为无定型碳,这归因于高度无序的碳颗粒[10]。

2.2 CQDs的荧光特性
探究了不同激发波长λex下PN-CQDs的荧光光谱,如图2所示。 由图可知,该PN-CQDs的发射波长λem和强度强烈依赖于λex。 随着λex由296 nm增加到356 nm,λem由400 nm红移至425 nm,荧光强度先增大后减小,其原因可能是PN-CQDs表面的缺陷、发射位点的数量和位置不同所致。 当λex为326 nm时,荧光强度达到最大,故实验所选λex为326 nm。
根据文献[11]以硫酸奎宁为参照物质,利用参比法,计算得出PN-CQDs的荧光量子产率φ为5.0%。
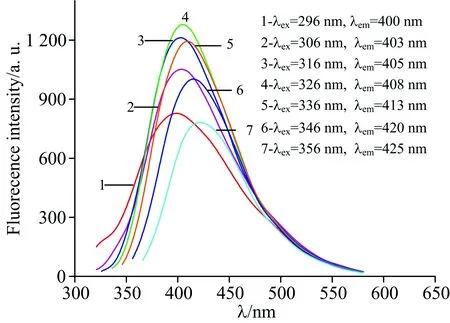
图2 不同激发波长下PN-CQDs的荧光光谱
2.3 Ce(Ⅳ)对PN-CQDs的猝灭作用
由图3体系的荧光光谱图可以看出,在PN-CQDs(曲线7)中加入Ce(Ⅳ)后,体系在λex/λem=326 nm/408 nm处的荧光强度降低(曲线1),PN-CQDs的荧光信号发生明显猝灭。 同时发现,体系在λex/λem=251 nm/350 nm处出现了新的荧光峰(曲线8)。 而Ce(Ⅲ)的特征激发波长为251 nm,特征发射波长为350 nm[12],说明PN-CQDs与Ce(Ⅳ)之间发生电子转移生成了强荧光性的Ce(Ⅲ),PN-CQDs自身荧光信号“关闭”。

图3 Ce(Ⅳ)和DA存在下体系的荧光光谱图
λex=251 nm, 狭缝宽度均为2.5 nm; λex=326 nm, 狭缝宽度均为5 nm
注: 图3中每条线的含义: 7: CQDs; 1和8: CQDs+Ce(Ⅳ); 2—6和9—13: CQDs+Ce(Ⅳ)中分别加入1.0,2.5,5.0,7.5,10.0 μmol·L-1DA; (曲线1—7对应右侧纵坐标值,曲线8—13对应左侧纵坐标值
Fig.3FluorescencespectrumofthesysteminthepresenceofCe(Ⅳ)andDAλex=251 nm, EX/EM Slit 2.5 nm;λex=326 nm, EX/EM Slit 5 nm
Note: The meanings of each line in Fig.3 are: 7: CQDs; 1 and 8: CQDs+Ce(Ⅳ); 2—6 and 9—13: CQDs+Ce(Ⅳ) with 1.0, 2.5, 5.0, 7.5 and 10.0 μmol·L-1DA,respectively; (Curve 1—7 corresponds to the right ordinate value, curve 8—13 corresponds to the left ordinate value
实验对PN-CQDs和PN-CQDs-Ce(Ⅳ)进行了荧光寿命的测定,结果如表1,其加权平均荧光寿命分别为6.02与5.15 ns,PN-CQDs-Ce(Ⅳ)与PN-CQDs体系相比,荧光寿命缩短,证实Ce(Ⅳ)使PN-CQDs荧光猝灭为动态猝灭[13],即Ce(Ⅳ)与激发态的PN-CQDs之间发生了电子转移导致PN-CQDs荧光猝灭。

表1 PN-CQDs和PN-CQDs-Ce(Ⅳ)的荧光寿命值
注:τ为荧光寿命;χ2为卡方检验
2.4 多巴胺对PN-CQDs-Ce(Ⅳ)体系荧光的恢复
向上述PN-CQDs-Ce(Ⅳ)体系(曲线1)中加入不同浓度的DA,如图3所示,λex/λem=326 nm/408 nm处和λex/λem=251 nm/350 nm的荧光峰均随DA浓度的增加而有规律的增大,λex/λem=326 nm/408 nm处PN-CQDs荧光信号得以恢复。λex/λem=326 nm/408 nm为PN-CQDs的特征荧光峰,此处荧光信号的恢复表明,当Ce(Ⅳ)加入到PN-CQDs溶液后,PN-CQDs荧光信号的猝灭除了Ce(Ⅳ)与PN-CQDs之间直接的电子转移作用外,还可能有部分Ce(Ⅳ)会与PN-CQDs的表面—OH和—COOH等基团进行结合[14],使PN-CQDs发生聚集,从而也导致PN-CQDs荧光猝灭,使得PN-CQDs荧光信号“关闭”。 DA加入后,由于其强的还原性,更易与结合于PN-CQDs表面的Ce(Ⅳ)发生反应,将结合于PN-CQDs表面的Ce(Ⅳ)“去除”,PN-CQDs被不断释放出来,导致λex/λem=326 nm/408 nm处荧光信号增大,PN-CQDs的荧光信号“打开”; 同时,DA与表面移除下来的Ce(Ⅳ)反应生成Ce(Ⅲ)使λex/λem=251 nm/350 nm下的荧光信号也表现出了同步增强。

图4 Ce(Ⅳ)-DA体系在不同λex下的荧光光谱图
λex=251 nm, 狭缝宽度均为2.5 nm;λex=326 nm, 狭缝宽度均为5 nm
Fig.4FluorescencespectraofCe(Ⅳ)-DAsystemunderdifferentexcitation
λex=251 nm, EX/EM Slit 2.5 nm;λex=326 nm, EX/EM Slit 5 nm
为验证上述推测,在一定量的Ce(Ⅳ)中加入不同浓度DA进行实验,结果如图4所示。 由图可知,随DA浓度增加,Ce(Ⅳ)与DA反应生成的Ce(Ⅲ)在λex/λem=251 nm/350 nm下荧光强度逐渐升高,但在λex/λem=326 nm/408 nm下几乎没有荧光,说明体系中反应生成的Ce(Ⅲ)对λex/λem=326 nm/408 nm下的荧光强度的测定不会造成影响。 根据λex/λem=326 nm/408 nm波长处荧光信号的恢复值可直接进行DA的测定。
综上所述,当Ce(Ⅳ)加入到PN-CQDs溶液后,PN-CQDs与Ce(Ⅳ)之间的电子转移反应(如图5中的路线A)和Ce(Ⅳ)与PN-CQDs表面基团的结合作用(如图5中的路线B)共同导致PN-CQDs荧光猝灭,DA能将结合于PN-CQDs表面的Ce(Ⅳ)“去除”,使PN-CQDs荧光恢复。 体系反应原理如图5所示。

图5 体系反应原理图
2.5 多巴胺测定条件优化
对测定DA时体系的酸度、缓冲溶液用量、猝灭剂Ce(SO4)2的用量、PN-CQDs的用量进行了优化,结果如图6。 图6表明,加入3.00 mL pH 3.80的HAc-NaAc缓冲溶液、0.003 mol·L-1的Ce(SO4)2溶液0.80和2.00 mL PN-CQDs时,体系的荧光恢复值最大。

图6 缓冲溶液pH值的选择(a); 缓冲溶液、Ce(SO4)2和PN-CQDs用量(b)对体系的影响
Fig.6ThepHvalueofthebuffersolution(a);theeffectofbuffer,Ce(SO4)2andPN-CQDsdosage(b)onthesystem
实验发现,反应在室温下进行的比较缓慢,故实验中采用水浴加热来提高反应速率。 探究了不同的温度下的加热时间,如图7所示,在80 ℃的恒温水浴中加热10 min,PN-CQDs荧光信号恢复程度ΔF可达最大,且在20 h内基本不变。
2.6 干扰测定
在优化的实验条件下,DA浓度为1.0×10-5mol·L-1,考察了可能存在的离子和药剂辅料对实验的影响,结果如表2所示。

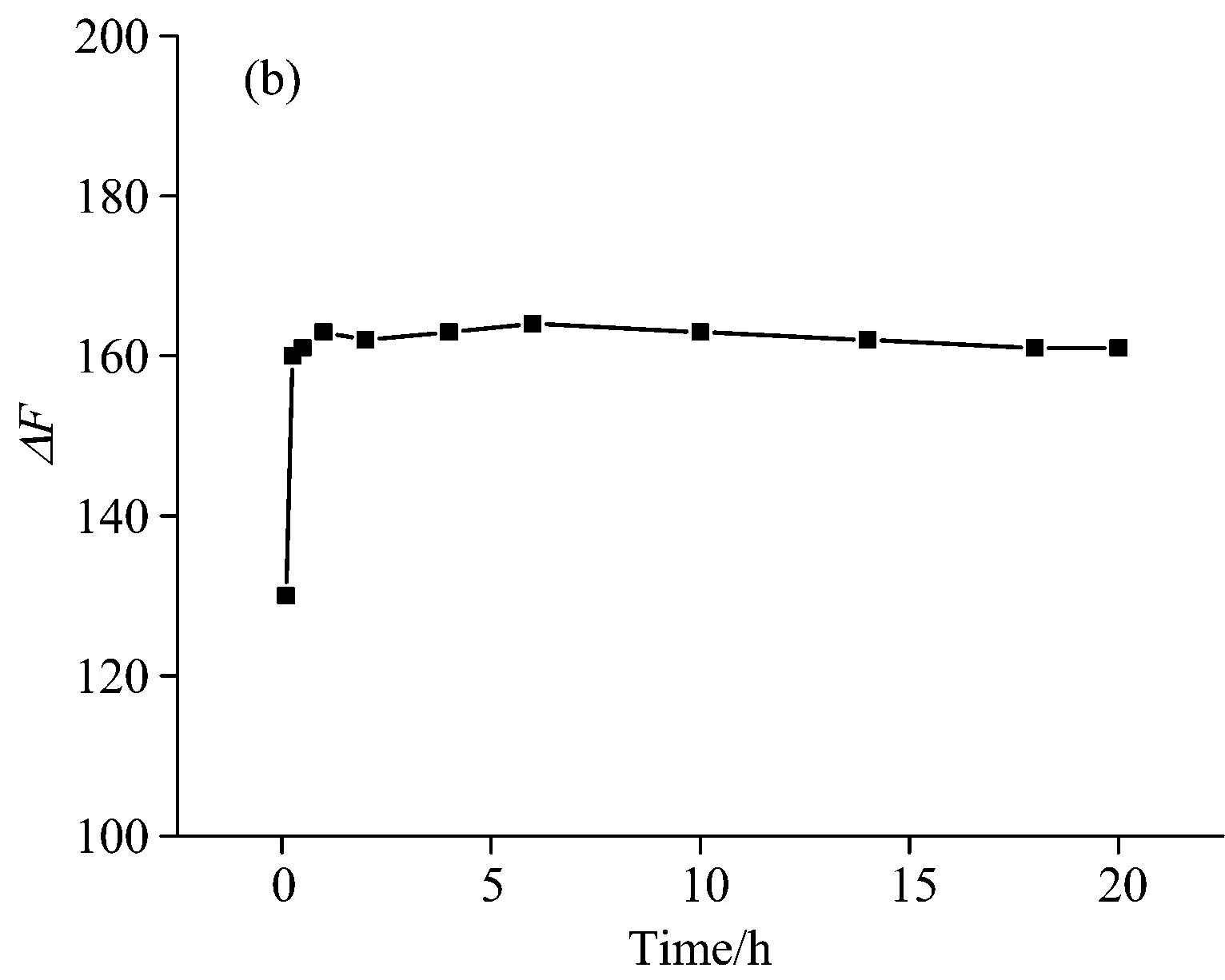
图7 反应温度(a)和时间(b)的影响

表2 干扰物质对体系的影响Table 2 The influence of interfering substances on the system
2.7 方法分析性能
DA浓度在2.5×10-7~1.0×10-5mol·L-1的范围内与PN-CQDs-Ce(Ⅳ)体系荧光恢复值呈一定的线性关系。 图8显示其线性方程为ΔF=2.68×107c+16.68,决定系数R2为0.997 6。 方法相对标准偏差为1.3% (c=1.0×10-5mol·L-1,n=5),检出限低至9.0×10-8mol·L-1。

图8 PN-CQDs-Ce(SO4)2-DA的线性回归方程
2.8 样品测定
取同一批次的DA 5支(规格: 10 mg·mL-1),准确量取其体积1.9 mL(相当于DA 0.019 0 g),用水定容于100 mL容量瓶中。 移取适量,按照实验方法进行测定。 从表3中可以看出加标回收率(平均值±SD)在97.5%±1.3%~103%±1.5%之间。

表3 加标回收实验(n=5)
注: 1为上海禾丰制药有限公司,产品批号: 33160302; 2为上海禾丰制药有限公司,产品批号: 33170812
3 结 论
采用一步水热法合成了强荧光PN-CQDs。 基于DA可使被Ce(Ⅳ)猝灭的PN-CQDs荧光信号重新恢复的现象,实现了对DA的定量测定,该方法灵敏度高、操作简单、绿色环保、成本低廉。 该研究拓展了CQDs在分析化学领域的应用范围,为一些药物的荧光检测提供了新思路。

