miR-93-3p和CDC42在上皮性卵巢癌化疗耐药组织中的表达及临床意义
杨雷 魏丽军 王福花 曾勇
1山西医科大学第二临床医学院(太原030013);山西医科大学附属肿瘤医院2妇一科,
3分子生物室(太原030013)
卵巢癌是女性生殖系统常见的恶性肿瘤之一。由于卵巢位于盆腔深部,早期卵巢癌发病无明显症状且无特异性的肿瘤标记物进行诊断,大多数卵巢癌患者初次诊断即为晚期。而且卵巢癌易复发和化疗耐药,使得晚期卵巢癌患者5年生存率低于30%[1]。目前卵巢肿瘤细胞减灭术联合化疗是治疗卵巢癌的重要手段,而顺铂等铂类药物是目前卵巢癌一线化疗药物[2]。患者预后很大程度上取决于是否对铂类化疗药物敏感。由于部分患者对化疗药物耐药而导致化疗失败,从而缩短生存期。上皮性卵巢癌为卵巢癌中最为常见的类型(占80%~85%)。上皮性卵巢癌相关基因表达异常是导致化疗耐药的重要因素之一。因此近年来卵巢癌化疗耐药相关基因也成为上皮性卵巢癌研究的热点。
在笔者前期研究[3]中利用miRNA表达谱基因芯片技术筛选出与上皮性卵巢癌化疗耐药相关低表达量的miR-93-3p。在此基础上,应用两种生物信息学软件预测miR-93-3p 可能的靶基因,结合文献分析靶基因可能参与上皮性卵巢癌化疗耐药的生物学过程及信号通路。本研究采用RT-PCR 技术检测miR-93-3p和CDC42在上皮性卵巢癌组织中的表达,比较上皮性卵巢癌化疗敏感和化疗耐药组织中的表达水平。探讨miR-93-3p在上皮性卵巢癌化疗耐药中可能的作用机制。
1 资料与方法
1.1 一般资料收集2015年8月至2018年7月间就诊于山西省肿瘤医院111例上皮性卵巢癌患者的组织学标本。根据NCCN 公布的卵巢癌临床实践指南,将患者分为铂类化疗敏感组与耐药组。其中铂类化疗敏感组44例,耐药组67例。患者年龄35~62岁,耐药组平均年龄49.9岁,敏感组平均年龄51.1岁。将铂类化疗敏感组定义为对照组。上皮性卵巢癌化疗耐药定义标准:肿瘤细胞减灭术后对初次化疗有反应,但完成化疗后相对较短的时间通常6个月内复发者;上皮性卵巢癌化疗敏感定义标准:肿瘤细胞减灭术后对初次化疗有明确反映,并达到临床完全缓解,停用化疗药6个月后复发者。上皮性卵巢癌复发的证据和迹象:(1)CA125水平升高;(2)出现胸、腹水;(3)体检发现肿块;(4)影像学检查发现肿块;(5)不明原因肠梗阻。存在上述两项或两项以上指标即可考虑为上皮性卵巢癌复发。纳入实验标准为:(1)患者年龄35~62岁;(2)无其他恶性肿瘤病史;(3)术前均未接受任何抗肿瘤药物治疗且未行其他辅助治疗;(4)接受卵巢癌细胞减灭术后经病理学证实为上皮性卵巢癌并在术后完整规范接受紫杉醇联合铂类药物化疗患者。所有组织标本取出后0.5 h 内置于的冻存管中,液氮冷冻保存备用。本研究经山西医科大学附属山西省肿瘤医院伦理委员会批准(批准文号:201507),受试者均签署知情同意书。
1.2 主要试剂TaqMan Real-time PCR miRNA Array、SYBR®Select Master Mix,购自ABI公司;RNAiso Plus,购自TaKaRa公司;the First Strand cDNA Synthesis Kit,购自Tiangen®公司。
1.3 方法
1.3.1 miR-93-3p靶基因预测及功能、生物学通路分析通过miRD、mirTarbas 等生物信息学分析软件对miR-93-3p 进行靶基因预测分析,选取2种软件共同结果作为其可能靶基因,并对每个micro RNA所有靶基因在DAVID 网站进行KEGG和功能通路分析(P<0.05)。
1.3.2 实时荧光定量PCR检测(1)运用RNAiso Plus,在无RNase 条件下提取卵巢癌组织总RNA。使用Nanodrop2000c 分光光度仪进行RNA浓度及纯度的测定,测量到260 nm和280 nm的吸光度值的比值(OD260/OD280)均在1.8~2.0间,用于进一步实验。(2)使用the First Strand cDNA Synthesis kit,将总RNA反转录成cDNA。反应条件:25℃10 min,37℃120 min,85℃5 min。(3)将合成的cDNA 作为定量PCR 模板,按照miScript SYBR Green PCR Kit 反转录试剂盒的说明对cDNA 实施RT-PCR 扩增。用20 μL反应体系,标本使用U6作为内参。扩增反应条件:95℃5 min,95℃45 s,60℃30 s,40 cycles。每一样本PCR 反应重复3次。miR-93-3p 引物序列:上游5′-GTGCAGGGTCCGAGGT-3′;下游5′-ACUGCUGAGCUAGCACUU-3′。CDC42 引物序列:上游5′-CCATCGGAATATGTACCGACTG-3′;下游:5′-CTCAGCGGTCGTATCTGTCA-3′。
1.4 统计学方法应用SPSS 24.0 对PCR 数据进行统计分析。每个样品目的基因的ΔCt 值用内参基因进行处理(ΔCt=Ct目的基因-CtU6,U6为内参,随后对化疗敏感组ΔCt 取平均值,记为ΔCt敏感均值。ΔΔCt=ΔCt目的基因-ΔCt敏感均值),最后计算样品目的基因相对表达量即2-ΔΔCT。化疗耐药组织及化疗敏感组织数据采用t检验分析比较,数据以表示。miR-93-3p和CDC42的相关性采用Spearman 相关性检验。
2 结果
2.1 miR-93-3p靶基因预测及生物信息学分析对miR-93-3p 通过2个数据库(miRD,mirTarbas)预测靶基因信息,把2个数据库的预测结果取交集作为预测结果,可以降低预测靶基因的假阳性率。运用2种生物信息学软件分析预测到miR-93-3p 可能的靶基因有ACTB,CDC42,ENAH,MAP2K1,PNMA5,ING3,ABR 等126个。通过靶基因GO 功能注释分析发现:miR-93-3p 预测到靶基因参与的生物学过程主要富集在RNA 代谢过程调节、细胞分化、转录调节、蛋白质结合等方面(P<0.05)。通过靶基因KEGG 信号转导通路分析发现:miR-93-3p 靶基因显著富集在焦点粘连、癌症通路、蛋白质分解等基因通路(P<0.05)。结果见图1、2。结合药物代谢及化疗耐药相关理论和相关文献,并将生物学过程中所包含的靶基因与信号通路中所包含的靶基因取交集,CDC42 可能通过miR-93-3p的调控Focal adhesion 信号通路参与上皮性卵巢癌化疗耐药。
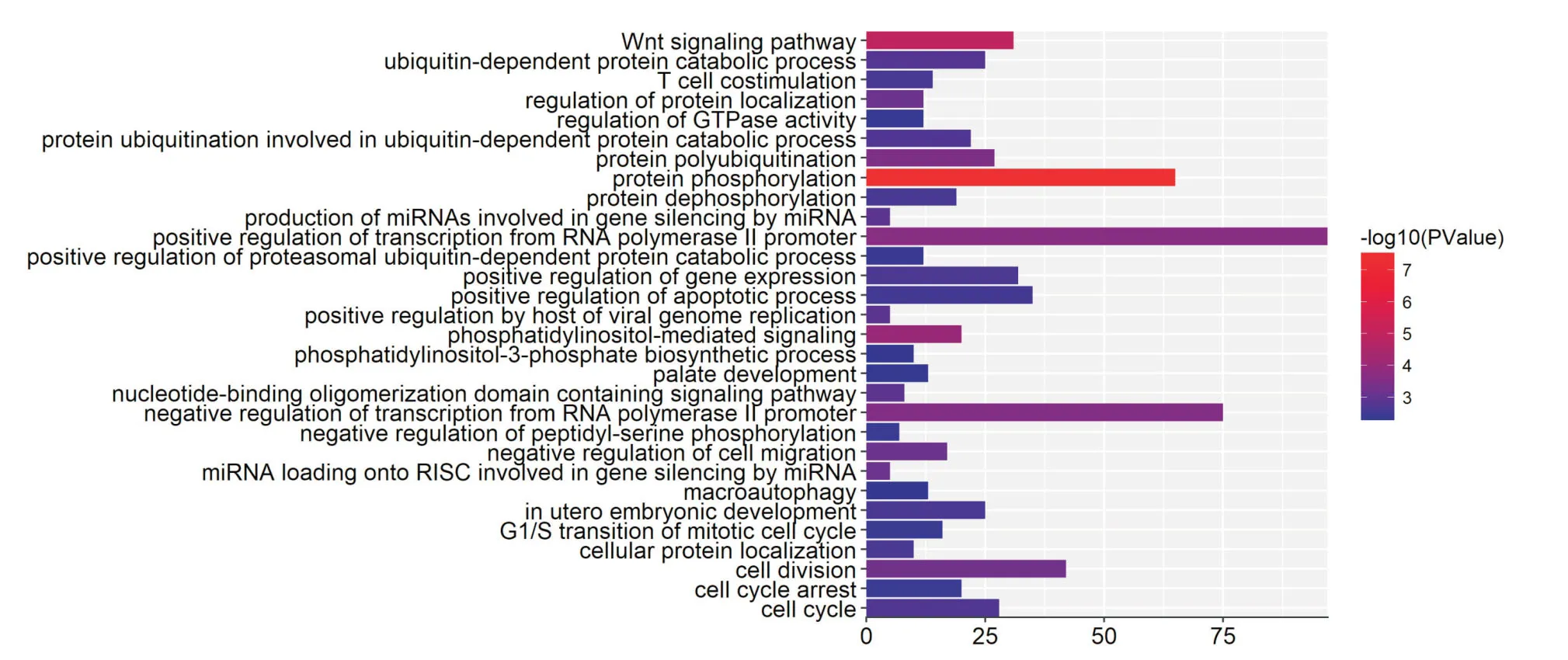
图1 miR-93-3p 预测靶基因GO 功能注释分析Fig.1 GO function annotation analysis of miR-93-3p predictive target gene
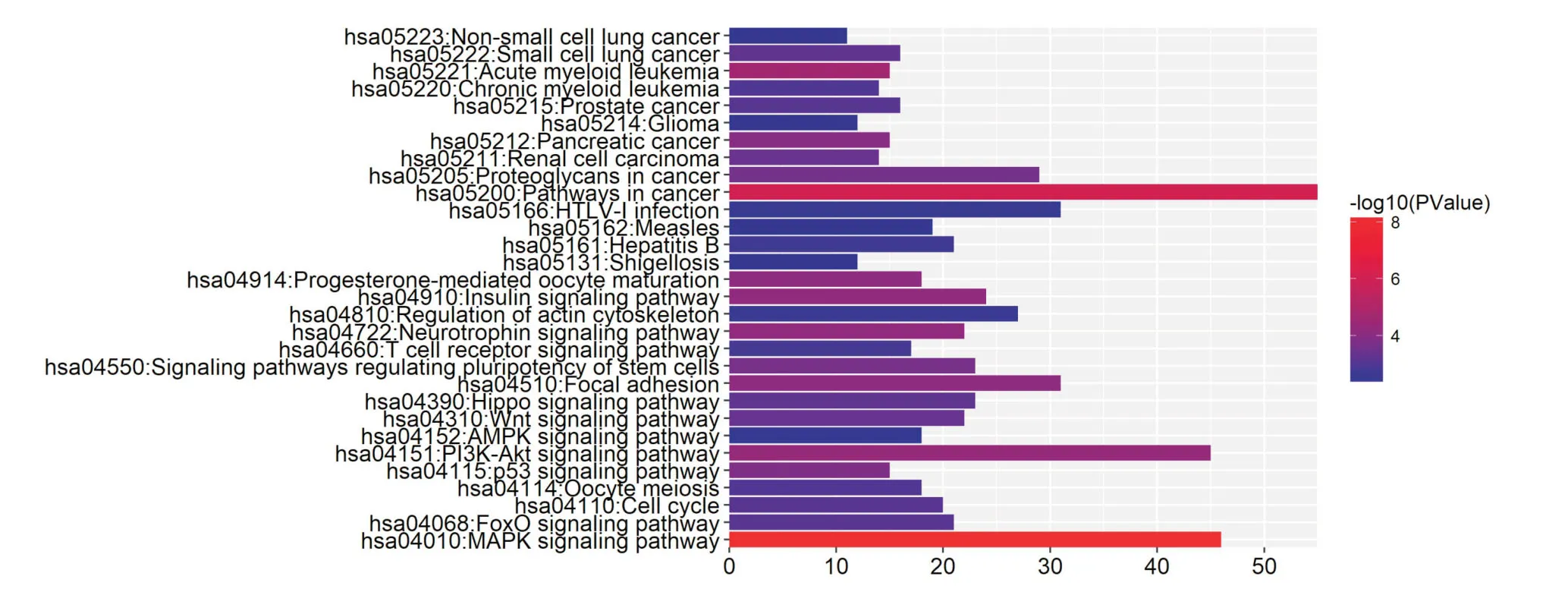
图2 miR-93-3p 靶基因KEGG 通路富集分析Fig.2 KEGG pathway enrichment analysis of miR-93-3p target genes
2.2 RT-PCR检测上皮性卵巢癌组织中miR-93-3p和CDC42的表达水平
2.2.1 实时定量PCR检测miR-93-3p、CDC42和U6内参的扩增曲线和溶解曲线miR-93-3p、CDC42和U6 内参扩增曲线呈S型,曲线光滑,拐点清楚(图3、5);miR-93-3p、CDC42和U6 内参溶解曲线呈单峰,提示扩增的特异性较好,结果可信(图4、6)。
2.2.2 miR-93-3p、CDC42在化疗耐药和敏感组织中的表达水平比较实时荧光定量PCR检测结果显示,miR-93-3p在化疗耐药组中的相对表达量显著低于敏感组,差异具有统计学意义(P<0.05,表1)。CDC42在化疗耐药组中的相对表达量显著高于敏感组,差异具有统计学意义(P<0.05,表1)。
图3 miR-93-3p和U6 内参扩增曲线Fig.3 miR-93-3p and U6 internal parameter amplification curves
2.3 miR-93-3p、CDC42表达量与上皮性卵巢癌患者临床病理参数的关系按照上皮性卵巢癌患者不同临床特征对研究对象进行分组,miR-93-3p在临床分期中的表达量随着期别升高呈现明显下调,CDC42的表达量随着期别升高呈现明显上调(P<0.05)。miR-93-3p在不同的组织学分级中,随着分级升高,肿瘤恶性程度增加,miR-93-3p表达水平呈现明显下调,而CDC42表达水平呈现明显上调(P<0.05)。有淋巴转移及无淋巴转移组中,miR-93-3p的表达在淋巴转移组较淋巴无转移组明显下调,CDC42的表达在淋巴转移组较淋巴无转移组明显上调(P<0.05)。而与年龄无明显相关(P>0.05)。见表2。
图4 miR-93-3p和U6 内参溶解曲线Fig.4 The Melt curves of miR-93-3p and U6
图5 CDC42和U6 内参扩增曲线Fig.5 CDC42 and U6 internal parameter amplification curves
图6 CDC42和U6 内参溶解曲线Fig.6 The Melt curves of CDC42 and U6
表1 miR-93-3p、CDC42在化疗耐药和敏感组织中的表达水平比较Tab.1 Comparison of expression levels of miR-93-3p and CDC42 in chemotherapy-resistant and sensitive tissues(n=111)±s

表1 miR-93-3p、CDC42在化疗耐药和敏感组织中的表达水平比较Tab.1 Comparison of expression levels of miR-93-3p and CDC42 in chemotherapy-resistant and sensitive tissues(n=111)±s
组别敏感组耐药组miR-93-3p 2-ΔΔCT 1.303±1.000 0.075±0.052 P 值0.023 CDC42 2-ΔΔCT 1.069±0.447 1.704±0.705 P 值0.017
表2 上皮性卵巢癌组织miR-93-3p、CDC42 相对表达量与部分临床病理参数的关系Tab.2 Relationship between relative expressions of miR-93-3p and CDC42 in epithelial ovarian cancer tissues and some clinicopathological parameters±s

表2 上皮性卵巢癌组织miR-93-3p、CDC42 相对表达量与部分临床病理参数的关系Tab.2 Relationship between relative expressions of miR-93-3p and CDC42 in epithelial ovarian cancer tissues and some clinicopathological parameters±s
注:G1级为高分化,恶性度相对较低;G3为低分化,恶性度高;N1组为有淋巴结转移,N0组为无淋巴结转移
病理参数年龄<50≥50临床分期Ⅰ~ⅡⅢ~Ⅳ组织学分级G1 G2 G3淋巴结转移N1 N0例数53 58 61 50 16 34 61 60 51 miR-93-3P 1.36±0.56 1.34±1.02 1.47±1.70 1.16±1.47 1.33±1.22 1.07±0.71 0.12±0.22 0.28±0.54 1.05±1.56 P 值0.323 0.031 0.028 0.001 CDC42 0.38±0.17 0.36±0.25 0.31±0.03 0.91±0.47 0.21±0.13 0.81±0.37 0.95±0.23 0.88±0.36 0.45±0.41 P 值0.562 0.043 0.001 0.037
2.4 miR-93-3p与CDC42表达的相关性111例卵巢癌患者组织中miR-93-3p与CDC42表达经Spearman 相关性分析显示,miR-93-3p与CDC42表达水平呈负相关(r=-0.469,P<0.01)。
3 讨论
miRNA是非编码RNA 家族的成员之一,长度约20~25个核苷酸,在真核生物中首次被发现[4],以往认为miRNA 无生物学功能。当前研究[5]发现,人类各种类型肿瘤发生与miRNA的异常表达相关。miRNA 能够通过控制其靶mRNA的表达来促进肿瘤的生长、侵袭、血管生成和免疫逃避,调控靶基因的表达[6-7]。miRNA与靶基因的3′端非翻译区互补结合后,发挥转录后水平的调节作用,并且同时调控多个目标基因,此为miRNA 作用广泛的重要机理[8]。与肿瘤相关的miRNAs 被分为两类:抑癌miRNAs和促癌miRNAs[9]。抑癌miRNAs表达量减少,其所调控的下游靶基因表达量增加,下游基因一般为致癌基因。相反,促癌miRNAs 一般表达量增多,其调控的下游靶基因表达量减少,一般为抑癌基因。尽管如此,有关人类miRNAs 异常表达导致恶性肿瘤发生发展的研究才刚刚开始,这是因为一个miRNA 可以同时调控多个靶基因,一个靶基因也可以被多个miRNA 调控,miRNA与靶基因之间形成了复杂的关系。
研究[10-11]表明,在卵巢癌患者中,参与不同卵巢癌通路的miRNA表达是上调或下调的。miRNA在不同组织类型的卵巢癌的发病机制和发生过程中都发挥着重要作用。miR-93属于miR-106b-25家族成员,miR-93-3p 属于miR-93的亚型。有研究[12]发现miR-93 可抑制肿瘤细胞侵袭转移能力,并且负向调控靶基因表达,抑制肿瘤细胞的侵袭和转移过程。miR-93在非小细胞肺癌和弥漫性大B 细胞淋巴瘤中表达上调,而在胃癌组织中则表达降低,说明不同肿瘤组织中miR-93的作用和分布均存在较大差异[13]。XIANG 等[14]研究了在人结肠癌干细胞中不同miRNA的表达,结果显示,miR-93会抑制SW1116 干细胞增值,属于抑癌基因。在SRIVASTAVA 等[15]研究中,从卵巢癌细胞分离出的miR-93表达水平下降,且与铂类化疗耐药相关。有研究[16]表明,miR-93-3p 通过靶向促进FZD7的表达,激活Wnt/β-catenin 信号通路,促进骨肉瘤的进展。迄今为止,miR-93-3p在上皮性卵巢癌化疗耐药中的作用还不清。笔者前期运用miRNA表达谱基因芯片技术分析发现miR-93-3p在上皮性卵巢癌化疗耐药组织中低表达。本研究结果显示,miR-93-3p 相对于化疗敏感组,在铂化疗耐药组中的表达量显著下调;在临床分期中的表达,随着期别升高其表达水平却呈现明显下降;组织学分级中,随着肿瘤恶性程度增加,miR-93-3p表达量明显下降;在淋巴结转移组中的表达水平较无淋巴结转移组表达水平明显下降。说明miR-93 低表达可能在卵巢癌化疗耐药过程中可能发挥抑癌基因的作用。
笔者利用生物信息学软件预测到miR-93-3p可能的126个靶基因,进一步对预测到的靶基因进行GO 分析和KEGG Pathway 分析,GO 分析结果显示小的GTPase 介导的信号转导、正调控RNA 聚合酶Ⅱ转运过程与化疗耐药相关。KEGG Pathway分析结果显示FAK 信号通路可能与上皮性卵巢癌化疗耐药发生相关。FAK是一种分子量125 kD的非受体、非膜性的胞质酪氨酸蛋白激酶,主要位于黏附细胞的黏着斑,主要在细胞质中表达,其在进化上高度保守,并在调节细胞生存、黏附、凋亡中发挥重要作用。在细胞癌变过程中,FAK 活化,并通过自动磷酸化后激活下游信号通路,促进细胞的增殖和迁移[17-18]。有研究[19]表明,宫颈癌标本中FAK 被激活,而宫颈细胞、宫颈炎细胞中FAK 未被激活,激活的FAK与宫颈癌患者临床预后不良相关,特别是FAK 基因可通过抑制肿瘤细胞凋亡而起到促肿瘤的作用。本研究中笔者通过生物信息学软件预测到可能的靶基因CDC42 参与FAK 信号通路,因此选择CDC42 作为接下来的研究方向。CDC42是Rho 家族的一种小GTP 酶,全长191个氨基酸,促进细胞分裂和生长,包括细胞周期进展、转录、肌动蛋白细胞骨架组织和膜运输等[20]。CDC42 除参与正常的细胞生理过程外,与肿瘤的发生、侵袭和转移密切相关[21],CDC42 可以增强细胞间的黏附,促进细胞骨架构建和肿瘤血管壁生成,阻断正常凋亡信号转导途径从而抑制凋亡。在消化系统肿瘤、头颈部肿瘤、黑色素瘤等恶性肿瘤中表达增高[22]。在体内成像观察和侵入性研究表明伪足在肿瘤侵袭和转移中起主要作用[23]。有研究[24]表明,miR-924在肝癌细胞株中表达下调,当miR-924在肝癌细胞中过表达后,可靶向调控CDC42 抑制细胞的增殖和迁移。LIU 等[25]研究发现经过化疗后残存的乳腺癌衰老细胞可表现出对内分泌药物的耐药性。进一步研究发现乳腺癌衰老细胞中CDC42 高表达,CDC42在乳腺癌衰老细胞中通过激活ERK 信号通路增加对内分泌药物的耐药性。本研究中,笔者发现CDC42在上皮性卵巢癌铂类化疗耐药组中显著高表达,且高表达量的CDC42与上皮性卵巢癌临床分期、组织学分级、淋巴转移有显著相关性。miR-93-3p和CDC42的表达呈负相关。表明高表达的CDC42与上皮性卵巢癌恶性程度及迁移有关。
综上所述,miR-93-3p 低水平表达可能与上皮性卵巢癌的发生发展有关,并在上皮性卵巢癌化疗耐药中产生作用。miR-93-3p 可能通过调节靶基因CDC42 参与上皮性卵巢癌铂类化疗耐药过程。

