酿酒酵母细胞壁和细胞膜应对高渗胁迫机制研究
郭 红 邱 月 魏建平 张宇翔 袁亚宏 岳田利,
(1.西北大学食品科学与工程学院, 西安 710069; 2.西北农林科技大学食品科学与工程学院, 陕西杨凌 712100)
0 引言
细胞暴露于非理想的生长条件及任何降低细胞活力或适应性的环境都可以被认为是压力[1]。高渗压力是一大类主要的非生物压力[2]。酿酒酵母(Saccharomycescerevisiae)是一种温和耐渗酵母,已成为研究渗透压耐受性的模型菌株。目前,对于酿酒酵母耐渗机理的研究主要集中在高渗透性甘油促分裂原活化蛋白激酶(High-osmolarity glycerol mitogen-activated protein kinase, HOG-MAPK)途径[2-4],通过甘油的产生调节渗透压平衡[5-6]。HOG-MAPK途径中的细胞膜传感器感知压力信号,将压力信号传输至Hog1激酶,Hog1磷酸化(Hog1-PP)后进入细胞核,进而调节转录反应[4]。在0.2 g/mL糖胁迫下的转录反应表明,酿酒酵母诱导了与压力反应途径、修复途径和HOG途径有关的基因[7]。在0.4 g/mL糖压力下,酿酒酵母增加了糖酵解和戊糖途径等相关基因的表达[8]。在0.6 g/mL的糖胁迫下,酿酒酵母诱导了半胱氨酸蛋白酶和线粒体依赖性凋亡[9],但是在此条件下,酿酒酵母细胞壁(膜)的变化与分子机制尚不清楚。此外,酿酒酵母还是一种可揭示与高渗压力变化有关的病理特征(例如缺血和糖尿病昏迷)的模型菌株[4,9],高渗应激也能诱导人细胞系凋亡[10]。
细胞壁是细胞在压力下存活所必需的。在高渗压力下,一方面,酵母转向更低渗透压环境会增加细胞体积,从而破坏细胞膜的完整性,为了抵消这种压力,酵母细胞壁具有保护细胞膜免于被爆裂的作用。另一方面,高渗透压会导致酵母细胞内的水流出和细胞收缩,且会造成多种细胞生物过程的破坏,例如破坏细胞骨架结构、触发细胞周期停滞和凋亡[6]。然而,酿酒酵母细胞表面响应在极端高糖压力的应对机制尚不清楚。为此,本文比较研究酿酒酵母细胞壁(膜)在高糖压力下的变化,并通过全局转录文件对其进行分析。
1 材料与方法
1.1 材料与试剂
酿酒酵母(ATCC38531)购自美国典型培养物保藏中心(ATCC);TRIzol试剂购自美国Invitrogen公司;几丁质酶和β-葡聚糖降解酶购自上海源叶公司;D-葡糖胺、4-二甲基氨基苯甲醛、磷酸盐缓冲盐水(PBS,pH值 7.2~7.4)、卡尔科弗卢尔荧光增白剂(Calcofluor white stain, CFW)、碘化丙啶(PI)和赫斯特荧光燃料33342(Hoechst 33342)购自美国Sigma-Aldrich公司;酵母提取物、蛋白胨、D-(+)-葡萄糖和多肽购自当地供应商。
1.2 细胞培养
酿酒酵母ATCC38531在YPD(1%酵母提取物、2%蛋白胨和2%葡萄糖)肉汤中30℃培养,直至培养物处于指数后期(菌体浓度约1×108CFU/mL)。然后使用YPD培养基(0.02 g/mL葡萄糖)作为基础和无应激培养基,使用60%YPD(0.6 g/mL葡萄糖)作为高糖培养基[11]。取20 mL培养至指数后期的酿酒酵母(菌体浓度约2×109CFU/mL)接种到60%YPD培养基中,至菌体浓度为2×107CFU/mL,然后30℃适应4 h。将分别在YPD培养基和60%YPD培养基中适应4 h的酿酒酵母细胞洗涤并重悬于PBS中,并作为对照组的样品和高渗胁迫处理组的样品。
1.3 细胞壁特性变化分析
1.3.1细胞壁中几丁质和β-葡聚糖含量测定
根据文献[12]报道的方法分离对照组和处理组酿酒酵母的细胞壁并定量测定细胞壁几丁质和β-葡聚糖的含量。
1.3.2细胞壁染色
根据文献[13]报道的方法进行酵母细胞的CFW染色试验。将2 μL CFW染色的细胞上样到载玻片上,在顶部添加盖玻片,使用Andor CSU-W型共聚焦显微镜拍摄图像。
1.3.3细胞壁酶解
根据文献[14]报道的方法,选择葡聚糖特异性降解酶对对照组细胞和高浓度葡萄糖处理组的细胞进行细胞壁的降解试验,从而对细胞壁的灵敏性进行分析。将对照组和高浓度葡萄糖处理组的细胞用超纯水洗涤,分别在NaH2PO4(0.1 mol/L)、0.04%NaN3和40 μg/mL降解酶的缓冲液中稀释至细胞在660nm处OD值为0.73。每小时监测细胞浓度的变化并测定对照组和高浓度葡萄糖处理组的酵母细胞酶解后的OD值,重复3次。
1.4 细胞膜的PI和Hoechst 33342双染试验
根据文献[15]报道的方法并做了一些改进,进行酿酒酵母细胞膜完整性分析的双染试验。染色试验需要添加至少0.1 μg/μL PI和10 μg/μL Hoechst 33342。细胞染色处理后在荧光显微镜(德国Lecia公司)下观察酵母细胞。
1.5 RNA提取的样品制备
RNA提取的样品为分别在YPD培养基和60%YPD培养基中适应4 h的酿酒酵母细胞,即对照组的样品和高渗胁迫处理组的样品。每个样品重复3次,收集所有样品,随后用液氮快速冷冻并在-80℃下储存,用于RNA提取。
1.6 转录组分析
RNA的提取准备、RNA质量检测、cDNA文库构建和RNA测序在北京诺禾公司进行。按照TRIzol试剂的说明书提取细胞总RNA并用无RNase的DNA酶I处理。使用NanoDrop型分光光度计(美国Thermo Scientific公司)、Qubit 2.0型荧光计(美国Life Technologies公司)、琼脂糖凝胶电泳和Agilent 2100型生物分析仪(美国Agilent Technologies公司)测定RNA样品的浓度、纯度和完整性[11,16]。根据文献[17-18]构建cDNA文库,并在Illumina Hiseq 2000平台(美国San Diego公司)上测序。
1.7 差异表达基因鉴定
从对照组和处理组样品中测序并产生原始读数。通过过滤衔接子序列获得高质量的RNA-Seq纯净序列读数。通过HISAT 2.0将酿酒酵母的纯净序列读数与酿酒酵母S288C的参考基因组比对。通过HTSeq v0.6.1量化基因表达值。DESeq v1.10.1用于确定对照组和处理组样品之间的差异表达基因(DEG)。如果基因变化倍数以2为底的对数值大于0且显著性p<0.05,则认为基因显著差异表达。根据文献[11],通过GOSeq Release 2.12进行DEG的GO富集分析。本试验测定的RNA-seq数据已经存入国家生物技术信息中心,登录号为PRJNA437612。
2 结果及分析
2.1 极端高糖压力对酿酒酵母细胞壁的影响
为探索酿酒酵母在极端高糖条件下细胞壁特性的变化,测定了对照组和高糖压力处理组酿酒酵母细胞壁中几丁质和葡聚糖的含量。如图1a所示,酿酒酵母细胞壁在高糖压力下适应4h后几丁质含量(质量比,以每毫克干细胞壁质量计)从6 μg/mg增加到6.9 μg/mg,葡聚糖含量从128 μg/mg增加到138 μg/mg。如图1b、1c所示,相比对照组细胞,处理组的酿酒酵母细胞对CFW染料的结合显示出高灵敏性,并且CFW染色的高灵敏性主要富集在芽颈的区域。此外,如图1d所示,处理组的细胞在降解酶处理3 h后细胞浓度(660 nm处OD值)有49%的下降,而对照组仅有25%的下降,这说明了经过高糖压力处理的酿酒酵母的细胞壁更易受到葡聚糖特异性降解酶的降解。以上的现象可能是因为酿酒酵母在高糖压力下细胞壁葡聚糖-几丁质层遭到了损伤或者破坏。
2.2 极端高糖压力对酿酒酵母细胞膜的影响
为研究极端高糖压力对酿酒酵母细胞膜的影响,进行双染试验来区分细胞膜完整的细胞和细胞膜损伤的细胞[13,15]。PI染料不可渗入具有完整细胞膜的细胞,但它可以容易地渗入到细胞膜受损的细胞中并使该细胞染色,而留下具有完整细胞膜的细胞未被染色。而细胞膜完整和细胞膜受损的细胞都可以被细胞穿透性染料Hoechst 33342染色。荧光图像结果显示,经过0.6 g/mL高糖压力分别处理4 h和8 h的部分细胞能被PI染料染成红色而对照组的细胞未被PI染料染色,这说明高浓度葡萄糖处理的细胞细胞膜受到了损伤(图2),而对照组细胞的细胞膜未受到损伤。
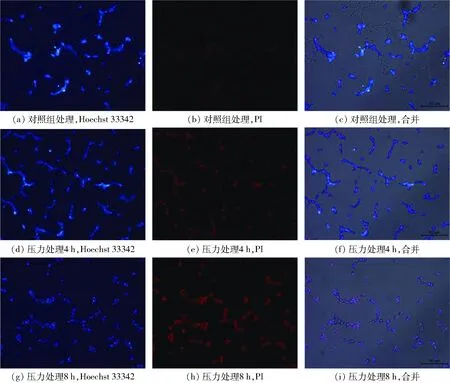
图2 高渗胁迫对酿酒酵母细胞膜完整性的影响Fig.2 Effects of high sugar stress on integrity of cell membrane
2.3 酿酒酵母细胞的RNA测序结果
为解释以上发现,对对照组细胞和处理组细胞进行了全局的RNA-seq测序。差异基因火山图如图3所示,有显著性差异表达的基因用红色点(上调)和绿色点(下调)表示,无显著性差异表达的基因用蓝色点表示。本试验中鉴定出酿酒酵母在适应0.6 g/mL极端高糖压力下上调表达的1 959个和下调表达的1 955个基因(DEGs)(图3)。这个基因数量要显著多于酿酒酵母在应对0.2 g/mL糖质量浓度下获得的294个差异基因[7]和酿酒酵母在应对0.4 g/mL糖质量浓度条件下获得的589个差异基因[8]。由此可以看出,酿酒酵母随着环境糖浓度的增加,差异表达的基因也增加。这可能是因为随着环境压力的增加,细胞应对环境压力的调节机制变得更复杂。为此,本文着重关注与表型结果相关的细胞膜和细胞壁的DEGs。

图3 差异基因火山图Fig.3 Volcano diagram of DEGs
2.4 极端高糖压力对酿酒酵母细胞膜代谢途径的影响
本研究观察到与细胞膜相关的脂肪酸/不饱和脂肪酸合成、脂肪酸代谢、脂肪酸降解、脂肪酸延长等途径在极端高糖压力下均发生了显著变化(表1、图2)。这说明0.6 g/mL高糖压力可能通过干预脂肪酸的组成和含量来影响膜的流动性或渗透性。文献[19]表明脂肪酸通过改变膜的流动性或渗透性来参与对外部应激的反应。
2.5 极端高糖压力对酿酒酵母细胞壁完整性(CWI)信号传导途径的影响
极端高糖压力诱导了酿酒酵母一系列与细胞壁组成和生物发生相关的基因的差异表达(表2)。细胞壁完整性(CWI)信号通路相关基因显著的差异表
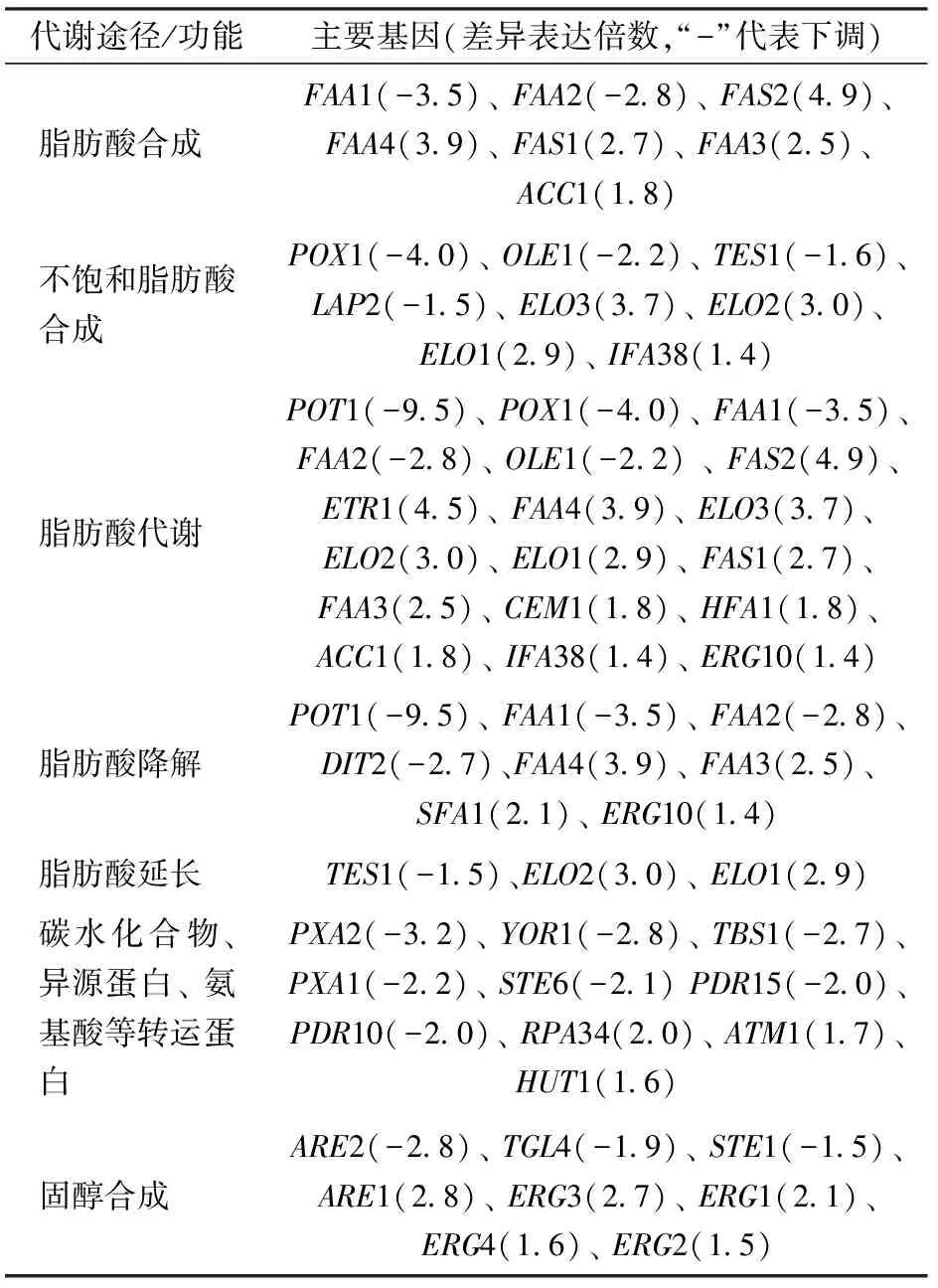
表1 与细胞膜相关的差异表达基因Tab.1 Differentially expressed genes associated with plasma membrane compartments and functions
达进一步支持了从图1中观察到的细胞壁变化。酿酒酵母在高糖压力下与细胞壁有关的一些关键信号基因(ROM1、PIR3、YGP1和CWP1)和主要转录因子RLM1被下调(表2、图4d)。此外,RLM1的22个靶标基因中有6个基因过表达,有6个基因被抑制,这些靶标基因编码与细胞壁组织和细胞壁生物发生相关的蛋白质(图4d)。

表2 与细胞壁相关的差异表达基因Tab.2 Differentially expressed genes associated with cell wall compartments and functions
3 讨论
膜外排泵在假单胞菌耐渗过程中起关键作用。细菌外排泵(AcrAB-TolC)在大肠杆菌中的过表达导致其对环境压力的耐受性增加[14]。与细菌泵系统类似,酵母细胞的排毒功能主要由多效药物抗药性(PDR)泵驱动,PDR泵是酵母细胞膜上ABC转运蛋白(ATP-binding cassette)的一个子家族[20]。ABC转运蛋白通过释放细胞有害分子来应对环境压力[21]。在真菌扩展青霉中,ABC转运蛋白基因的下调表达降低了耐药性[18]。酿酒酵母的ABC转运蛋白基因(YOR1和PDR15)在高糖胁迫下分别下调表达了2.8倍和2.0倍(表1),这表明本研究使用的极端高渗压力(0.6 g/mL糖)可能降低了酿酒酵母的排毒功能。0.6 g/mL高糖压力还影响了酿酒酵母细胞膜上碳水化合物、异源蛋白和氨基酸转运蛋白的活性(表1),这个结果与柠檬醛压力对酿酒酵母细胞膜转运蛋白的影响类似[14]。麦角固醇是真菌细胞膜的主要成分之一,它被认为对调节细胞的结构、渗透、生长和增殖至关重要[18]。在本研究中,参与麦角固醇生物合成的大多数基因(ERG1~4)的表达水平被上调(表1),这说明酿酒酵母在0.6 g/mL高糖压力下可能增加合成麦角固醇,这与文献[2]报道的鲁氏接合酵母通过上调麦角固醇合成的相关基因来应对高渗压力类似。麦角固醇与脂肪酸两者比例的变化已被报道影响细胞膜的流动性[2],这也进一步说明0.6 g/mL高糖压力影响细胞膜流动性,但是细胞膜流动性对细胞响应高渗压力的具体作用机制尚待进一步研究。此外,如图5所示,GO分析前30条下调的GO分类,纵坐标表示GO术语,横坐标表示每个GO术语的差异基因数量,“*”显示显著性,观察到多达393个DEGs富集在膜组分GO分类上且均被下调(图5),这些DEGs可能在膜上发挥功能。上述细胞膜基因的显著变化,结合试验中发现的脂肪酸、麦角固醇等成分的基因在高渗胁迫下的差异表达,支持了双染试验中发现的细胞膜损伤的现象(图2)。

图4 细胞壁完整性(CWI)信号通路在不同压力下的转录表达Fig.4 Cell wall integrity signaling pathway with transcriptomic expression changes during different stresses
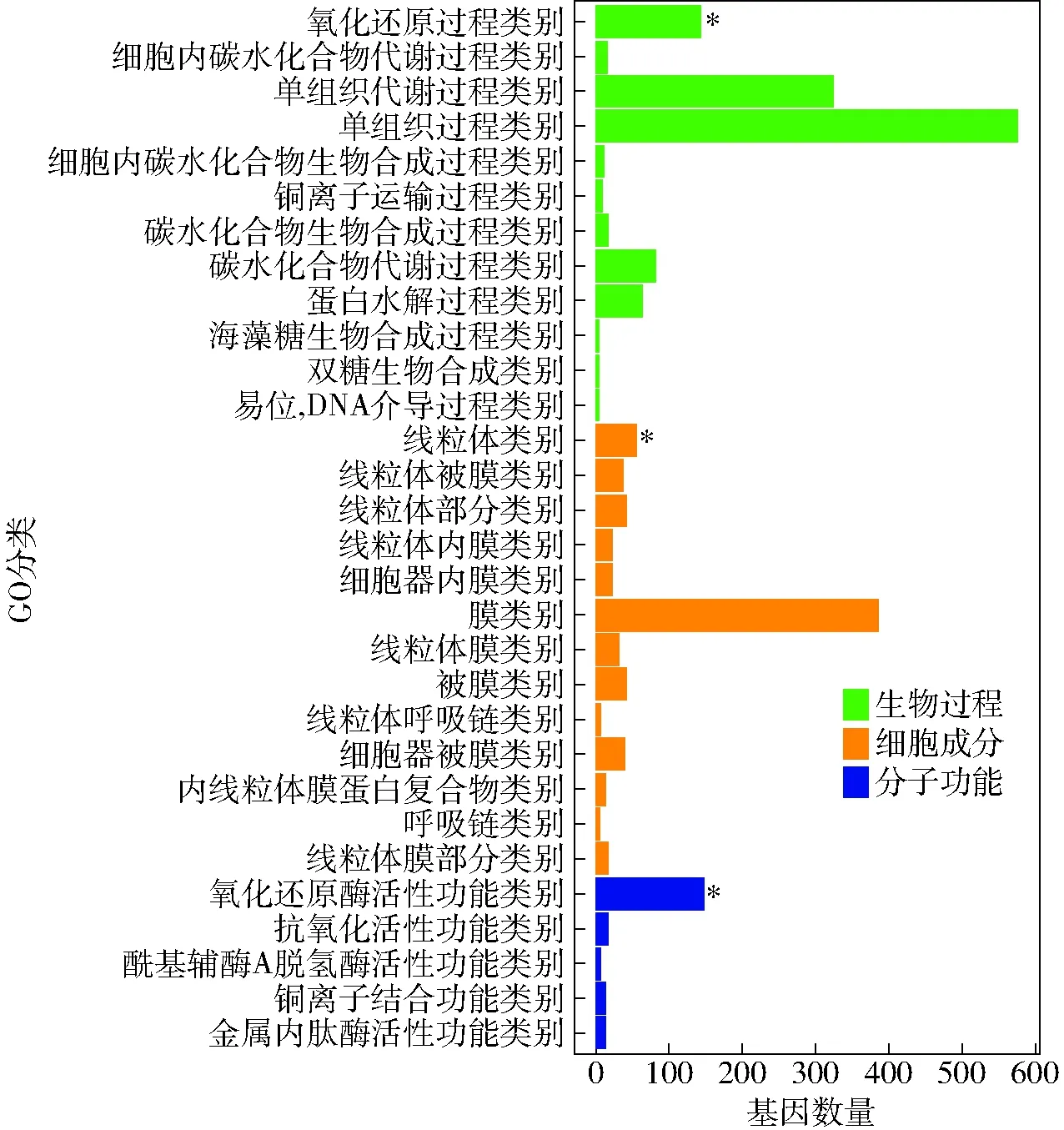
图5 GO功能分类分析下调的差异基因Fig.5 GO functional classification of down-regulated DEGs
细胞壁对细胞存活至关重要[14]。它的晶格结构通过纤维素和几丁质链之间强大的氢键网络以及3个壁成分(葡聚糖、甘露糖蛋白和几丁质)之间的共价糖苷键紧密地结合在一起。CFW是一种荧光染料,通过与几丁质和多糖之间的氢键结合到细胞壁[14],但是在真菌中,CFW优先结合位于细胞壁发芽颈中的几丁质[22]。在图1b、1c的细胞壁CFW染色试验中,每个处理组的细胞数量相同,但是有更多的CFW染料与处理组的细胞结合,说明高糖压力处理的酿酒酵母对CFW敏感性增加。文献[23-24]表明白色念珠菌、黑曲霉和许多其它真菌对CFW的敏感性增加表明细胞壁受损。以前的报道还表明几丁质聚合物的晶格结构破裂会削弱细胞壁,从而导致细胞停滞和几丁质在酿酒酵母细胞中的积累[24],这种机制与结果中细胞几丁质含量增加(图1a)和CFW敏感性增加(图1c)的结果一致,而且与已报道的0.6 g/mL高糖压力抑制酿酒酵母生长的结果一致[2,9]。此外,在用极端高糖压力处理酿酒酵母后,细胞壁对葡聚糖特异性裂解酶的降解更敏感,这表明酿酒酵母在极端高糖压力下可能发生了去结晶作用(图1),推测酿酒酵母细胞壁相关的基因可通过调节细胞壁多糖-几丁质层[25]的交联程度来应对高渗压力。
酿酒酵母在极端高糖压力下的转录结果进一步表明细胞壁正在承受压力。在这项研究中发现的13个差异表达基因(HSP12、CWP1、PIR3、CRH1、GFA1、PST1、SLT2、SRL3、MLP1、YPL0882、PRM5、YHR097C和FBP26)同属于文献[26]报道的一个包含20个特征基因的基因簇,这20个特征基因代表了细胞壁正在承受压力的转录指纹图谱,其中有一些特征基因直接参与细胞壁完整性(CWI)信号通路(图4d)。在极端高糖压力下,酿酒酵母抑制了细胞表面传递压力信号的鸟嘌呤核苷酸交换因子ROM1(表1),然后它下游的RLM1被抑制(表1)。RLM1的6个靶标基因(PIR1、CWP1、PIR3、SPS100、FIT2和YGP1)下调表达,特别是细胞壁组织和稳定性所必需的PIR3和YGP1分别下调了12.6倍和5.8倍(图4d和表2)。研究表明RLM1是编码负责输出CWI大部分转录基因的关键转录因子[21]。图4还显示了酿酒酵母依赖RLM1调节的CWI信号传导途径在不同压力因子下的差异调节。酿酒酵母在0.6 g/mL高糖压力下生长受到抑制甚至开始凋亡[2,9],在试验中(0.6 g/mL糖压力下)RLM1转录因子下调表达,同时也造成由RLM1转录的靶标基因发生改变。酿酒酵母在0.2 g/mL 和0.4 g/mL糖质量浓度下均生长良好,并没有发生RLM1转录因子的改变以及大多数由RLM1转录的靶标基因的改变[7-8],这些结果说明了酿酒酵母在进一步的糖压力下RLM1被抑制并失去了维持细胞稳定的能力。
4 结束语
本研究测定了在0.6 g/mL极端高糖压力下酿酒酵母细胞壁组分的变化,采用染色试验和酶降解试验研究了细胞壁(膜)的结构变化,并通过全局转录文件对发现的表型结果进行分析讨论。结果表明,在0.6 g/mL极端高糖压力下,通过下调酿酒酵母与细胞壁完整性(CWI)信号传导途径、细胞膜成分相关的基因(ROM1、RLM1、PIR3、YGP1、CWP1、PDR15、YOR1等),进行细胞壁(膜)高渗损伤的应激反应,0.6 g/mL极端高糖压力改变了酿酒酵母细胞壁特性和细胞膜流动性。本文为进一步研究酿酒酵母的高渗胁迫应对机制奠定了基础。

