小麦抗白粉病及分子标记研究进展
周军 徐如宏 谢鑫

摘要:小麦白粉病是威胁小麦的主要病害。实践证明,选育和应用抗病品种是解决小麦白粉病最经济、安全、有效的措施。近年来,分子标记技术的快速发展为小麦抗白粉病基因的研究奠定了基础。对小麦白粉病菌的形态特征、毒性频率、抗性基因来源、染色体定位、生理抗性、抗性基因应用等方面研究进展进行了综述,旨为小麦抗病育种提供参考依据。由于病原菌生理小种极容易变异,导致克服寄主原有抗性,可通过基因聚合使不同抗性基因实现有效结合,拓宽其抗谱,提高其抗性持久性,对小麦白粉病抗性研究具有重要理论和实践意义。
关键词:小麦;白粉病;分子标记
中图分类号:S512.1 文献标识码:A
文章编号:0439-8114(2020)06-0010-06
DOI:10.14088/j.cnki.issn0439-8114.2020.06.002 开放科学(资源服务)标识码(OSID):
Research advances on wheat powdery mildew resistance and molecular markers
ZHOU Jun,XU Ru-hong,XIE Xin,REN Ming-jian
(College of Agriculture,Guizhou University/Guizhou Sub-center of National Wheat Center,Guiyang 550025,China)
Abstract: Wheat powdery mildew is the main disease that harms the field of wheat. It has been proved that breeding and application of resistant varieties are the most economical, safe and effective measures to solve wheat powdery mildew. In recent years, the rapid development of molecular marker technology has laid the foundation for the research of resistant genes of wheat powdery mildew. The morphological characteristics, virulence frequency, source of resistance gene and chromosome location, physiological resistance and application of resistance gene of wheat powdery mildew were reviewed, in order to provide reference for wheat disease resistance breeding. Because the physiological races of pathogenic bacteria are extremely susceptible to mutation, which leads to overcoming the host's original resistance, different resistance genes can be effectively combined through gene aggregation, the resistance spectrum can be broadened, and the resistance can be lasted. And it is of great theoretical and practical significance to study the resistance of wheat powdery mildew.
Key words:wheat; powdery mildew; molecular markers
小麥白粉病是由禾本科布氏白粉病菌(Blumeria graminis)引起的气传性真菌病害,具有发生强度高、流行范围广等特点,严重威胁中国小麦生产。世界各主要麦产区均有白粉病发生,产量损失2%~5%;白粉病发生严重的欧美地区,小麦产量减产达20%[1]。化学防治及其他防治措施虽已取得阶段性的成效,但实践证明,选育和推广抗病品种是解决白粉病危害最经济、安全、有效的措施。本文综述了小麦白粉病的危害、抗性基因发掘和利用等方面的研究进展,展望了小麦抗病育种的方向,旨在为小麦抗白粉病研究提供参考。
1 小麦白粉病发生概况
20世纪60年代,小麦白粉病(真菌气传性病害)仅发生在西南地区。随着小麦矮秆品种的推广和栽培技术的提高,使株间环境更有益于白粉病孢子的传播,危害日渐加重[2,3]。
1.1 小麦白粉病菌的形态特征
小麦白粉病菌为专化性活体寄生菌。电镜扫描观察小麦白粉病菌的微观形态,发现其菌丝体主要附着于叶片正面,依靠吸器汲取营养供其生长[4]。与菌丝体垂直的分生孢子梗端,串生单胞无色的分生孢子。白粉病菌的繁殖世代分为两类:即无性与有性。无性世代中其形态为串珠状粉孢菌,依靠分生孢子的增长[5];有性世代中,病菌形态呈球状、无孔的闭囊壳[6,7]。
1.2 小麦白粉病的发生规律
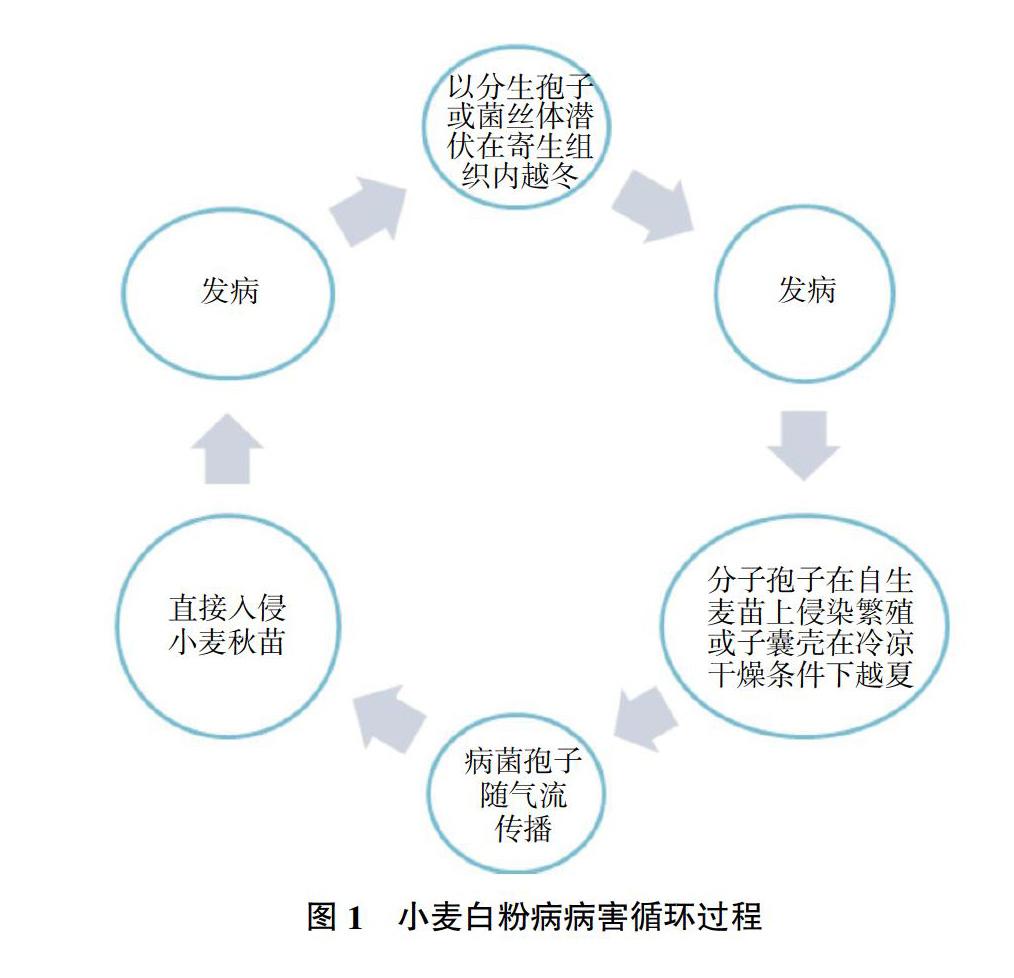
小麦白粉病菌的子囊孢子或分生孢子可借助气流传播。因分生孢子寿命短暂,不耐高温,只能附着于闭囊壳或春生麦苗上顺利越夏[8-10]。小麦白粉病菌越冬形式主要有以下两种:一是分生孢子(无性孢子)的形态;二是潜伏在宿主体内的菌丝体,并且两种越冬形式均能成功越冬。小麦白粉病病害循环过程如图1所示[9]。
2 小麦白粉病菌的毒性研究
在20世纪30年代,国外学者Stakman创建病原菌生理小种的鉴别标准(通过寄主的表现型鉴定)。随后,诸多学者根据鉴定标准对白粉病菌做了大量研究。如1956年Flor提出“基因对基因”假说,即寄主与病菌存在相互对应的关系。Wolfe等[11]根据“基因对基因”假说,提出毒性基因分析法的理念。Persaud等[12]、Parks等[13]研究发现,美国的小麦白粉病菌对Pm3a、Pm3c、Pm5a等基因的毒性频率高。
由于病原菌生理小种变异速度快、幅度大,难以掌控毒性基因的动态变化,因此国内学者着手研究白粉病菌的毒性频率[14]。通过采集不同白粉病菌的生理小种,鉴定发现毒性基因V1和V5的毒性频率达90%以上;V2、V4、V2+6毒性基因频率低[15]。毒性频率因地域不同,存在差异[16]。在东北春麦区中,其毒性基因(V3c、V3f、V5、V8等)频率达50%以上,V2、V4a、V5+6等毒性频率低,可作为有效的抗性来源[17,18]; 湖北省麦区的小麦白粉病菌的毒性基因(V2、V4b、V13等)频率低于25%;甘肃省中西部春小麦白粉病菌毒性频率分布在16.7%[19];新疆小麦白粉病菌群体中,抗性基因Pm16和Pm21的毒性频率为0,可作为优秀的抗源[20]。小麦白粉病菌群体时刻处于变化的状态,因此掌握遗传群体结构和毒性频率的变化,对合理布局抗源具有重要意义。
3 小麦白粉病的抗性研究
3.1 小麦白粉病的生理抗性
植物具有主动防御机制,响应病原菌侵染时,体内的生长调节剂、类黄酮等生物合成途径发生改变,激活其防御机制及增加防御反应的代谢物[21]。几丁质酶参与植物体内重要免疫反应,能抑制病原菌的吸器数量及菌丝体的生长,对增加病程相关蛋白有促进作用,降低寄主应答几丁质诱导的免疫反应[22,23];李新燕等[24]通过Western杂交体系检测小麦近等基因系(含Pm21),结果发现供试材料中均含有几丁质酶,表明几丁质酶与白粉病菌侵染密切相关。
根据“基因对基因”假说,植物的抗病性由抗病基因与病原菌的无毒基因共同作用决定。这种主动抗病机制分为3个阶段:①病原菌与寄主的初识别;②无毒基因与抗性基因特异性识别;③寄主植物产生系统获得抗性或诱导系统抗性(ISR)[25]。
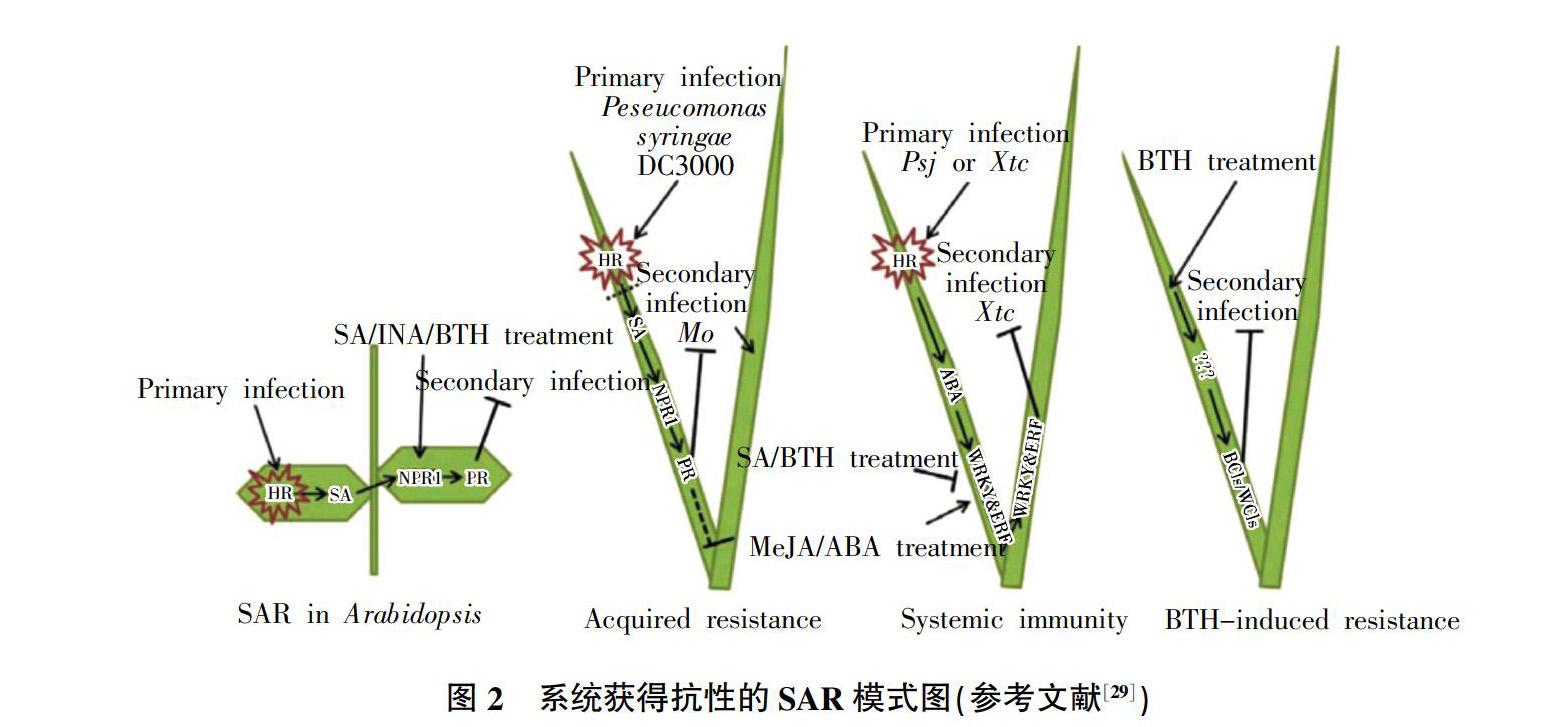
麦类作物响应白粉病菌侵染时,其免疫体系产生系统获得抗性(SAR)。SAR过程的关键调控因子NPR1蛋白,是调节植物整体抗病性的重要作用因子,参与植物多种抗性代谢通路,是多个抗病信号传导通路的交叉点。若作物(小麦)缺失NPR1的功能,将导致相关蛋白PR基因表达不完全和响应病害侵染时,系统获得抗性(SAR)的作用全部丧失[26]。在麦类作物中,可观察到3种类似SAR(图2)现象,即获得抗性(AR)、系统免疫(SI)及BTH诱导抗性(BIR)。3种现象虽与植物SAR相似,却存在明显的差异,推测是由不同基因通路调控。小麦应对白粉病菌侵染时,不仅产生系统获得抗性,同时激活免疫系统中的核苷酸结合位点类受体(NLR),病原物的效应子被LRR区域识别结合,触发植物的防御机制[27]。病原菌侵染或水杨酸类似物BTH处理均能诱导植株产生对白粉病、叶锈病、赤霉病等多种植物病害的广谱抗性[28,29]。
在小麦与白粉病菌的相互作用中,抗性基因(如Pm3)所编码的核苷酸与富含亮氨酸的重复型受体相结合,能赋予植株对白粉病的抗性,并且抗性基因的每个位点都能赋予对不同株系分离单株的抗性[30]。通过植物体内泛素化机制,调节HvARM1基因的表达活性,提高对白粉病的抗性[31]。相关学者通过分离编码WDR蛋白的TaHOS15,瞬时诱导基因沉默敲低TaHOS15表达,减弱小麦对白粉病菌的易感性;TaHOS15可能还作为衔接蛋白寡聚TaHDA16到小麦防御相关基因中,抑制组蛋白乙酰化,增强防御相关转录及对白粉病的抗性[32]。不少学者通过病毒诱导基因沉默,沉默主要负责CHH甲基化的重组酶DRM2,结果发现DRM2下降增强了植物对白粉病菌的抗性,揭示了DNA甲基化参与调控活体寄生类真菌抗病应答的新机制[33]。
3.2 小麦抗性基因来源及其染色体定位
小麦抗白粉病基因分布在小麦基因组中。除3D和4D染色体外,其余染色体均存在抗性基因位点[2]。小麦抗白粉病基因主要来源于普通小麦族及其近缘种属,分为3類,即小麦近缘种、普通小麦和小麦近缘属,详见表1[34]。
小麦抗白粉病基因杂乱分布在染色体上。由表2可知,第2、7染色体组的抗性基因位点最多;第1、3、4染色体组的抗性位点少。从抗性基因分布情况看,A、B染色体组的抗性基因位点较多。3D和4D染色体上尚未发现抗性基因位点。其中,Pm10、Pm11等抗性基因只对冰草白粉病菌产生抗性。来自黑麦的Pm17和Pm8抗白粉病基因均被Heun等[35]和Hsam[36]等定位于1RS。由于抗性基因来源不同、表达程度不同,因此对小麦白粉病菌的抗性存在差异。
3.3 小麦白粉病抗性基因研究
3.3.1 质量抗性基因 质量抗性基因抗性水平好、遗传力较好、选育方便,是当前生产上选育的主要形式。根据“基因对基因假说”,质量抗性由小种专化性基因控制,将其命名为“Pm(Powdery mildew)”。迄今为止,共发现110个主效抗白粉病基因,其中62个基因被命名(Pm1~Pm62)、7个基因含有多个抗性位点及8个新被挖掘的抗性基因(Pm55、Pm56、Pm57、Pm58、Pm59、Pm60、Pm61、Pm62),即Pm1(Pm1a~Pm1e)、Pm2(Pm2a~Pm2c)、Pm3(Pm3a~Pm3j)、Pm4(Pm4a~Pm4d)、Pm5(Pm5a~Pm5e)、Pm8(Pm8~Pm17)和Pm24(Pm24a~Pm24b),分别位于7A、5D、1A、4A、7B、1R和1D染色体上;新抗性基因Pm59[37]、Pm58[38]、Pm57[39]、Pm56[40]、Pm55[41]、Pm62[42]、Pm61[43]、Pm60[44]被分别成功定位于7AL、2DS、2S、6RS、T5VS·5AL、2VL、4AL染色体上。根据紧密连锁分子标记的物理定位信息,许多研究学者对抗病基因或其等位基因进行物理定位分析,确定62个抗性基因在小麦染色体上的物理位置。
3.3.2 数量抗性基因 数量抗性又称水平抗性、成株抗性[4,7,45]。小麦白粉病的数量抗性没有质量抗性明显,主要表现为阻碍病菌在植株上的侵染、生长及繁殖。成株期抗性由微效多基因控制,以加性效应为主[46,47],为非专化性。成株抗性具有广谱抗性基础,抗性持久。相较质量抗性,数量抗性易受环境影响。随着QTL分子标记技术的发展,相关研究者已发现140个抗白粉病QTL,分布于小麦21条染色体,其中4个QTL已被证实并在部分地区或单位广泛应用,为兼抗小麦种质资源的选育提供理论支撑[34]。
3.3.3 数量抗性基因的作用机理 有关学者认为数量抗性即成株抗性,可能是系统获得抗性或者诱导系统抗性,亦或是两种抗性机制与周围环境共同作用决定。其中“SAR”诱导的抗性反应与植物防御体系有关;ISR与土壤微生物、植物次生代谢有关,并伴随抗病相关基因(如NPR1)的表达[48]。研究表明,在烟草[49]、大豆[50]等作物体内存在类似成株抗性的体制。在小麦体内尚未发现,有待进一步探索发掘。
4 小麦抗白粉病分子标记应用
随着DNA分子标记技术的不断成熟与发展,被广泛应用于小麦传统育种。研究者利用相关分子标记检测99份育种材料,结果发现,只有4份材料携带抗病基因,其余材料未发现任何抗病基因[51,52];隋建枢等[53]运用特异性标记,对F2群体194个单株进行检测,发现标记SCAR1265与抗白粉病基因Pm21呈共分离状态;曹廷杰等[54]利用相关分子标记检测908份供试材料,发现只有少量材料携带广谱抗源基因Pm21;刘易科等[55]利用相关分子标记检测湖北省小麦主要品种,发现所用标记均可在参试材料中检测出相应基因。相关研究者先后利用特异性分子标记,筛选出若干抗源材料,为小麦抗病育种奠定了基础[56-59]。
国内不少学者对分子标记筛选进行了大量的研究。如利用SSR标记对小麦F2代群体进分析,筛选到与抗病基因紧密连锁的分子标记[60-63];利用分子标记对小麦F2代群体进行PCR分析,获得与抗白粉病基因Pm6、Pm4a、Pm16紧密连锁的特异性标记[64-67];殷贵鸿[68]、陈松柏等[69]采用不同的抗病基因标记对后代群体进行连锁遗传分析,估算抗病基因与分子标记的相对遗传距离。因此,筛选与抗病基因连锁的分子标记的相关研究奠定了分子标记辅助选择的基础。
5 小麦抗白粉基因的克隆
随着现代分子生物技术(如克隆)的广泛应用,小麦白粉病抗性基因被相继克隆,如Pm21[70]、Pm38/Lr34/Yr18/Sr57/Ltn1、Lr67/Yr4/Pm46/Sr55、Pm60[44]。特别是兼抗叶锈病、白粉病、秆锈病的成株抗性基因的克隆,为小麦兼抗种质资源的筛选奠定基础。
6 展望
6.1 小麦白粉病菌生理小种的动态监测
由于中国独特的气候与环境,导致白粉病菌生理小种基因突变或遗传重组,与寄主协同进化,使抗性基因失去作用[71]。若产生新生理小种或白粉病菌群结构改变,将给农业生产带来毁灭性的后果。因此,必须监测小麦白粉病菌生理小种毒性基因频率,掌握该菌群体遗传结构的动态变化,才能正确使用抗病材料,避免盲目利用抗源。
6.2 小麦白粉病抗源多样化
小麦白粉病菌生理小种时常变化易使生产上推广的抗病品种失去抗性,对小麦产量造成威胁。因此,国内外学者针对小麦的垂直抗性,产生了几点设想:①抗源的合理分布;②选育、推广多系品种及利用混合品种;③国内外收集、积累抗源。抗病育种实践证明,由多个抗病基因控制的复杂抗性比单个基因的抗性更稳定、持久。国内学者针对中国小麦白粉病菌新生理小种产生等问题,提出应加强收集、利用“二线抗源”[72]的方案,注重多基因水平抗性的研究和選育,借以解决持久抗性的问题。
6.3 抗性基因差异
不同类型的抗病基因存在抗性质量或抗谱能力差异,导致其利用时间、地域也不尽相同。据普查,贵州大学农学院麦作研究中心于2007年选育的贵农19号小麦品种(黔审麦2007002)在田间对白粉病表现出高抗甚至免疫,作为稳定持久的抗源,被很多育种单位利用。若抗性基因的抗谱基础狭窄,则难以应对复杂多变的生理小种。特此建议尽量从小麦近缘属中寻求具有广谱抗性基础的抗性基因,作为小麦抗白粉病育种的有效抗源。
6.4 基因聚合育种
病原菌的高度变异性和抗性资源的不恰当使用,致使小麦抗病育种面临抗源匮乏、抗谱遗传基础狭窄的威胁。育种家们应遵循“滚动回交育种”[73]的策略,广泛收集不同类型的高质量抗性基因,运用MAS的技术优势,使不同抗性基因通过基因聚合手段实现有效结合,不仅可弥补抗性基因间的差异,还能提高抗病基因强度,延长抗性基因使用寿命,使抗病表现更加持久,保证小麦抵御病害的能力。因此,应以基因聚合育种为主,常规育种为辅将作为今后抗病育种工作的重要方向。基因聚合育种虽已取得阶段性的成效,但大部分仍停留在理论研究中,这需要育种工作者们在今后的工作中不断努力探索,将理论成效转化为实践。
参考文献:
[1] 王宏梅.贵农6号小麦抗白粉病基因的分子标记[D].贵阳:贵州大学,2009.
[2] 申晓柯.小麦白粉病新抗源的遗传分析及抗性基因的分子标记定位[D].成都:四川农业大学,2013.
[3] 刘万才,刘振东,黄 冲,等.近10年农作物主要病虫害发生危害情况的统计和分析[J].植物保护,2016,42(5):1-9.
[4] 王保勤.兰考906抗白粉病新基因的分子标记筛选[D].郑州:河南农业大学,2008.
[5] 巢凯翔.三个小麦品种(系)抗条锈病和白粉病基因的遗传分析和分子作图[D].陕西杨凌:西北农林科技大学,2018.
[6] 郝元峰.小麦抗白粉病基因的分子标记定位及标记辅助选择[D].济南:山东农业大学,2008.
[7] 马宏棋.普通小麦抗白粉病新基因的发掘和分子标记定位[D].南京:南京农业大学,2010.
[8] 黄苗苗.甘肃省小麦白粉病菌的温度敏感性及其抗病性遗传分析[D].兰州:甘肃农业大学,2015.
[9] 才旦卓玛.2012年小麦白粉病菌温度敏感性和遗传多样性的相关性研究[D].西宁:青海大学,2014.
[10] 杨美娟,黄坤艳,韩庆典.小麦白粉病及其抗性研究进展[J].分子植物育种,2016,14(5):1244-1254.
[11] WOLFE M S,SCHWARZBACH E.Patterns of race changes in powdery mildews[J].Annu Rev Phytopathol,1978,16:159-180.
[12] PERSAUD R R.Virulence genes and virulence gene frequencecies of Blumeria graminis f.sp.tritici in Ohio[J].Plant disease,1995,79(5):494-499.
[13] PARKS R,CARBONE I,MURPHY J P,et al.Virulence structure of the eastern of U.S. wheat powdery mildew population[J].Plant disease,2008,92(7):1074-1082.
[14] 段雙科,许育彬,吴兴元.小麦白粉病菌致病毒性和抗病基因及抗病育种研究进展[J].麦类作物学报,2002,22(2):83-86.
[15] 郭建国.甘肃中部小麦白粉病流行影响因素初步探讨及我国部分麦区小麦白粉菌抗药性监测[D].兰州:甘肃农业大学,2005.
[16] 肖仲久.贵州省小麦白粉菌群体多样性分析及品种抗性研究[D].贵阳:贵州大学,2006.
[17] 魏松红,曹远银,牟连晓.东北春麦区小麦白粉病菌生理小种鉴定及毒性基因分析[J].植物保护学报,2006,33(1):27-31.
[18] 季宏平,孟庆林,王 芊,等.黑龙江省小麦白粉病菌毒性结构和毒力频率研究[J].黑龙江农业科学,2007(3):49-52.
[19] 王 龙,王生荣,甘丽萍.甘肃中西部春小麦白粉菌群体毒性分析[J].西北农业学报,2005,14(1):106-110.
[20] 王振花,刘 伟,高海峰,等.新疆小麦白粉病菌群体的毒性监测和分析[J].新疆农业科学,2017,54(10):1903-1910.
[21] YUAN H J,ZENG X Q,YANG Q F,et al.Gene coexpression network analysis combined with metabonomics reveals the resistance responses to powdery mildew in Tibetan hulless barely[J].Scientific reports,2018,8(1):14928.
[22] TOYDA H,MATSUDA Y,RAMAGE T,et al.Suppression of powdery mildew pathogen by chitinase microinjection into barely coleoptileepidermal cells[J].Plant cell reports,1991(10):217-220.
[23] SCHMMBAUM A,MAUCH F,VOGELI U,et al.Plant chitinases are potential inhibititors of fungal growth[J].Nature,1986(24):365-367.
[24] 李新燕,陈文品,马正强.小麦白粉菌诱导的几丁质酶同工酶分析[J].南京农业大学学报,2002,25(1):1-4.
[25] 李爱丽.小麦抗白粉病基因同源序列的分离鉴定及分子标记的研究[D].河北保定:河北农业大学,2002.
[26] 韩永光,马利刚,赵 乐,等.植物抗性基因NPR1研究进展[J].安徽农业科学,2018,46(26):18-20.
[27] ZHANG X,DODDS P N,BERNOUX M.What do we know about NOD-like receptors in plant immunity?[J].Annual of review of phytopathology,2017,55:205-229.
[28] GAO J,BI W S,LI H P,et al.WRKY transcription factors associated with NPR1-mediated acquired resistance in barley are potential resources to improve wheat resistance to Puccinia triticina[J].Frontiers in plant science,2018,9:1486.
[29] WANG X D,BI W S,GAO J,et al.Systemic acquired resistance,NPR1,and pathogenesis-related genes in wheat and barley[J].Journal of integrative agriculture,2018,17(11):2468-2477.
[30] KOLLER TERESA,BRUNNER SUSANNE,HEREN GERHARD,et al.Field grown transgenic Pm3e wheat line show powdery mildew resistance and no fitness costs associated with high transgene expression[J].Transgenic research,2019,28(1):9-20.
[31] RAJARAMAN J,DOUCHKOV D,LUECK S,et al.The partial duplication of an E3-ligase gene in Triticeae species mediates resistance to powdery mildew fungi[EB/OL].BioRxiv,2017,https://doi.org/10.1101/190728.
[32] LIU J,ZHI P F,WANG X Y,et al.Wheat WD40-repeat protein TaHOS15 functions in a histone deacetylase complex to fine-tune defense response to Blumeria graminis f.sp.tritici[J].Journal of experimental botany,2019,70(1):255-268.
[33] GENG S,KONG X,SONG G,et al.DNA methylation dynamics during the interaction of wheat progenitor Aegilops tauschii with the obligate biotrophic fungus Blumeria graminis f. sp. tritici[J].New phytologist,2019,221(2):1023-1035.
[34] GUO J,LIU C,ZHAI S N,et al.Molecular and physical mapping of powdery mildew resistance genes and QTLs in wheat:A review[J].Agricultural science & technology,2017, 18(6):965-970.
[35] HEUN M,FRIEBE B,BUSHUK W.Chronosomal location of the powdery mildew resistance gene of Amigo wheat[J].Phytopathology,1990,80(10):1129-1133.
[36] HSAM S L K,ZELLER F J. Evidence of allelism between genes Pm8 and Pm17 and chromosomal location of powdery mildew and leaf rust resistance genes in the common wheat cultivar ‘Amigo[J].plant breeding,1997,116(2):119-122.
[37] TAN C,LI G,COWGER C,et al.Characterization of Pm59,a novel powdery mildew resistance gene in Afghanistan wheat landrace PI 181356[J].Theor Appl Genet,2018,131(5):1145-1152.
[38] WIERSMA A T,PULMAN J A,BROWN L K,et al.Identification of Pm58 from Aegilops tauschii[J].Theor Appl Genet,2017,130(6):1123-1133.
[39] LIU W,KOO D H,XIA Q,et al.Homoelologous recombination-based transfer and molecular cytogenetic mapping of powdery mildew-resistant gene Pm57 from Aegilops searsii into wheat[J].Theor Appl Genet,2017,130(4):841-848.
[40] HAO M,LIU M,LIU J T,et al. Introgression of powdery mildew resistance gene Pm56 on rye chromosome Arm 6RS into wheat[J].Frontiers in plant science,2018,9:1040.
[41] ZHANG R Q,SUN B X,CHEN P D,et al.Pm55,a developmental-stage and tissue-specific powdery mildew resistance gene introgressed from Dasypyrum villosum into common wheat[J].Theoretical and applied genetics,2016,129(10):1975-1984.
[42] ZHANG R Q,FAN Y L,KONG L N,et al. Pm62,an adult-plant powdery mildew resistance gene introgressed from Dasypyrum villosum chromosome arm 2VL into wheat[J].Theoretical and applied genetics,2018,131(12):2613-2620.
[43] SUN H G,HU J H,SONG W,et al. Pm61:A recessive gene for resistance to powdery mildew in wheat landrace Xuxusanyuehuang identifed by comparative genomics analysis[J].Theoretical and applied genetics,2018,131:2085-2097.
[44] ZOU S H,WANG H,LI Y W,et al. The NB-LRR gene Pm60 confers powdery mildew resistance in wheat[J].New phytologist,2018,218(1):298-309.
[45] 张志良.小麦地方品种红蚰麦抗白粉病基因的发掘和定位[D].南京:南京农业大学,2015.
[46] DAS M K,GRIFFEY C A.Diallel analysis of adult-plant resistance to powdery mildew in wheat[J].Crop Sci,1994,34(4):948-952.
[47] DAS M K,GRIFFEY C A.Gene action for adult-plant resistance to powdery mildew in wheat[J].Genome,1995,38(2):277-282.
[48] PIETERSE C M,WEES S C,PELT J A,et al.A novel signaling pathway controlling induced systemic resistance in Arabidopsis[J].Plant cell,1998,10(9):1571-1580.
[49] WYATT S,PAN S,KUC J.β-1,3-Glucanase,chitinase and peroxidase activities in tobacco tissues resistant and susceptible to blue mould as related to flowering,age and ucker development[J].Physiology molecular plant pathology,1991,39(6):433-440.
[50] WARD E W B,STOSSEL P,LAZAROVITS G. Similarities between age-related and race-specific resistance of soybean hypocotyls to Phytophthora megasperma var. sojae[J].Phytopathology,1981,71:504-508.
[51] 张小辉,畅志坚,乔麟轶,等.99份小麦地方品种抗白粉病种质发掘及其分子鉴定[J].山西农业科学,2017,45(5):692-698.
[52] 张小辉.小麦抗白粉病种质资源发掘及其分子标记鉴定[D].太原:山西大学,2017.
[53] 隋建枢,任明见,徐如宏.贵农775抗白粉病基因的分子标记定位[J].贵州农业科学,2013,41(1):4-7.
[54] 曹廷杰,陈永兴,李 丹,等.河南小麦新育成品种(系)白粉病抗性鉴定与分子标记检测[J].作物学报,2015,41(8):1172-1182.
[55] 刘易科,朱展望,佟汉文,等.湖北省主要小麦品种抗病基因分析[J].分子植物育种,2018,16(4):1040-1049.
[56] 张增艳,陈 孝,张 超,等.分子标记选择小麦抗白粉病基因Pm4b、Pm13和Pm21聚合体[J].中国农业科学,2002,35(7):789-793.
[57] 董建力,张增艳,王敬东,等.3种小麦抗白粉病基因聚合体的STS和SCAR标记[J].西北农业学报,2007,16(3):64-67.
[58] 高安礼,何华纲,陈全战,等.分子标记辅助选择小麦抗白粉病基Pm2、Pm4a和Pm21的聚合体[J].作物学报,2005,31(11):16-21.
[59] 董 娜,张亚娟,张军刚,等.分子标记辅助小麦抗白粉病基因Pm21和Pm13聚合育种[J].麦类作物学报,2014,34(12):1639-1644.
[60] 朱玉丽,王黎明,王洪刚.小麦抗白粉病基因Pm5e的SSR标记研究[J].分子植物育种,2008,6(6):1080-1084.
[61] 朱玉丽.小麦抗白粉病基因Pm2和Pm5e的SSR分子标记研究[D].山东泰安:山东农业大学,2007.
[62] 王黎明,朱玉丽,李兴锋,等.小麦抗白粉病基因Pm2的SSR标记筛选[J].植物保护学报,2011,38(3):216-220.
[63] 张军刚,董 娜,闫文利,等.小麦抗白粉病基因Pm13的SSR标记筛选[J].河南农业科学,2014,43(10):62-66.
[64] 王俊美,劉红彦,王 飞,等.小麦抗白粉病基因Pm6的微卫星标记鉴定[J].植物病理学报,2007,37(3):329-332.
[65] 王俊美.小麦抗白粉病基因Pm4、Pm6的PCR鉴定[D].陕西杨凌:西北农林科技大学,2005.
[66] 王 瑞,刘红彦,王俊美,等.小麦抗白粉病基因Pm6的PCR标记鉴定[J].麦类作物学报,2007,27(3):421-424.
[67] 罗瑛皓.小麦抗白粉病基因Pm16的SSR标记定位以及多基因累加体的分子标记辅助选择[D].成都:四川农业大学,2003.
[68] 殷贵鸿.小麦抗条锈病和白粉病基因的分子标记[D].陕西杨凌:西北农林科技大学,2009.
[69] 陈松柏,蔡一林,周荣华,等.小麦抗白粉病基因Pm4的STS标记[J].西南农业大学学报,2002,24(3):231-234.
[70] H G HE,S Y ZHU,Y Y JI,et al.Map-based cloning of the gene Pm21 that confers broad spectrum resistance to wheat powdery mildew[J].BioRxiv,2017,177857.
[71] 兰彩霞.普通小麦条锈病和白粉病成株抗性QTL定位[D].北京:中国农业科学院,2010.
[72] 蔡士宾,程顺和,吴纪中,等.引进小麦白粉病二线抗源的鉴定与改良利用[J].麦类作物学报,2005,25(6):124-128.
[73] 张菲菲. 转抗赤霉病基因小麦的聚合育种和回交转育研究[D].武汉:华中农业大学,2015.

