紫薯组培快速繁殖技术初探
张明菊,孙 青,余 凡
(黄冈师范学院 生物与农业资源学院,湖北 黄冈 438000)
紫薯[Ipomoeabatatas(L.) Lam]属旋花科甘薯属草本植物,薯肉呈紫色至深紫色,是甘薯的一个特殊品种类型,兼有粮食作物、经济作物和药用作物的特点,是食品、医药、化工、轻工、纺织等工业的重要原料。紫薯产量高,用途广,是一种集药用、保健、食用为一体的天然食品[1]。紫薯具有普通甘薯丰富的成分和功能外,还含有多糖、黄酮类物质,并且还富含硒元素和花青素,而硒元素,具有预防高血压、减轻肝机能障碍等功能,花青素具备抗氧化、抗突变、降低血压、保肝护肝、抗癌等多种药理活性[2]。而紫薯在生产过程中,是用块根、藤蔓进行无性繁殖的,易受多种病毒的侵染。当病毒在植物体内累积达到一定程度时就会引起产量下降、品质降低、品种退化[3],严重制约了紫薯的生产和推广应用。
对紫薯进行组培快速繁殖是利用植物组织培养技术来提高繁殖系数,减少病毒危害,从而获得大量健康的繁殖材料用于大田生产。已有文献中这方面研究较少。本研究以欣薯2号紫薯催芽得到的顶芽为外植体,对紫薯外植体进行不同灭菌处理,通过探索诱导培养、增殖培养和生根培养不同阶段激素配比的最佳组合,优化培养基配方,从而建立欣薯2号紫薯组织培养脱毒快速繁殖体系。同时还可以通过组织培养获取大量紫薯细胞,利用生物反应器提取黄酮、花青素等成分。因此,对紫薯进行组织培养研究,不仅可以建立紫薯快速繁殖体系,实现脱毒苗的工厂化生产[4],还能为黄酮、花青素等工业化生产提供重要原料。
1 材料与方法
1.1 供试材料及处理
供试材料为黄石市欣野薯业有限公司提供的欣薯2号紫薯(图1A)。将欣薯2号紫薯埋种在沙土中(图1B),离沙土面2~3 cm,放于恒温箱中进行催芽,隔1~2 d浇水一次,当幼苗长至20~30 cm时,取其顶芽10~15 cm,剪去较大的叶片,取茎段作为外植体材料(图1C)。

图1 欣薯2号紫薯及其组培苗A.紫薯; B.紫薯催芽;C.接种后的茎尖
1.2 培养基的配制
以MS培养基为基本培养基,加入不同配比的细胞分裂素/生长素,细胞分裂素使用6-苄氨基嘌呤(6-BA),生长素用萘乙酸(NAA)或吲哚丁酸(IBA)。此外,还在培养基中加入3.0%蔗糖,琼脂粉的浓度为0.7%。因此,培养基主要成分表示为:MS基本培养基+3.0%蔗糖+0.7%琼脂+一定浓度的NAA+一定浓度的6-BA,调节培养基的pH为5.8。1/2MS表示所有无机盐浓度减半,其他成分不变;2MS表示所有无机盐浓度增加一倍,其他成分不变。
1.3 外植体消毒及接种
消毒:用0.1%洗衣粉液洗涤或加几滴吐温浸泡5 min,用蒸馏水清洗干净,置于超净工作台上进行灭菌。接种:先在烧杯中用75%酒精浸泡30 s,再用2.5%次氯酸钠溶液消毒10 min,最后用无菌水清洗4~5次,在超净工作台上用无菌剪刀剪成1 cm左右茎尖接种在诱导培养基中。
1.4 培养条件
将接种好的培养瓶放在培养室培养,培养温度为25±2 ℃,每天光照12 h,光照强度1500~2000 lx。
1.5 数据调查统计
外植体按照实验设计分别接种20个,接种培养后在固定时间内对外植体材料的萌芽率、增殖倍数、生根率等指标作观察记载并进行统计分析,并据此选择最优培养基配方。
其中:成苗率=成苗外植体数/接种外植体总数×100%;
出芽率=萌芽外植体数/外植体总数×100%;
生根率=生根苗数/总苗数×100%;
成活率=成活株数/总移栽苗数×100%。
外植体在诱导培养基中,20 d后统计出芽数和萌芽率。每个处理接种10个,重复2次,定期观察培养物的生长状况,筛选出适合欣薯2号紫薯诱导培养的培养基组合。
将增殖培养所得的健壮茎芽,转接到添加不同浓度NAA和IBA的生根培养基中,每个处理接种10个,重复3次。30 d后记录根数,并统计生根率。
2 结果与分析
2.1 不同激素配比对紫薯外植体诱导培养的影响
在MS培养基中,首先通过固定NAA浓度0.1 mg·L-1,添加不同浓度的6-BA(0、0.25、0.5、0.75、1.0 mg·L-1),形成A1、A2、A3、A4、A5等组合;再通过固定6-BA浓度0.75 mg·L-1,添加不同浓度的NAA(0.1、0.2、0.3、0.4、0.5 mg·L-1),形成B1、B2、B3、B4、B5等组合,观察不同激素配比的诱导结果(表1)。结果表明,6-BA对欣薯2号紫薯芽萌发有促进作用,接种后,第7 d后顶芽开始伸长(图2A),15 d后叶片展开,叶色浓绿;第7 d后茎段的腋芽也开始萌动,小腋芽点变绿;第14 d后腋芽伸长,叶片展开。
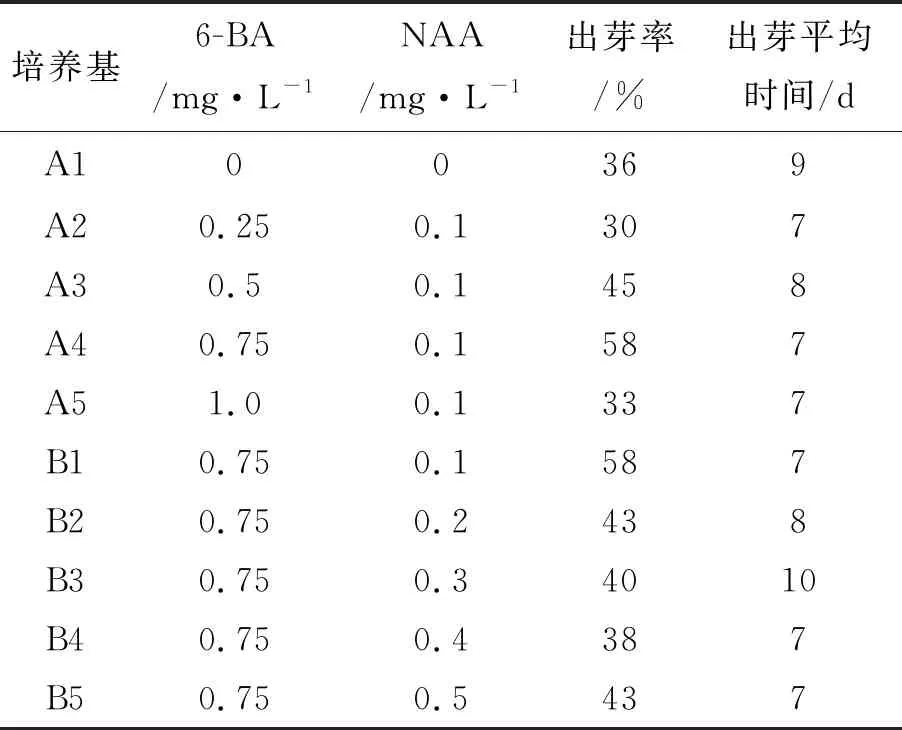
表1 不同6-BA和NAA配比对紫薯茎尖分生组织诱导苗的影响
在固定NAA浓度0.1 mg·L-1时,6-BA浓度为0.75 mg·L-1的培养基对促进顶芽生长的效果最好,出芽率为58%,与对照组相比出芽率增加了1.6倍;但当6-BA浓度达到1.0 mg·L-1时出芽率反而降低(33%)。固定6-BA浓度0.75 mg·L-1,添加不同浓度的NAA时,发现随着NAA浓度的提高,出芽率和出根率有下降的趋势。因此,欣薯2号紫薯茎尖的最佳诱导培养基的组合是:MS+6-BA0.75 mg·L-1+NAA 0.1 mg·L-1。
2.2 不同激素配比对紫薯茎芽增殖继代培养的影响
在紫薯外植体增殖继代培养过程中,首先通过固定NAA浓度0.2 mg·L-1,添加不同浓度的6-BA(0、1.0、2.0、3.0、4.0 mg·L-1),形成E1、E2、E3、E4、E5等激素组合;再通过固定6-BA浓度3.0 mg·L-1,添加不同浓度的NAA(0.1、0.2、0.3、0.4、0.5 mg·L-1),形成F1、F2、F3、F4、F5等组合,观察不同激素配比的诱导结果(表2)。
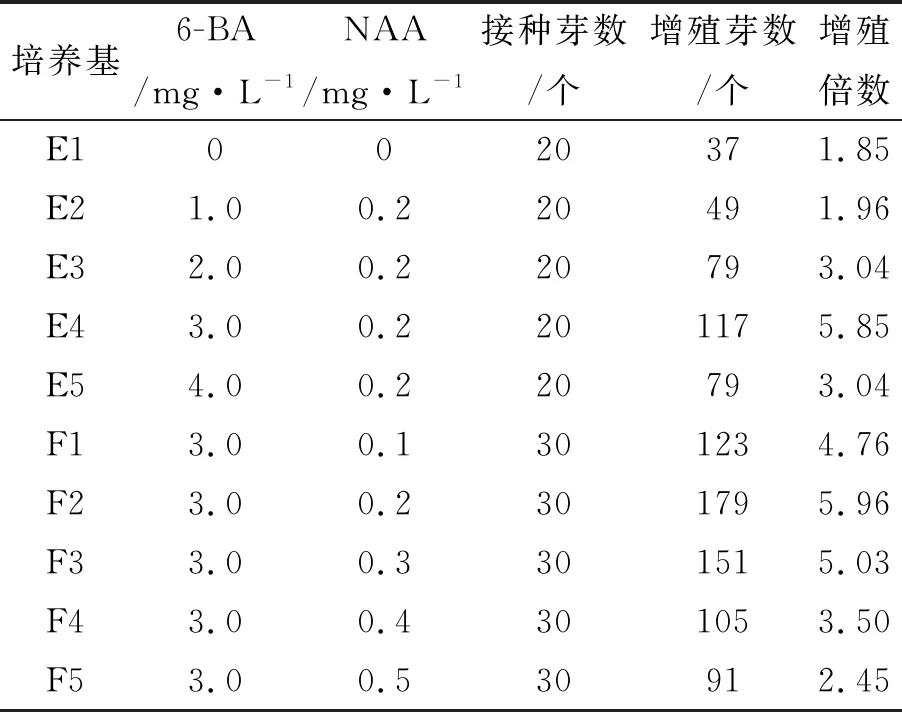
表2 不同6-BA和NAA配比对紫薯继代增殖的影响
结果表明,在不加6-BA和NAA的MS培养基中,腋芽能够萌发生长,但是增殖倍数比添加6-BA的各处理组都低,且萌发芽长势明显较差,这说明细胞分裂素6-BA对紫薯茎芽增殖继代培养起重要作用。但当6-BA浓度为4 mg·L-1时,不仅腋芽增殖倍数下降,还会产生大量气生根,降低了苗的质量。当6-BA浓度固定在3.0 mg·L-1,以NAA浓度为0.2 mg·L-1时,茎芽增殖倍数最高,7 d左右芽伸长0.5~1.0 cm,15 d左右便可以完全展开第一片叶,腋芽长势旺盛,茎粗壮,叶片舒展,叶色深绿,有光泽(图2B)。NAA浓度偏低或偏高均不利于茎芽增殖。因此,欣薯2号紫薯茎芽增殖培养的最佳培养基组合为:MS+6-BA3.0 mg·L-1+NAA 0.2 mg·L-1。
同时,实验发现,当6-BA与NAA以不同浓度在培养基中一起使用时,欣薯2号紫薯增殖芽的诱导效果增强,增殖倍数最高可达5.96,此时6-BA浓度为3 mg·L-1,NAA为0.2 mg·L-1。可以得出欣薯2号紫薯茎尖的继代增殖最佳培养基组合为:MS+6-BA 3.0 mg·L-1+NAA 0.2 mg·L-1。
2.3 不同激素配比和不同无机盐离子浓度对紫薯茎芽生根的影响
将增殖培养所得的健壮茎芽,转接到MS添加不同浓度NAA和IBA的生根培养基中生根培养,30 d后,调查生根情况(表3)。结果表明:茎芽在不添加生长素的MS培养基上也能生根,生根率为32%;在添加不同浓度NAA的MS培养基上,NAA为0.4 mg·L-1时生根率最高,且平均每株生根数也最高;在添加不同浓度IBA的MS培养基上,NAA为0.4 mg·L-1时生根率最高,但平均每株生根数以0.5 mg·L-1最高。因此,在MS培养基中,加入0.3~0.4 mg·L-1的NAA或0.3~0.5 mg·L-1的IBA均可促进紫薯茎芽生根。同时还发现,NAA对紫薯茎芽生根效果更好,苗的长势更强壮(图2C),而IBA处理组的组培苗偏细长,长势较弱。因此,NAA浓度为0.4 mg·L-1更有利于无菌芽的生根。

图2 欣薯2号紫薯组培苗A.诱导的愈伤组织;B.增殖茎芽;C.生根的组培苗
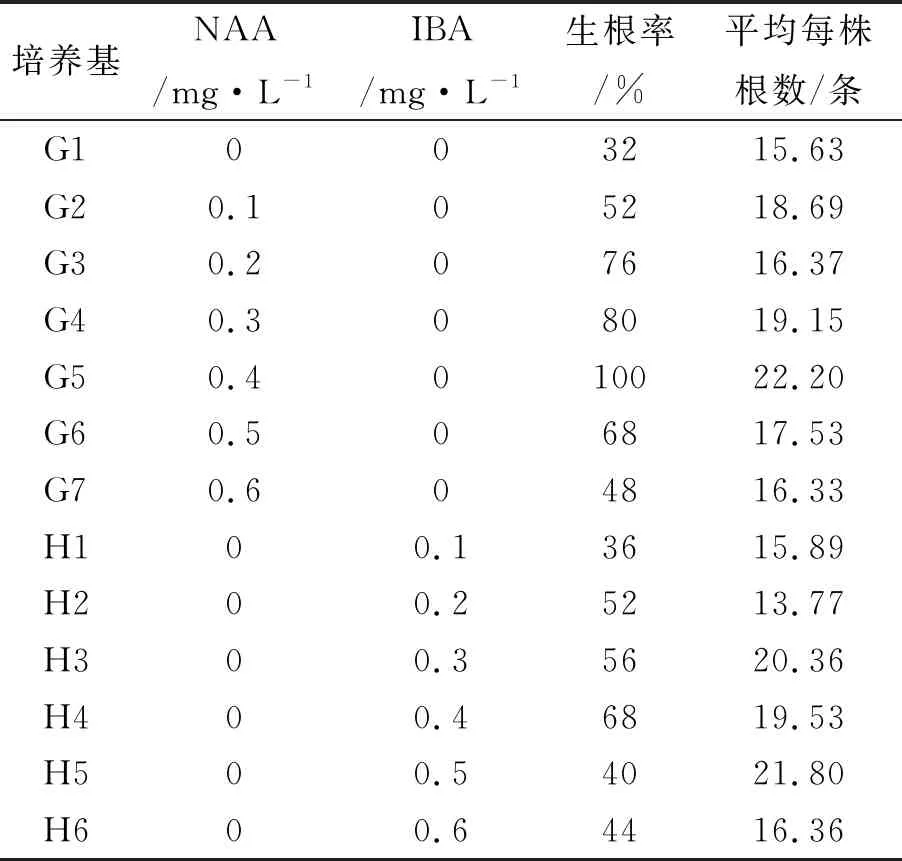
表3 不同浓度的NAA和IBA对无菌苗生根的影响
实验中,将增殖培养所得的健壮茎芽转接到含有NAA 0.4 mg·L-1的三种基本培养基中培养,观察发现,在1/2MS培养基上生根率和平均每株生根数最高(表4)。这说明适当降低培养基中无机盐离子浓度有利于生根。
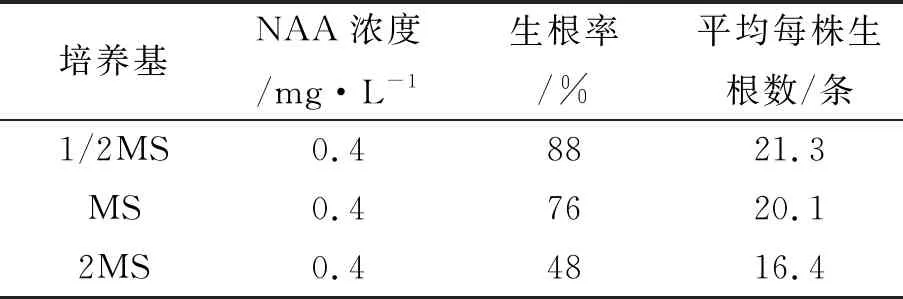
表4 不同无机盐离子浓度对紫薯茎芽生根的影响
3 讨论
外植体的消毒方法一般采用1%HgCl2溶液浸泡,灭菌效果好,成活率高, NaClO处理紫薯茎段的成活率不高,灭菌效果不佳。由于紫薯是一种天然、健康的保健食品,1%HgCl2溶液容易产生重金属离子残留污染等问题,因此实验中探索出欣薯2号外植体的消毒方案为:75%酒精处理30 s+2.5%NaClO溶液处理15 min+无菌水清洗3次。这样得到的欣薯2号紫薯外植体成活率可达75%以上。
在紫薯外植体愈伤组织和茎芽诱导培养及茎芽增殖培养中,MS培养基中不同的植物生长调节剂的配比诱导茎尖分化成苗的是主要影响因素,紫薯茎尖的最佳诱导培养基组合是:MS+6-BA 0.75 mg·L-1+NAA 0.1 mg·L-1,紫薯茎芽增殖培养的最佳培养基组合为:MS+6-BA 3.0 mg·L-1+NAA 0.2 mg·L-1。可见,适度增加细胞分裂素浓度有利于茎芽分化增殖。
欣薯2号紫薯组培苗在不添加任何植物生长调节剂的1/2MS、MS和2MS培养基中,都可以生根,但是生根时间较久,根细长。在三种培养基中添加诱导生根的NAA和IBA,生根时间、根苗质量均有所改善。其中NAA对根的诱导效果较IBA好,根粗壮、苗的长势也较好。浓度实验表明,低浓度的生长素促进细胞伸长,促进生根,而高浓度的生长素抑制生长,甚至有可能导致植株死亡。紫薯无根组培苗最佳NAA生根浓度为0.4 mg·L-1。在添加NAA浓度为0.4 mg·L-1的1/2MS、MS和2MS三种培养基中,以1/2MS的效果最好,说明低浓度的无机盐有利于生根,这与其他研究者的结果存在差异[2-5]。
欣薯2号紫薯在组织培养时也有出现褐化组培面茎细弱和玻璃化现象,褐化主要是因为外植体偏小造成的,外植体越小,其相对表面积越大,与空气接触的面积越大,组织中的酚类化合物越容易被氧化。玻璃化主要是因为组培苗在培养过程中光照不足或继代培养次数过多造成的。
欣薯2号紫薯花青素含量高,产量高,可提取食用色素,加工提取淀粉,茎尖可做蔬菜,茎藤可做猪饲料等,开发利用前景广阔。本研究初步探讨了欣薯2号紫薯茎尖分化、增殖、生根的最适培养基,为该品种的快速繁殖奠定了技术基础。杨强强等研究表明通过胚性愈伤和体细胞胚的诱导可进一步提高徐紫薯8号的繁殖系数[5],这是否可用于欣薯2号紫薯还有待进一步研究。

