淋巴瘤来源外泌体的提取方法比较与鉴定
陈珍珍 谢亚萍 施鹏飞 高大泉 谭俊峰 陈况 刘利蓉 黄细莲 徐颖 钱申贤
外泌体是几乎所有细胞都能分泌的纳米级膜状囊泡,由脂质双分子层及嵌在膜上的跨膜蛋白组成,其内包裹来源细胞的信息分子(蛋白质、mRNA和miRNA等)[1]。外泌体是一个直径在30~100 nm的异质性群体。它作为一种自然载体,在来源细胞与靶细胞间起着信息交流的纽带作用,能转运多种生物成分,如脂类、蛋白质、RNA、miRNA、DNA片段等[2-3]。不同类型细胞来源的外泌体携带着特异性的标志物,在临床诊断、疾病筛查、疾病治疗等方面具有重要作用[4]。因此,研究外泌体的组成成分及其特征对于探索肿瘤、神经退行性疾病、免疫功能障碍等疾病治疗的新策略具有重要意义。但是,外泌体是一种独特的转运载体,其形成和作用机制尚存在争议,目前仍无准确、完整的定义,而提取更是复杂[5-6]。提取外泌体的方法很多,但对几种提取方法的比较研究目前报道较少。因此,本研究对常用的3种方法以及提取到的外泌体生物学特征进行了比较,现将结果报道如下。
1 材料和方法
1.1 细胞株 小鼠B淋巴瘤细胞株A20、人Burkkit淋巴瘤细胞株Raji、人脐静脉内皮细胞株HUVEC购自美国模式培养物集存库(ATCC);人弥漫大B淋巴瘤细胞株 OCI-LY3(DLBCL-nonGCB)和 SU-DHL-16(DLBCL-GCB)由浙江省中医院顾建友教授惠赠。所用细胞株经武汉大学中国典型培养物保藏中心短串联重复序列鉴定。
1.2 试剂和仪器 聚乙二醇(polyethylene glycol,PEG)购自美国Sigma-Aldrich公司,exoEasy试剂盒购自德国Qiagen公司,细胞裂解缓冲液购自美国Cell Signaling公司,RIPA裂解液、考马斯亮蓝快速染色液购自中国碧云天生物技术有限公司,二奎啉甲酸法(BCA)蛋白定量试剂盒购自中国生工生物工程(上海)有限公司,CD63、CD81、Cyto-c、ALIX、TSG101 抗体购自美国 Abcam公司。超高速离心机购自美国Beckman Coulter公司,一次性抽滤器(0.8 μm)购自美国Millipore公司,透射电子显微镜(以下简称电镜)购自日本JEOL公司,凝胶图像分析系统购自美国Bio-Rad公司。
1.3 外泌体提取方法
1.3.1 收集细胞上清液 所有细胞株的培养基中加入双抗,置于37℃、5%CO2恒温细胞培养箱中培养。每1~2 d传代换液。准备提取细胞上清液中的外泌体时,收集处于生长状态良好的细胞,预先换用无外泌体血清的培养基培养细胞48 h后收集上清液。
1.3.2 PEG沉淀法提取外泌体 取细胞上清液,500 g离心5 min,去沉淀物;再2 000 g离心10 min,去细胞碎片;加入1倍体积配置的PEG,充分混匀,4℃孵育2 h;3 000g离心10 min,1 h后收集沉淀物。将沉淀物重悬于PBS中,使用略低浓度的PEG再次聚沉或通过小体系超速离心进一步纯化外泌体。
1.3.3 exoEasy试剂盒提取外泌体 取细胞上清液,先用0.8 μm孔径的滤头过滤,去除细胞、细胞碎片、凋亡小体等;再用试剂盒中溶液与细胞上清液等量上下颠倒混匀、离心过柱,用洗脱液将外泌体从柱上洗脱下来备用。
1.3.4 超速离心法提取外泌体 取细胞上清液,500 g离心5 min,去沉淀物;2 000 g离心10 min,去细胞和细胞碎片;然后依次经0.45、0.22 μm带有聚偏二氟乙烯膜滤膜的滤头过滤;再经超高速离心机100 000 g、4℃离心70 min,收集沉淀物。用PBS洗涤沉淀物,120 000 g离心70 min,最后用PBS重悬沉淀物。
1.4 外泌体形态学观察 (1)切片法:PEG沉淀法提取的外泌体用切片法进行形态学观察。外泌体用PBS洗涤2次,最后1次洗涤前将外泌体悬液转入1.5 ml EP管中。小心吸干上清液,沿EP管壁缓慢加入2.5%戊二醛,将样品放入4℃冰箱固定过夜。次日用吸管吸尽样品固定液,沿管壁小心缓慢加入1 ml PBS并漂洗样品3次,10 min/次;再用 1%锇酸溶液固定 1 h,PBS漂洗3次,10 min/次。随后用5种浓度(30%、50%、70%、90%、100%)的乙醇溶液依次对样品进行脱水处理,每种浓度脱水15~20 min。脱水完毕吸尽乙醇,加入1 ml纯丙酮处理20 min。用包埋剂和丙酮体积比1∶1的混合液处理样品2 h。然后用纯包埋剂处理样本过夜,70℃加热固化聚合过夜,用超薄切片机将样品切成70~90 nm切片,用柠檬酸铅溶液、醋酸双氧铀和50%乙醇饱和溶液依次染色15 min。在电镜下观察处理好的样品。(2)负染法:3种方法提取的外泌体均用负染法进行形态学观察。事先用PBS将外泌体稀释到最佳观察浓度,悬液滴在铜网上,2 min后用滤纸吸干,再滴一滴醋酸双氧铀到铜网上,负染3 min,用滤纸吸干多余液体,室温晾干后在电镜下观察拍照。
1.5 外泌体蛋白表达及分布检测 采用Western blot法。将提取的外泌体经细胞裂解液或RIPA裂解液处理,提取蛋白上清液,使用BCA蛋白定量试剂盒检测浓度后进行高温煮沸变性;变性后的蛋白经上样、垂直电泳,电转移、封闭、一抗和二抗孵育,然后显影,即得到不同蛋白表达的电泳图。提取的外泌体经10%聚丙烯酰胺凝胶电泳(SDS-PAGE)分离后进行考马斯亮蓝染色,可得到蛋白分布图。
2 结果
2.1 PEG沉淀法提取的外泌体形态学观察及蛋白分布特点 在电镜下,PEG沉淀法提取的外泌体负染后呈圆形或椭圆形的囊泡状结构,见图1a。利用切片法处理外泌体标本,见图1b-d;在不同放大倍数条件下观察到有零星散在单个分布的外泌体,但更多的是聚集成群。在电镜下,清晰可见PEG包裹大量的外泌体进而形成外泌体聚合物;外泌体呈现明显的双层膜结构,似茶托状;外泌体的粒径大小与文献报道(30~150 nm)一致[8]。
在PEG沉淀法提取的A20外泌体中,Western blot法检测到标志性蛋白四跨膜家族成员CD63表达且较细胞中更多,同时表达CD81、热休克蛋白HSP-70、GAPDH,但不表达胞质蛋白Cyto-C,见图2。这表明PEG沉淀法提取的A20外泌体内容物符合外泌体的经典特征。

图1 聚乙二醇(PEG)沉淀法提取的A20外泌体形态学观察(a:负染法,×80 000;b、c、d:切片法,放大倍数分别为11 500、20 500、44 000倍;透射电子显微镜)
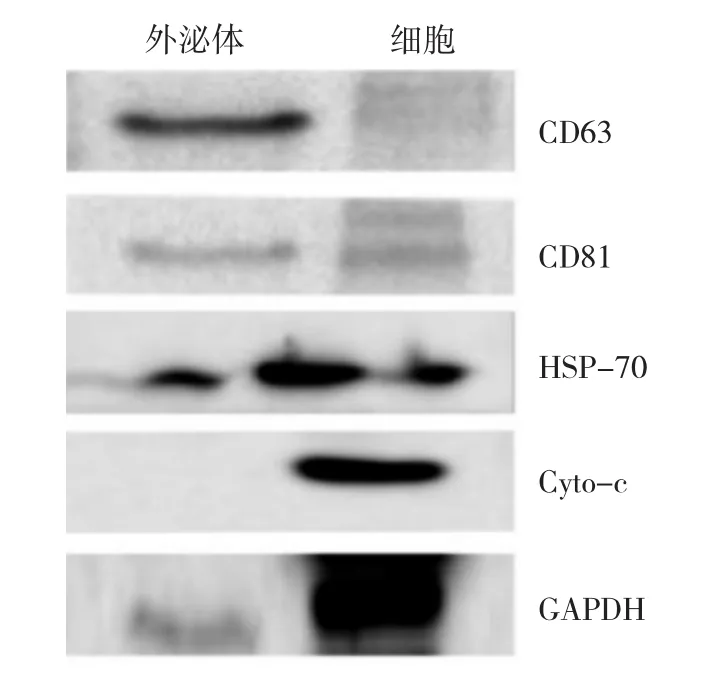
图2 聚乙二醇(PEG)沉淀法提取的A20外泌体表达特征性蛋白的电泳图
由蛋白分布图可见,细胞株的蛋白含量较外泌体丰富,外泌体大部分蛋白集中分布在55~130 kD区域,见图3。再次使用PEG沉淀法分离提取基础培养基1640和IMDM可能存在的外泌体,同样能观察到类似的蛋白条带,见图4。图中外泌体泳道为PEG沉淀的SU-DHL-16外泌体,与细胞泳道(SU-DHL-16细胞株全蛋白)相比,未检测到跨膜四分子蛋白CD81、CD63的表达。
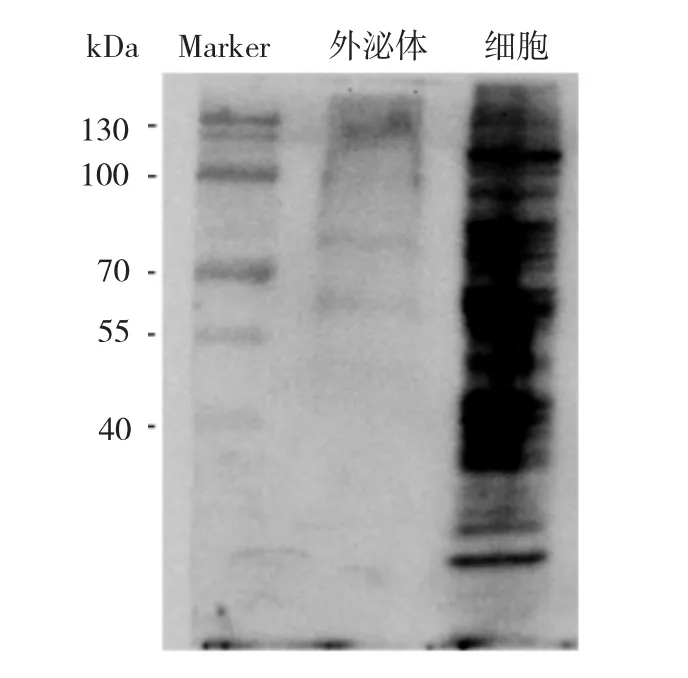
图3 聚乙二醇(PEG)沉淀法提取的A20外泌体蛋白分布图
2.2 exoEasy试剂盒提取的外泌体形态学观察及蛋白分布特点 在电镜下,exoEasy试剂盒提取的外泌体不易观察到典型的膜状结构,平均粒径偏小,而且背景较脏,杂质较多,视野不清晰,可见大片状的聚合物,见图5。
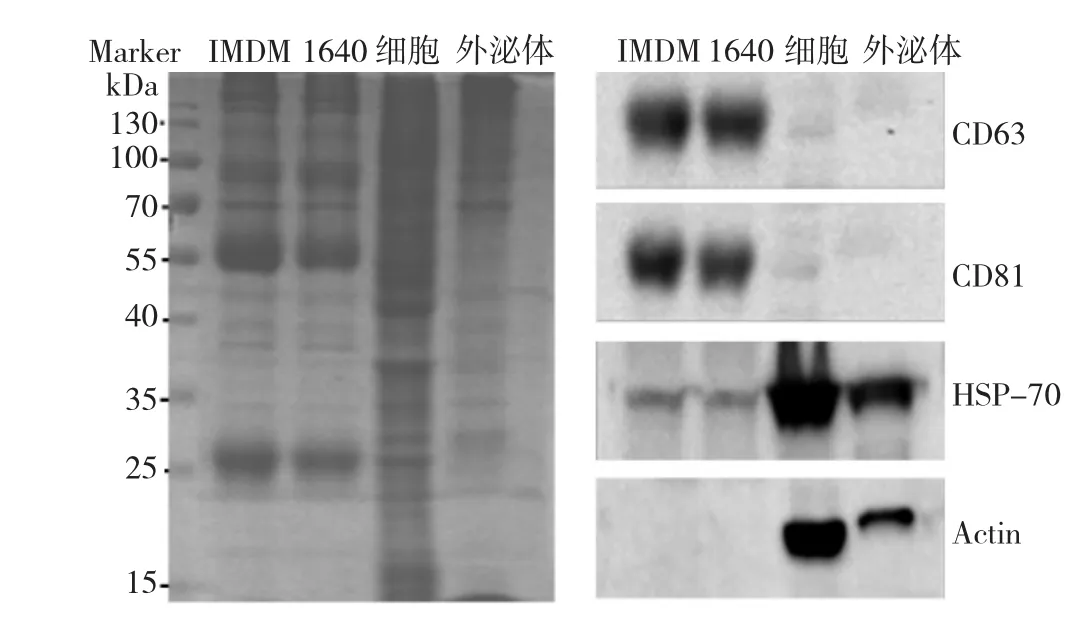
图4 聚乙二醇(PEG)沉淀法提取的基础培养基1640和IMDM可能存在的外泌体蛋白分布图及电泳图

图5 exoEasy试剂盒提取多种细胞株来源的外泌体形态学观察(a:Raji外泌体,×30 000;b:Raji外泌体,×50 000;c:HUVEC 外泌体,×20 000;d:A20 外泌体,×50 000;透射电子显微镜)
Western blot检测发现,exoEasy试剂盒提取的外泌体中CD81、CD63呈弱表达。经考马斯亮蓝染色后,外泌体蛋白条带变淡且模糊,仅见少数几个条带,见图6;提示exoEasy试剂盒提取的蛋白丰度不高,杂质偏多。

图6 exoEasy试剂盒提取的A20外泌体蛋白分布图及电泳图
2.3 超速离心法提取的外泌体形态学观察及蛋白分布特点 在电镜下,可清晰观察到多种细胞株分泌的外泌体,外泌体呈现经典的茶托状或类似球体被踩瘪的形状,粒径约100 nm。外泌体囊泡边缘可见双层膜状结构深染;中央为均质的淡染区,背景清晰,污染物较少;可见外泌体成团聚集的形状,见图7。
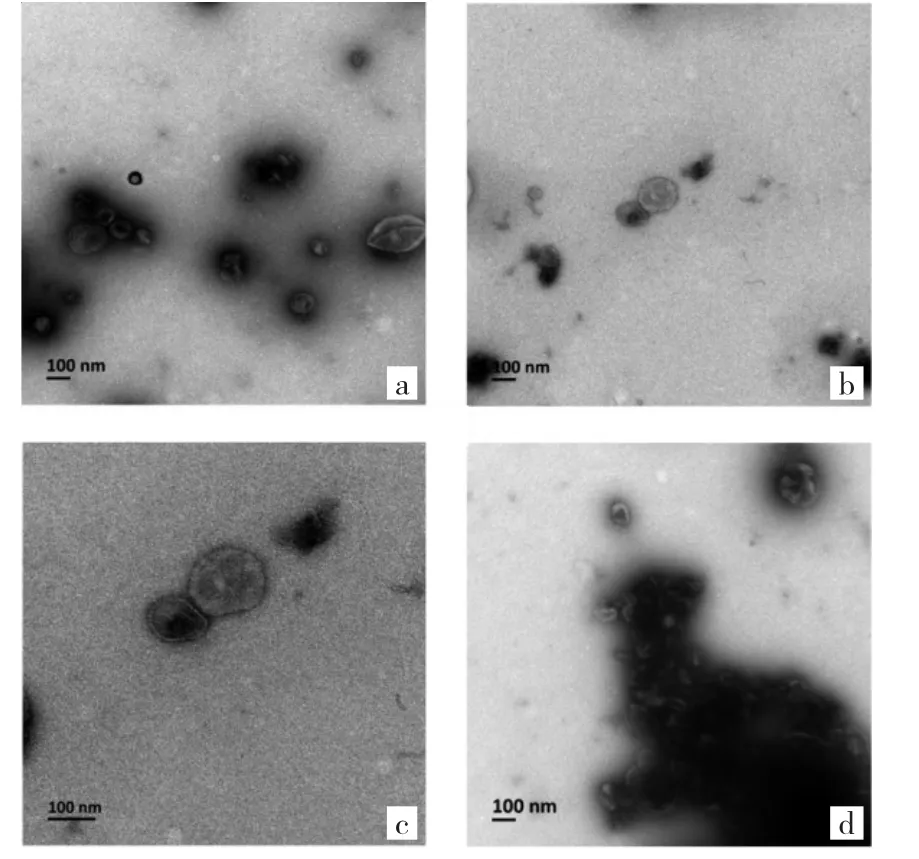
图7 超速离心法提取多种细胞株来源的外泌体形态学观察(a、b:Raji外泌体,×50 000;c:Raji外泌体,×100 000;d:A20 外泌体,×50 000;透射电子显微镜)
Western blot检测发现,超速离心法提取的外泌体中CD63、CD81呈高表达,同时还检测到与囊泡胞吞作用或囊泡形成相关的蛋白TSG101、ALIX表达,而胞质蛋白Cyto-C不表达,见图8。提示该方法提取的外泌体最符合典型特征。
经考马斯亮蓝染色后,蛋白条带呈明显较强的表达,且不同细胞株的外泌体如OCI-LY3外泌体、HUVEC外泌体有相似的蛋白特征条带(条带清晰),提示未受细胞培养基中的杂蛋白干扰,外泌体纯度佳,见图9a。
进一步比较RIPA裂解液或与细胞裂解液处理提取的外泌体蛋白表达情况,发现无明显区别,Western blot检测HSP-70蛋白表达也相似,而细胞裂解液处理提取的外泌体蛋白丰度相对高一些,见图9b-c。提示在对蛋白丰度有要求的实验中,可选用细胞裂解液处理外泌体;对于外泌体中表达量较高的蛋白,可选用RIPA裂解液或细胞裂解液。
3 讨论
淋巴瘤系淋巴组织恶性增殖性疾病,是血液系统中具有高度侵袭性的肿瘤。其临床表现高度异质性,由于缺乏灵敏度高、特异性好的生物标志物,临床上对该疾病的诊断与治疗存在较大的困难。外泌体是细胞分泌的具有独特生物学特征的膜性小囊泡,含有大量与来源细胞密切相关的成分。外泌体起源于细胞内的多泡体,胞膜内陷向胞外出芽释放形成的小囊泡[9]。由于外泌体的膜性结构能阻止蛋白酶等对其携带分子的降解,所以通过对淋巴瘤来源外泌体的研究能更好地了解淋巴瘤的疾病特征,并利用外泌体特性为淋巴瘤免疫疗法提供新的研究方向,以找到特异性的靶标。然而,对外泌体的分离、提取、纯化是研究的前期基础。
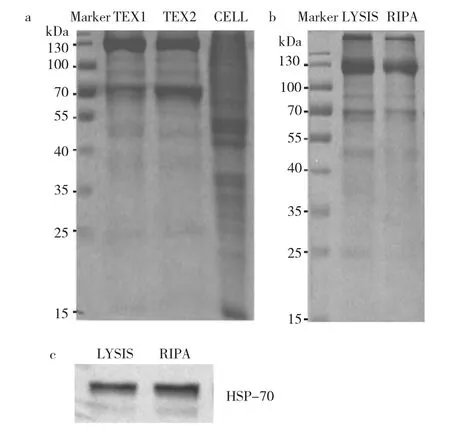
图9 超速离心法提取的OCI-LY3外泌体、HUVEC外泌体蛋白分布图及2种裂解液作用的蛋白表达电泳图(a:TEX1为OCI-LY3外泌体,TEX2为HUVEC外泌体,CELL为OCI-LY3细胞;b、c为OCI-LY3外泌体,LYSIS为细胞裂解液)
目前对于细胞培养上清液或体液(血液、尿液、唾液等)中外泌体成分及功能的研究越来越多,但对于分离提取纯度和效率等基础问题尚未得到很好的解决,且无公认的简便易行的技术方法。现在主流的分离提取方法主要有PEG沉淀法、试剂盒提取法、超速离心法等。利用PEG纯化和浓缩病毒已有50多年的历史,是一种相当成熟的手段[7]。基于外泌体的生物学特性与病毒相似,用PEG纯化病毒的方法尝试包裹沉淀外泌体[10]。Marton等[11]用PEG法提取了外泌体,并与其他方法提取的外泌体进行比较,发现不同方法提取的外泌体生物学特征没有差别,并且PEG沉淀法具有经济、简便易行、产量高的优势。试剂盒提取法的应用较多,操作简便,对仪器设备没有高要求,但是费用较高。exoEasy试剂盒是利用膜的亲和力特性分离外泌体,这种分离方法不是根据外泌体的大小、细胞来源的不同或外泌体表面特异性的表位,而是根据外泌体囊泡的一般生化特性,所以能很好得获得较完整的外泌体并且快速便捷。然而,目前应用最普遍的是超速离心法,基于外泌体的粒径大小,通过不同的离心速度去除较小的细胞碎片和体积较大的囊泡[12-13]。超速离心法获得的外泌体纯度较高,但费时、工作量大,效率不高。
本研究对PEG沉淀法、exoEasy试剂盒、超速离心法提取外泌体的生物学特征进行了比较,结果发现PEG沉淀法的提取效率最高,外泌体产量高,外泌体外形特征及标志蛋白能体现外泌体表征。PEG沉淀法同样提取基础培养基1640和IMDM同样观察到类似于外泌体的蛋白条带,提示PEG沉淀法可能存在血清杂蛋白的污染,因此提取的外泌体纯度不高。这与PEG沉淀法的原理有关,虽然PEG沉淀大大提高了外泌体的产量,但也增加了其他蛋白污染的可能性。PEG沉淀法的外泌体,与细胞株全蛋白的泳道CELL相比,Western blot结果显示未检测到跨膜四分子蛋白CD81、CD63的表达。这可能是PEG的包裹作用影响到外泌体表征的稳定体现,提示PEG沉淀法可能会影响到后续外泌体的功能实验,PEG沉淀法提取的外泌体存在影响提取质量的不稳定因素。exoEasy试剂盒利用非特异性亲脂性的原理,只需要较少体积的细胞上清(每次最多32 ml)就能提取到足量的外泌体,简便易行、时效佳;但是提取到的表征不明显,CD81、CD63的表达弱,纯度低,损耗大。使用此种方法,即使在表征不明显时,仍能观察到外泌体表达HSP-70,提示外泌体携带表达HSP-70不易受干扰,且HSP-70可能在外泌体中表达量高而易被检测到。超速离心法虽然费时费力、效率不高,但提取的外泌体表征突出明显,纯度高。因此,可以根据不同的研究目的选择不同的提取方法。PEG沉淀法适合对外泌体产量需求大的实验,超速离心法适合外泌体的功能实验,试剂盒适合外泌体前期预实验的探索使用。

