艰难梭菌毒素基因检测及分子流行病学分析*
李洋,姚立琼,刘志武,梁帅龙,韦小宝,刘旭升,颉晓玲(1.兰州大学第一医院a.检验科,b.中心实验室,兰州730000;.兰州大学第一临床医学院,兰州 730000)
艰难梭菌(Clostridiumdifficile)是一种革兰阳性厌氧芽胞杆菌,可引起腹泻、伪膜性肠炎、中毒性巨结肠甚至败血症等严重临床感染。艰难梭菌毒素A(TcdA)和毒素B(TcdB)是该菌的主要致病因素[1]。在欧美国家,艰难梭菌的流行已成为影响公共卫生的一大挑战,造成了严重的经济负担[2]。艰难梭菌流行病学研究可采用PCR核糖体分型(PCR-ribotyping)、脉冲场凝胶电泳(pulse-field gel electrophoresis,PFGE)、多位点序列分型(multilocus sequence typing,MLST)及序列测定等方法。核糖体分型是欧洲艰难梭菌参比实验室分型标准方法,实验条件要求低,经济实用,可快速判断艰难梭菌是否暴发流行。在北美及欧洲地区多次暴发流行的核糖体分型027型产毒型艰难梭菌[3],近年来在国内也有报道[4]。本研究旨在了解本院腹泻患者艰难梭菌感染现状,明确艰难梭菌产毒情况,同时对分离菌株进行核糖体分型,探讨菌株流行病学特点。
1 材料及方法
1.1标本收集 收集2019年5月至10月兰州大学第一医院161例住院腹泻患者(腹泻次数≥3次/d)的粪便标本,其中男性102份,女性59份。
1.2主要仪器与试剂 S1000型PCR扩增仪、Gel Doc XR凝胶成像仪(美国Bio-Rad公司),Vitek MS基质辅助激光解吸电离飞行时间质谱仪(法国生物梅里埃公司);艰难梭菌选择培养基(chromIDTMC.difficileagar,CDIF)、哥伦比亚血琼脂平板、厌氧产气袋(法国生物梅里埃公司),粪便细菌基因组DNA提取试剂盒(天根生化科技公司),Premix Taq酶、100 bp DNA ladder marker(TaKaRa公司);引物由南京金斯瑞公司合成;艰难梭菌标准株ATCC 43255和ATCC BAA-1870由江苏省人民医院刘根焰教授惠赠。
1.3细菌DNA提取及毒素基因检测 用粪便细菌基因组DNA提取试剂盒提取粪便细菌基因组DNA,依据试剂盒说明书进行。参照文献中方法[5]用PCR法检测毒素A基因(tcdA)和毒素B基因(tcdB)。引物序列见表1。反应体系共25 μL:Premix Taq缓冲液12.5 μL,上、下游引物(10 μmol/L)各1 μL,DNA模板2 μL,ddH2O 8.5 μL。反应条件:94 ℃ 5 min;94 ℃ 30 s,62 ℃ 30 s,72 ℃ 45 s,35个循环;72 ℃ 7 min。扩增产物经15 g/L琼脂糖凝胶电泳成像观察。

表1 艰难梭菌毒素基因检测及核糖体分型引物
1.4艰难梭菌产毒培养法 粪便标本收集后立即接种于CDIF及哥伦比亚血平板,35 ℃厌氧培养48 h。选取CDIF上黑色、扁平、边缘不规则、具有特殊臭味的典型菌落,用Vitek MS系统鉴定。培养阳性菌株进行tcdA、tcdB检测,同1.3。
1.5核糖体分型 参照Bidet等研究[6],用PCR法扩增16S~23S rRNA基因间隔区(ITS),进行菌株分型,引物序列见表1。反应体系共50 μL:Premix Taq缓冲液25 μL,上、下游引物(10 μmol/L)各5 μL,DNA模板3 μL,ddH2O 12 μL。反应条件:95 ℃ 5 min;95 ℃ 1 min,57 ℃ 1 min,72 ℃ 1 min,35个循环;72 ℃ 10 min;75 ℃ 45 min。扩增产物经30 g/L琼脂糖凝胶电泳成像观察。以ATCC 43255和ATCC BAA-1870(核糖体027型)作为对照菌株。菌株核糖体分型结果聚类分析采用软件BioNumerics BN7.5cn,相似系数采用Dice算法,位置差异容许度为1.5%,聚类算法选择非加权组平均法(UPGMA)。相似度100%认定为同一核糖体带型。
1.6统计学分析 用SPSS 26.0软件进行。艰难梭菌产毒培养法及粪便毒素基因检测结果进行配对χ2检验和Kappa一致性检验,以P<0.05为差异有统计学意义。Kappa系数≥0.75,认为2种方法诊断结果一致性较好;Kappa值<0.4,认为2种方法诊断结果不一致。
2 结果
2.1产毒株的筛查 161份粪便标本直接艰难梭菌毒素基因检测阳性率9.94%(16/161);经培养鉴定获得18株艰难梭菌,经毒素分子检测,其中16株检出毒素基因,分别为tcdA+tcdB+15株(83.33%),tcdA-tcdB+1株(5.56%)。见图1。配对χ2检验结果显示艰难梭菌产毒培养法与粪便毒素基因检测结果差异无统计学意义(P>0.05),2种方法诊断结果一致性较好(Kappa=0.931)。见表2。
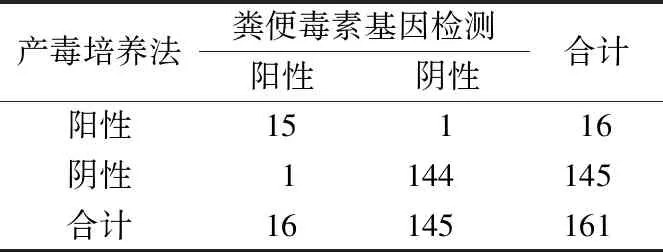
表2 粪便毒素基因检测与产毒培养法结果比较
2.2菌株核糖体分型 对分离所得18株艰难梭菌进行核糖体分型,共有16种型别,命名为GS1~GS16,均为不同科室散发,未见聚集暴发病例,未发现027型菌株,见图2。
3 讨论
本研究中住院腹泻患者粪便艰难梭菌毒素基因阳性率为9.94%,接近国内其他地区类似研究[7],应引起本地区临床及感染控制相关部门注意。
艰难梭菌为专性厌氧菌,传统分离培养鉴定困难且耗时,但厌氧培养敏感性高,菌株可用于流行病学调查[8]。本研究选择CDIF显色培养基选择分离出可疑菌落,再结合VITEK MS快速、准确作出鉴定。TcdA和TcdB是艰难梭菌的主要毒力因子,目前有多种商品化检测系统用于毒素基因检测,但需要特定仪器,试剂成本较高。本研究粪便标本基因组提取后PCR检测A、B毒素基因,耗时短,成本低,易于开展。产毒培养法是艰难梭菌诊断的参考方法,用来评价其他检测方法。本研究中粪便毒素基因检测结果与产毒培养法比较差异无统计学意义,一致性较好,表明粪便毒素基因检测方法可独立用于检测产毒素艰难梭菌。同时采用2种方法可互补并增加检出率,其中1例PCR毒素检测阴性标本培养后毒素检测为阳性,可能由于此粪便标本中艰难梭菌含量较少;而1例A、B毒素阳性标本可能由于保存运输时间较长而未培养到菌株。
培养鉴定所得18株艰难梭菌毒素基因检测结果显示,非产毒株tcdA-tcdB-占11.11%,tcdA+tcdB+产毒株占83.33%,tcdA-tcdB+产毒株占5.56%,表明本地区艰难梭菌感染中产毒株占优势,同相关研究结果一致[9]。
核糖体027型产毒型艰难梭菌曾在多个国家暴发流行,毒力作用大且易复发。近年来,我国内地报道027菌株均为散发[10],未引起暴发流行。本研究采用ATCC 43255、ATCC BAA-1870(核糖体027型)作为对照菌株,对18株艰难梭菌进行核糖体分型,未发现027型高毒力菌株,同时也未发现院内聚集暴发流行。

