高考化学二卷信息型氧化还原反应方程式书写策略分析


摘要:文章主要阐述高考理综化学二卷陌生方程式中的信息型氧化还原方程式的书写策略,同时将此策略迁移至电化学的电极反应书写,以期让学生氧化还原复习时能将学习的知识和方法融会贯通,学以致用,取得高考好成绩。
关键词:信息型氧化还原反应;方程式;策略
信息型氧化还原反应在历年高考试题二卷中频频出现,其书写方法迁移至电化学电极反应,所以陌生氧化还原方程式的书写方法在高三一轮二轮复习时很重要。文章就不同类型的信息型氧化还原方程式书写应对策略进行逐一说明,并将此方法推及电极反应书写。
一、 信息型氧化还原反应方程式的书写应对策略
(一)常见氧化剂和还原剂之间的氧化还原方程式书写
方法:电子守恒——电荷守恒——元素守恒法
步骤:
常见氧化剂:Cr2O2-7、MnO-4 、NO-3(H+)、 ClO-、 H2O2 、Fe3+
一般产物:Cr3+、Mn2+(H+)、 NO2(浓)、 Cl-、H2O、Fe2+、
MnO2(OH-)、NO(稀)
常见还原剂:S2-、 HS-、 SO2-3、 HSO-3、 I-、 Br-、 Fe2+、 H2O2
一般产物:S、 SO2-4、I2 、 Br2、 Fe3+ 、 O2
例1MnO-4和Fe2+在酸性条件下的反应
写主要物质、标化合价、配主要物质的系数:
MnO-4+7+Fe2-+2Mn2-+2得5e-×1+Fe3++3
失1e-×5
酸性环境用氢离子补电荷守恒:MnO-4+5Fe2++8H+Mn2++5Fe3+
氢原子守恒在右端补水、最后用氧原子守恒检查:
MnO-4+5Fe2++8H+Mn2++5Fe3++4H2O
(二)信息型氧化还原方程式的类型
信息型氧化还原反应最主要解决第一步写出主要物质。根据主要物质是否全部明确分4类说明。
类型1、主要物质在字里行间和流程中直接给出——主要产物明确型
例2(2017年全国3-28)砷(As)是第四周期ⅤA族元素,可以形成
As2S3、AS2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式。
分析:从(2)信息可知主要还原剂和氧化剂为As2S3和O2反应生成H3AsO4和S,根据书写方法得到方程式为2As2S3+6H2O+5O26S+4H3AsO4
類型2、根据化合价升降规律分析得出主要物质——主要产物半明型
例3(2019年全国26-2)①以重晶石(BaSO4)为原料,可按如下工艺生产立德粉:
问题:在回转窑中重晶石被过量焦炭还原为可溶性硫化钡,写出该过程的化学方程式。回转窑尾气中含有有毒气体,生产上可通过水蒸气变换反应将其转化为CO2和一种清洁能源气体,写出该反应的化学方程式。
分析:第一小问:根据流程显示回转窑温度900~1200℃,浸出槽得到物质是产物BaS,所以C和BaSO4反应生成BaS。硫的化合价从+6降为-2,根据化合价升降规律分析,碳的化合价一定升高,不特别说明,生成物为CO2,由此写出主要物质,然后根据电子守恒和元素守恒配平即得:C+BaSO4BaS+CO2(900~1200℃)。
第二小问:回转窑有毒气体只能是CO,和H2O反应得到CO2和一种清洁能源,根据碳化合价升高,只能是氢的化合价降低生成H2,所以方程式为:H2O(g)+COCO2+H2(高温)
例4(2018年全国1-27(4))Na2S2O5可用作食品的抗氧化剂。在测定某葡萄酒中Na2S2O5残留量时,取50.00mL葡萄酒样品,用0.01000mol·L-1的碘标准液滴定至终点,消耗10.00mL。滴定反应的离子方程式为:S2O2-5+2I2+3H2O2SO2-4+4I-+6H+。
例5(2017·全国1-28)将水样与Mn(OH)2碱性悬浊液混合,反应生成MnO(OH)2,实现氧的固定。“氧的固定”中发生反应的化学方程式。根据化合价升降规律可知Mn(OH)2生成
MnO(OH)2锰的化合价从+2升至+4,肯定有化合价降低的元素,“氧的固定”告诉应该是氧气氧化了锰元素。根据电子守恒和元素守恒方程式为:4Mn(OH)2+O24MnO(OH)2。
类型3、根据流程信息和化合价升降规律得出主要物质——产物和反应物都不透明
方法:从具体流程找出进出物质,再根据氧化还原规律和书写方法书写。
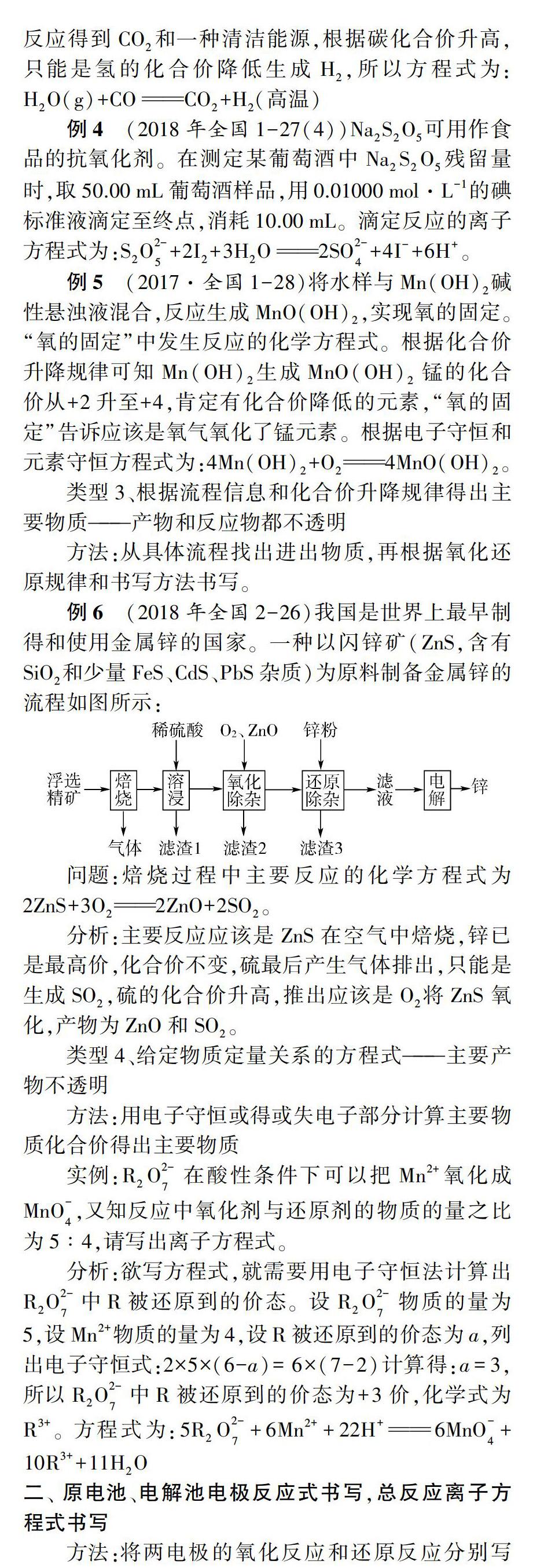
例6(2018年全国2-26)我国是世界上最早制得和使用金属锌的国家。一种以闪锌矿(ZnS,含有SiO2和少量FeS、CdS、PbS杂质)为原料制备金属锌的流程如图所示:
问题:焙烧过程中主要反应的化学方程式为2ZnS+3O22ZnO+2SO2。
分析:主要反应应该是ZnS在空气中焙烧,锌已是最高价,化合价不变,硫最后产生气体排出,只能是生成SO2,硫的化合价升高,推出应该是O2将ZnS氧化,产物为ZnO和SO2。
类型4、给定物质定量关系的方程式——主要产物不透明
方法:用电子守恒或得或失电子部分计算主要物质化合价得出主要物质
实例:R2O2-7在酸性条件下可以把Mn2+氧化成MnO-4,又知反应中氧化剂与还原剂的物质的量之比为5∶4,请写出离子方程式。
分析:欲写方程式,就需要用电子守恒法计算出R2O2-7中R被还原到的价态。设R2O2-7物质的量为5,设Mn2+物质的量为4,设R被还原到的价态为a,列出电子守恒式:2×5×(6-a)=6×(7-2)计算得:a=3,所以R2O2-7中R被还原到的价态为+3价,化学式为R3+。方程式为:5R2O2-7+6Mn2++22H+6MnO-4+10R3++11H2O
二、 原电池、电解池电极反应式书写,总反应离子方程式书写
方法:将两电极的氧化反应和还原反应分别写出,原电池正极、电解池阴极化合价降低的电子为还原反应,原负电阳元素化合价升高失去电子为氧化反应。加合得出总反应。依照:电荷守恒—元素守恒—电子守恒过程书写。
步骤:
实例1:(2018年27题 (3)) 改编:KIO3也可采用“电解法”制备,装置如图所示。书写阳极电极反应式。
分析:在碱性条件下,碘單质在阳极被氧化。根据书写方法有:
I2-10e-+12OH-2IO-3+6H2O
实例2:化学在环境保护中起着十分重要的作用。催化反硝化法和电解法降解法可用于治理水中硝酸盐的污染。(2)、电化学降解NO-3是酸性溶液中硝酸根在电极上降解为N2,硝酸根在为(填“阳极”或“阴极”)放电,写出阴极反应式。
分析:NO-3的氮元素从+5价降低到的N2零价,化合价降低得电子在电解池的阴极。电极反应为:2NO-3+ 10e-+8H+N2↑+4H2O
电极反应只是将氧化还原方程式的氧化反应和还原反应分开书写,书写同信息型氧化还原应对方法。教师在讲解时要讲方法讲透,学生融会贯通后,对氧化还原的方程式的书写加强训练,遇到陌生方程式按一定的思路求解,必不失分,取得好成绩。
参考文献:
[1]杜志建.2017年全国各省市高考试题汇编,理科综合[J].乌鲁木齐:新疆青少年出版社,2017.
[2]天利全国高考命题研究中心编.2018全国各省市高考试题汇编全解,理科综合[M].拉萨:西藏人民出版社,2018.
[3]杜志建.2019年全国各省市高考试题汇编,理科综合[J].乌鲁木齐:新疆青少年出版社,2019.
作者简介:聂柯湘,陕西省西安市,陕西省西安市高新区鄠邑第四中学。

