罗非鱼鳞胶原肽亚铁螯合物制备工艺优化及结构表征
唐顺博 涂宗财,3 沙小梅 张 耀 张 露
(1. 江西师范大学国家淡水鱼加工技术研发专业中心,江西 南昌 330022; 2. 江西师范大学江西省淡水鱼高值化利用工程技术研究中心,江西 南昌 330022; 3. 南昌大学食品科学与技术国家重点实验室,江西 南昌 330047)
铁为人体必需元素,在维持正常造血功能和增强免疫功能等方面起到巨大作用[1]。世界上约有25%的人患有贫血,其中一半是缺铁造成的,口服补铁剂是治疗缺铁性贫血的重要方法之一,但传统硫酸亚铁复合剂可能会导致患者肠胃不适[2]。研究发现,氨基酸铁螯合物比传统硫酸亚铁复合剂具有更好的补血效果[3],多肽亚铁螯合物作为一种新型补铁剂,可通过肽的转运系统直接被人体吸收,并且对人体刺激较小,有希望用于一些特殊人群[4-5]。
明胶是一种多功能性的生物大分子,普遍用于食品、医药及化工领域[6-8]。与传统明胶相比,鱼明胶具有来源广,价格低,营养价值高等特点。随着近年水产养殖的发展,鱼类加工副产物如鱼鳞、鱼头、鱼内脏等资源被大量浪费,充分利用加工副产物能大大提高鱼类的综合价值[9]。沙小梅等[10]从鳙鱼鱼鳞中提取鱼鳞明胶并研究了提取过程中pH值对鳙鱼鱼鳞明胶性质的影响;Sinthusamran等[11]研究了不同提取温度对鲈鱼鱼皮明胶性质的影响。罗非鱼别称非洲鲫鱼,肉质鲜嫩,富含多种营养物质,是中国鱼类养殖中的重要品种[12],贾杏歌等[13]研究了不同浓度戊二醛对罗非鱼鳞胶原蛋白膜机械性和抗水性的影响;李瑞杰等[14]比较了不同酶解物的钙离子螯合能力和螯合物的抗氧化活性。刘永等[15]曾对罗非鱼鳞胶原蛋白肽铁螯合物的制备工艺进行了优化,但未对螯合物结构进行探究。
研究拟以罗非鱼鳞胶原肽为原料制备多肽亚铁螯合物,并对多肽亚铁螯合物的最佳制备工艺及其结构进行探索,以期为罗非鱼鱼鳞的精深加工及高值化利用提供技术参考。
1 材料与方法
1.1 材料与试剂
罗非鱼鳞明胶:苏州吉利鼎海洋生物科技有限公司;
碱性蛋白酶:酶活力为8.68×107U/g,诺维信酶制剂公司;
乙腈、三氟乙酸:色谱纯,上海阿拉丁生化科技有限公司;
细胞色素C、抑肽酶、L-氧化型谷胱甘肽、羟脯氨酸:色谱纯,北京索莱宝科技有限公司;
其余试剂均为分析纯。
1.2 仪器与设备
SevenCompact台式pH计:S220型,梅特勒—托利多仪器(上海)有限公司;
冷冻干燥机:SR-AON-50型,上海舍岩仪器有限公司;
HSM高效液相色谱:D-2000型,日本Hitachi公司;
酶标仪:Synergy H1型,美国Bio Tek公司;
氨基酸分析仪:L-8900型,日本Hitachi公司;
智能型傅立叶变换红外光谱仪:Nicolet5700型,美国热电尼高力公司;
扫描电镜:S-3400N型,日本Hitachi公司;
X射线衍射仪:D8 ADVANCE型,德国BRUKER公司。
1.3 试验方法
1.3.1 鱼鳞多肽的制备 酶解方法参考文献[16]修改如下:取鱼鳞明胶加蒸馏水配成浓度为5%的明胶溶液,置于50 ℃恒温水浴锅中保温15 min,用0.1 mol/L NaOH调节pH至8,加入明胶质量比为1%的碱性蛋白酶水浴30 min,再次调节pH至8,水解4.5 h,水解结束后立即沸水浴10 min灭活,冷却,4 000 r/min离心15 min,取上清液,经冷冻干燥后存于4 ℃冰箱备用。
1.3.2 多肽分子量测定 按照GB 31645—2018《食品安全国家标准 胶原蛋白肽》对多肽分子量进行测定。取1.3.1中多肽粉配制成1 mg/mL的溶液,过0.22 μm水系滤膜后,使用高效液相色谱仪进行分析。以细胞色素C(12 384 Da)、抑肽酶(6 511.51 Da)、L-氧化型谷胱甘肽(612.63 Da)和羟脯氨酸(131.13 Da)为标准品绘制相对分子质量校正曲线。色谱条件:色谱柱型号为XBridge BEH 125Å SEC(3.5 μm,7.8 mm×300 mm);流动相比例为V乙腈∶V水∶V三氟乙酸=40∶60∶0.05;流速0.5 mL/min;柱温30 ℃;进样量10 μL。
1.3.3 多肽亚铁螯合物制备工艺优化
(1) 亚铁螯合物的制备流程:
多肽→加入一定比例水→加入抗氧化剂(抗坏血酸)→调节pH值→按比例加入铁盐→进行螯合反应→加入无水乙醇沉淀→离心得到沉淀→冷冻干燥[17]
(2) 单因素试验:由于亚铁螯合受pH、多肽浓度及多肽与亚铁盐质量比影响较大[18],因此试验固定反应温度为25 ℃,反应时间为40 min,pH为5.0,多肽浓度为3%,多肽与亚铁盐质量比为3∶1,依次对pH值(3.0,4.0,5.0,6.0,7.0),多肽浓度(1%,2%,3%,4%,5%),多肽与亚铁盐质量比(1∶1,2∶1,3∶1,4∶1,5∶1)进行单因素试验,以螯合率和螯合物得率为指标,探讨单因素对螯合反应的影响。
(3) 响应面试验设计:根据单因素试验结果,以pH值、多肽与铁盐质量比和多肽液浓度为影响因素,设计三因素三水平响应面试验,以多肽螯合物得率为评价指标,探索螯合物的最佳制备工艺。
1.3.4 评价指标的测定 采用邻菲罗啉比色法[17]评价肽—铁螯合体系中亚铁离子的含量、铁螯合率和螯合物得率。
(1) 铁离子含量:
(1)
式中:
F——体系铁离子含量,mg/kg;
C——从标准曲线获得溶液相应的铁含量,μg;
M——称取样品的质量,g;
V1——测定所取的溶液体积,mL;
V2——样品处理后的定容体积,mL。
(2) 铁螯合率:
(2)
式中:
D——铁螯合率,%;
m1——螯合物中铁的含量,mg;
m2——加入铁的含量,mg。
(3) 螯合物得率:
(3)
式中:
Y——螯合物得率,%;
M1——生成物总质量,g;
M2——加入反应体系的总质量,g。
1.3.5 氨基酸组成分析 参照GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》,采用氨基酸自动分析仪对样品中氨基酸的含量进行测定。
1.3.6 多肽亚铁螯合物的结构表征
(1) 扫描电镜分析:取少量样品,均匀涂在样品盘的导电胶上进行喷金处理,之后采用S-3400N型扫描电子显微镜进行扫描,对其表观形貌进行分析。
(2) 红外光谱分析:采用Nicolet 5700型红外光谱仪测定多肽与多肽亚铁螯合物的红外光谱,扫描范围为400~4 000 cm-1。
(3) X衍射分析:将样品研磨均匀后,采用Bruker D8 X-射线衍射仪进行分析测定,分析条件为:Cu靶,管电流40 mA,扫描速度10°/min,扫描角度为5°~80°。
1.4 数据处理
2 结果与分析
2.1 多肽分子量分布
通过对标品出峰时间与标品分子量进行线性拟合,得到分子量标品标准方程为Y=6.855 16-0.249 9X(R2=0.997),由图1可知,胶原多肽中主要含有4个组分,经计算各组分平均分子量分别为7 479,5 450,3 030,889 Da,符合GB 31645—2018标准对多肽的定义。
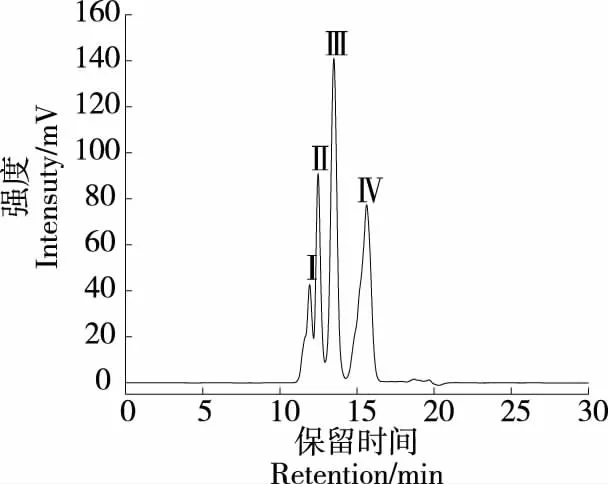
图1 胶原多肽分子量分布
2.2 单因素试验结果
由图2(a)可知,当固定多肽液浓度为3%,多肽与亚铁盐质量比为3∶1时,螯合率和螯合物得率先升高,在pH为5时达到最大值,随后又减小,表明反应体系在弱酸或中性时,溶液中的OH-会参与Fe2+的反应,不利于螯合反应的进行[19];由图2(b)可知,固定pH为5,多肽与亚铁盐质量比为3∶1时,螯合率先增大后减小,在多肽液浓度为3%时,螯合率和螯合物得率最高,这是因为多肽浓度增大,在水中溶解性变小,参与反应的多肽更少;由图2(c)可知,当固定多肽浓度为3%,pH为5时,螯合率随亚铁盐质量比的增大而减小,螯合物得率先增大后减小,当质量比为3∶1时达到最大,可能是由于多肽与亚铁离子的结合位点有限,当结合数目达到最大时,不再发生反应,不能生成螯合物[20]。

图2 pH、多肽浓度和多肽与铁盐质量比对螯合反应的影响
2.3 响应面优化分析
2.3.1 响应面试验设计及结果分析 根据单因素试验结果,选取pH、多肽浓度、肽铁盐质量比三因素(见表1),利用Box-Behnken中心组合原理设计三因素三水平的响应面试验,试验方案与结果见表2。

表1 响应面因素及水平表
用Desgin-Exper 8.0软件对表2的试验结果进行分析,建立螯合物得率(Y)的二次响应面回归模型为:

表2 响应面试验方案与结果
Y=1.15A+0.75B+0.80C-0.05AB+0.28AC-0.89BC-2.00A2-3.44B2-2.12C2+65.83。
(4)
根据表3中方差结果分析,该二次模型P值<0.000 1表明极显著,相关系数R2为0.979 9,表明预测值和实测值之间有很高的相关性,RAdj2为0.954 1,表明此模型能解释95.41%的响应值变化,因此该模型可以较好地描述pH值、多肽液浓度和多肽与铁盐质量比对螯合反应影响的变化规律。
回归方程的各项方差分析结果表明,A、B、C、A2、B2和C2对螯合物得率的影响极显著(P<0.01),BC相互作用对螯合物得率的影响显著(P<0.05),而AB、AC的相互作用对螯合物得率的影响不显著(P>0.05)。由F值可知,各因素对螯合物得率的影响次序:pH>肽铁质量比>多肽浓度。剔除不显著项AB、AC后对方程进行优化,得优化后的方程为:
Y=1.15A+0.75B+0.80C-0.89BC-2.00A2-3.44B2-2.12C2+65.83。
(5)
由图3可知,因素B和C之间的相互作用等高线图呈椭圆形,表明多肽浓度与肽铁质量比之间具有显著的相互作用[21],与表3结果一致。

图3 多肽浓度与肽铁盐质量比的交互作用对螯合物得率影响的响应面图
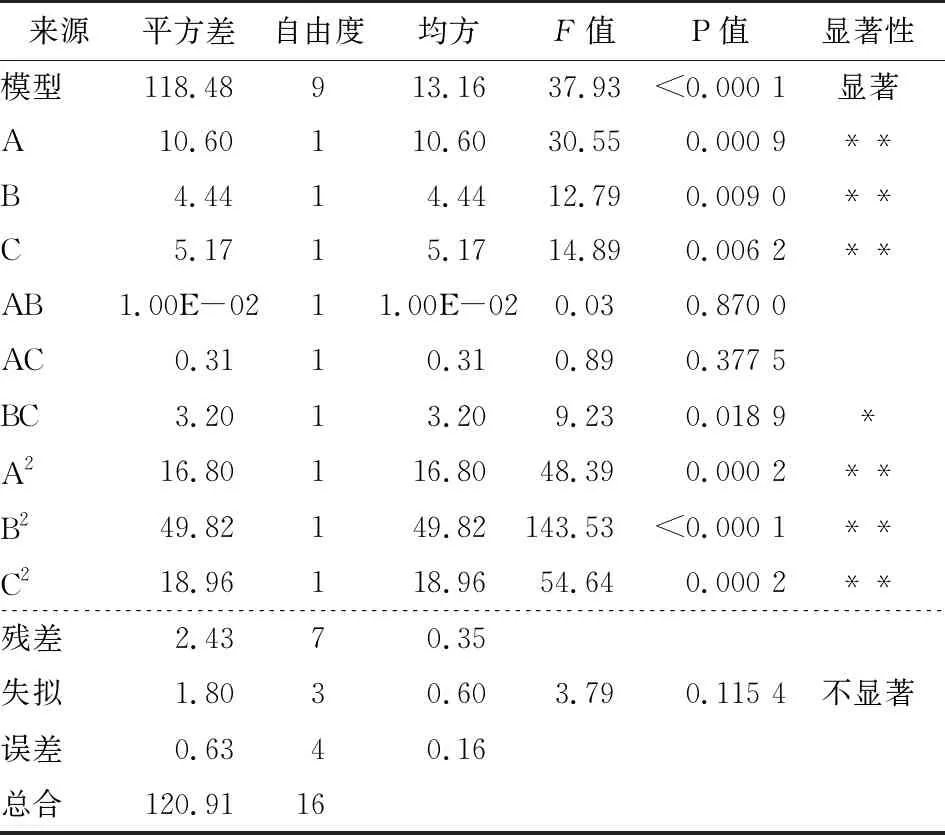
表3 响应面二次模型方差分析†
2.3.2 最优解的验证 利用Design-Expert 8.0软件计算得到肽铁螯合物最佳工艺条件为pH 5.29,多肽浓度3.09%,多肽与铁质量比3.17∶1.00,预测螯合物得率为66.10%。考虑到实际操作,最佳制备工艺确定为pH 5.30,多肽浓度3.00%,多肽与铁质量比为3.20∶1.00,在此条件下进行3次重复验证实验,螯合率平均值为82%,肽铁螯合物得率平均值为65.43%,与最佳工艺条件螯合物得率66.10%无显著性差异(P>0.05),说明此模型可用于反应多肽螯合铁的变化规律。
2.4 氨基酸组成成分分析
由表4可知,胶原多肽中Gly含量最高,Glu、Pro、Ala和Asp的含量也相对较高,符合胶原蛋白氨基酸组成特征[22],结合图1,多肽分子量分布在800~8 000 Da,因此可认为经酶解后冻干所得粉末为胶原多肽。Glu、Gly、Lys、His和Arg等氨基酸被认为与金属离子螯合活性密切相关[23-24],从表4可知,该5种氨基酸在多肽中大量存在,经螯合后,其在螯合物中的含量大量增加,与Lee等[25]的研究结果相符。
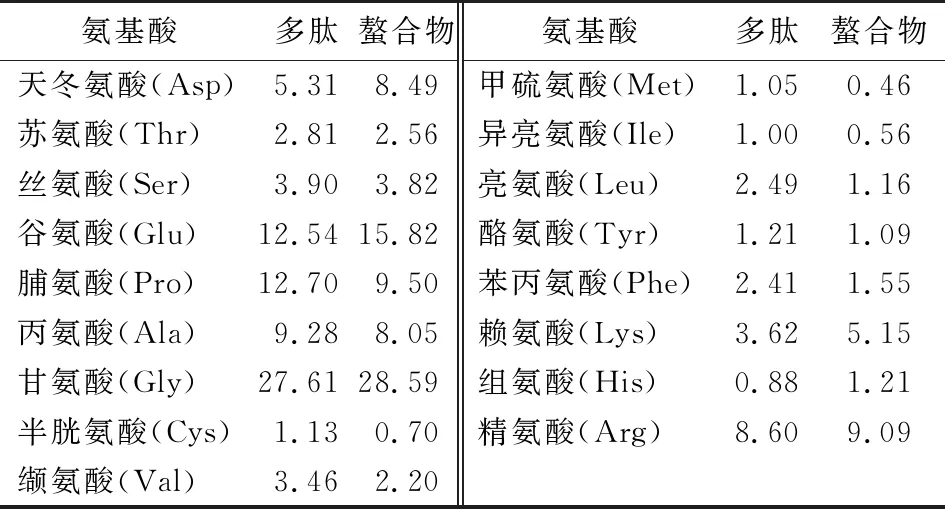
表4 多肽与螯合物的氨基酸组成
2.5 螯合物的结构表征
2.5.1 扫描电镜分析 由图4可知,多肽表面光滑并有裂纹,可能是在真空干燥过程中失水导致,而螯合物是主体成球状的团状交织结构,表面有颗粒附着于球体上,与汪婧瑜等[17]结果类似。

图4 多肽与螯合物的扫描电镜图
2.5.2 红外光谱分析 由图5可知,发生螯合反应后,多肽和肽铁螯合物的特征吸收峰发生了明显的变化。螯合后,多肽的—NH2吸收峰由3 380.60 cm-1移动到3 370.97 cm-1,在1 542.77 cm-1处—NH2的吸收峰移动到1 546.63 cm-1,多肽的—COO—吸收峰由1 400.67 cm-1移动到1 409.71 cm-1,另外多肽的C—H吸收峰由于伸缩振动由1 455.99 cm-1移动到1 468.64 cm-1,以上结果表明多肽中—NH2、—COO—与C—H与亚铁盐发生反应生成了多肽亚铁螯合物。

图5 多肽与螯合物的红外光谱图
2.5.3 亚铁螯合物的X衍射分析 由图6可知,鱼鳞胶原肽在2θ=20°左右处出现强衍射峰,与刘静[26]所测图谱类似,在与亚铁离子螯合后,多肽螯合物在20°左右的衍射峰减弱,并且向大掠射角偏移,其他地方未出现衍射峰,属于无规则的非晶体结构,表明亚铁离子与多肽以配位键形式结合。

图6 多肽和螯合物的X衍射图谱
3 结论
以鱼鳞胶原肽为原料,以螯合物得率和螯合率为指标,采用单因素试验及响应面法优化得出了多肽亚铁螯合物的最佳制备工艺为pH 5.30,多肽浓度3.00%,多肽与亚铁盐质量比3.2∶1.0,在此条件下螯合率为82%,螯合物得率为65.43%。氨基酸分析表明Glu、Gly、Lys、His和Arg等氨基酸在螯合反应中起到重要作用。通过扫描电镜发现多肽与螯合物表观结构发生明显改变,由表面光滑变为球型团状结构;红外光谱表明胶原多肽中的—NH2、—COO—以及C—H与亚铁盐发生了反应;X衍射图谱分析发现亚铁离子与多肽以配位键的形式结合,证实多肽与亚铁盐发生反应生成了螯合物。以上研究结果表明,鱼鳞胶原肽可作为新型补铁剂载体材料,扩宽了补铁剂材料的来源,同时为鱼类副产物中鱼鳞的精加工提供了思路,有利于促进鱼鳞的高值化利用。后续将采用体外和体内模型研究罗非鱼鳞胶原肽亚铁螯合物的消化稳定性和贮存稳定性,以及促进铁吸收的效果。

