蝉拟青霉疏水蛋白PChyd基因表达模式分析及敲除载体构建
王丽芳 彭耀 党向利 叶良 李双姣 许慧慧 杜鹃 董育德


摘 要:為深入研究昆虫病原真菌蝉拟青霉疏水蛋白PChyd基因的功能,根据蝉拟青霉基因组信息克隆疏水蛋白PChyd基因,对该基因序列进行生物信息学分析,使用qRT-PCR技术对其在不同培养条件或阶段下的表达模式进行分析,并通过酶切酶连的方法构建了该基因的敲除载体。结果表明:PChyd基因的开放阅读框序列全长303 bp,编码100 aa,包含22 aa的信号肽序列和70 aa疏水蛋白功能区域。系统发育分析显示该基因与粗糙虫草菌亲缘关系最近。qRT-PCR结果显示PChyd基因在PDA培养的菌丝体、诱导的附着胞、诱导的芽生孢子中表达量显著高于另外2个样品,其中芽生孢子表达量最高,暗示该基因在蝉拟青霉侵染初期和在昆虫血腔中定殖阶段可能具有重要作用。凝胶电泳结果表明,成功构建了该基因的敲除载体,扩增出含有上臂、HPH、下臂的3356 bp左右的片段。本研究为进一步探究蝉拟青霉疏水蛋白PChyd基因的致病机理、生防工程菌的改造奠定了基础。
关键词:蝉拟青霉;疏水蛋白;PChyd:表达模式;敲除载体中图分类号:Q78;S476.12 文献标识码:A
Analysis of Expression Pattern and Construction of Knockout Vector ofPChydGeneof Paecilomyces cicadae
WANG Lifang1, PENG Yao2*, DANG Xiangli2, YE Liang2, LI Shuangjiao2, XU Huihui2, DU Juan2,DONG Yude1
1. School of Horticulture, Anhui Agricultural University, Hefei, Anhui 230036, China; 2. School of Plant Protection, Anhui Agricultural University, Hefei, Anhui 230036, China
Abstract: In order to investigate the function ofPChydofPaecilomyces cicadae, the gene was cloned according to the genomic data ofP. cicadae, and the bioinformatics of the gene were analyzed by the NCBI database and the Expasy online tools. The expression pattern ofPChydwas analyzed under different culture conditions or stages by qRT-PCR. The knockout vector of the gene was constructed by molecular biological methods. The open reading frame ofPChydwas 303 bp encoding 100 aa. Domain analysis revealed that the gene contained a 22 aa signal peptide region and a 70 aa hydrophobin functional region. Phylogenetic analysis showed that the relationship ofP. cicadae PChyd was close toCordyceps confragosa hydrophobin. Expression pattern analysis showed that the expression level ofPChydin mycelium in PDA, appressorium and blastospore were significantly higher than that of the other two samples, and the expression level was the highest in blastospore among five samples, which indicating that this gene had important function in the initial stage of the infection ofP. cicadaeand in the colonization stage of insect blood. The results of gel electrophoresis and sequencing showed that the knockout vector of the gene was successfully constructed. The research would lay a foundation for further exploring of the pathogenic mechanism ofPChydand engineering this entomopathogenic fungusP. cicadae.
Keywords: Paecilomyces cicadae; hydrophobin;PChyd; expression pattern; knockout vector
DOI: 10.3969/j.issn.1000-2561.2020.07.005
随着害虫抗药性的增强、害虫的再猖獗以及农业投入物对环境的污染这一系列问题的出现,人们迫切需要寻找以生物为基础的有害生物控制形式。昆虫病原真菌作为一种重要的微生物群,广泛分布于整个真菌界,已经作为害虫生物防治的主要手段之一并应用于农业生态系统中。当前害虫生物防治中广泛应用的昆虫病原真菌包括金龟子绿僵菌(Metarhizium anisopliae)、球孢白僵菌(Beauveria bassiana)、玫烟色拟青霉(Paecil omycesfum osoroseus)和蜡蚧轮枝菌(Verticillium lecanii)[1]。蝉拟青霉(Paecilomyces cicadae)是一种在同翅目和鳞翅目昆虫幼虫上发现的昆虫病原真菌,它能够侵染竹蝉(Platylomia pieli)、山蝉(Cicada flammata)、小菜蛾(Plutella xylostella)等昆虫[2-3]。在我国,该菌是研究较早的虫草菌和生防菌种类之一,目前主要分布于我国华东与西南地区[4]。早期主要研究了其对菜粉蝶(Pieris rapae)等鳞翅目农业害虫的致病性[5]。随着人们对虫草的关注度逐渐升高,近年来关于虫草属菌种的研究越来越多。研究表明蝉拟青霉对鳞翅目(Lepidoptera)、半翅目(Hemiptera)、同翅目(Homoptera)等昆虫都具有较强的致病能力[6-8]。这些研究为后期蝉拟青霉的开发利用提供了理论基础。
为提高昆虫病原真菌的田间稳定性、杀虫效果和杀虫速度,国内外学者对病原真菌致病性的分子机制展开了研究。当前白僵菌与绿僵菌致病毒力基因的研究已有大量报道,但对蝉拟青霉毒力相关基因的研究甚少,在一定程度上限制了该菌在害虫生物防治上的应用。在前期的研究中,本课题组对蝉拟青霉菌株(ZJ1611)基因组进行了测序。根据已报道的白僵菌、绿僵菌等昆虫病原真菌的毒力相关基因,对蝉拟青霉基因组中的毒力相关基因进行筛选,从中发现1个疏水蛋白(hydrophobin)基因——PChyd。疏水蛋白是一种存在于丝状真菌中、分子量较小、具有表面活性的分泌蛋白,常分布于分生孢子、菌丝等结构的表面,该蛋白根据其自身的亲水模式、溶解特性、核苷酸序列以及自组装过程中所形成的结构可分为2种类型(I型和II型)[9-11]。疏水蛋白在真菌中扮演着多种重要的角色。例如,在食用真菌中,Hyd9基因的沉默会造成金针菇(Flammulina filiformis)菌丝减少,并对原基形成产生影响[12]。Zhang等[13]研究发现白灵菇(Pleurotus nebrodensis)疏水蛋白PN1与细菌抵抗力有关。在生物防治真菌粉红螺旋聚孢霉(Clonostachys rosea)中,疏水蛋白对分生孢子的疏水性、控制分生孢子萌发以及粉红螺旋聚孢霉在根内定殖都有一定作用[14]。这些研究都表明疏水蛋白在真菌的生长和发育过程中具有重要的作用。
目前关于蝉拟青霉疏水蛋白基因的研究尚未见报道。鉴于此,对蝉拟青霉基因组中发现的疏水蛋白PChyd基因进行克隆,利用生物信息学方法对其序列进行分析,对其在不同培养条件或阶段的表达模式进行检测,并成功构建了该基因的敲除载体。为进一步探究蝉拟青霉疏水蛋白PChyd基因的致病机理奠定基础,同时为该菌生防工程菌的改造以及生防菌的应用提供理论依据。
1 材料与方法
1.1 材料
蝉拟青霉(P.cicadae)菌株分离自采集于浙江的野生蝉虫草子实体(编号:ZJ1611)。质粒pMD19-T和大肠杆菌Escherichia coliDH5α感受态细胞购自TaKaRa。Bar-HPH由安徽农业大学植物保护学院郭敏教授馈赠。
1.2方法
1.2.1PChyd基因的克隆与鉴定 采用Primer 5.0软件对预测的PChyd基因设计克隆引物,引物序列详见表1,以cDNA为模板对PChyd基因进行PCR扩增。以DNA为模板进行PCR反应来分析基因序列中是否存在非編码区域。PCR反应根据2×Taq Plus MasterMix(北京康为)试剂的使用说明在PCR仪(Bio-RAD)中进行。产物经琼脂糖凝胶电泳检测,并使用上海生工胶回收试剂盒对反应产物进行胶回收、纯化,回收后的产物使用Mighty TA-cloning(TakaRa)试剂盒进行TA克隆,克隆好的质粒用于大肠杆菌E. coliDH5α的转化,并挑选已成功验证的转化子寄往安徽通用生物公司进行测序,以验证基因组测序序列的正确性,对验证正确的基因进行后续生物信息学及表达模式分析。
1.2.2PChyd基因的生物信息学分析 将PChyd基因序列于NCBI上利用BLAST进行比对。根据NCBI提供的InterProScan、dbCAN、CDD
注:下划线序列为PmeI酶切位点。
Note: The underlined sequences are thePmeI cleavage site.
databases等在线工具对该基因结构域进行分析。采用ProtParam预测蛋白的等电点(pI)、分子量(Mw)和GPI位点。采用SignalP 4.1预测该蛋白的理论信号肽区域。采用MEGA 6.0软件构建系统发育树。
1.2.3 菌株的培养 根据PChyd基因可能参与的反应阶段,选取了2种不同的菌丝培养条件和3个阶段,共5个样品(PDA、CM、AP、BS、C)。各种样品的培养方法如下:将蝉拟青霉接种在PDA固体培养基上于28 ℃培养12~15 d,使用含有0.05%吐温80的无菌水收集蝉拟青霉的分生孢子,配置孢子悬浮液,悬浮液浓度为1×108个/mL。蝉拟青霉分生孢子接种到CM[15](硝酸盐溶液50 mL/L,微量元素溶液1 mL/L,維生素溶液1 mL/L,葡萄糖10 g/L,蛋白胨2 g/L,酵母提取物1 g/L,络蛋白氨基酸1 g/L,琼脂粉15 g/L)、PDA液体培养基中,在28 ℃条件下180 r/min的摇床中培养3 d后收集菌丝体。使用Junges等[16]报道的实验方法对分生孢子(C)、芽生孢子(BS)(诱导培养基配方:玉米浆固体30 g/L,葡萄糖40 g/L,酵母提取物30 g/L;培养条件:28 ℃ 180 r/min培养64 h)和附着胞(AP)(配置含有0.004%酵母提取物和0.05%吐温80的无菌溶液,使用该溶液将1×108个/mL的孢子悬浮液稀释至1×106个/mL。稀释后的孢子悬浮液均匀涂抹于盖玻片上,并于28 ℃培养16 h后,使用上述配置好的溶液冲洗、离心并收集样品)进行收集。所有试剂均购自生工生物工程(上海)股份有限公司。
1.2.4 基因组DNA、总RNA提取及cDNA合成 利用Wizard?Genomic DNA提取试剂盒(Pro mega)提取各样品的基因组DNA,提取后的基因组DNA用1%的琼脂糖凝胶进行电泳检测。根据Rio等[17]的方法对所有样品的总RNA进行提取,并使用RNase-free DNase I(TaKaRa)去除总RNA中的基因组DNA污染。通过琼脂糖凝胶电泳和NanoDrop 2000分光光度计(Thermo Scientific,DE)对提取的RNA质量和浓度进行检测。cDNA合成根据PrimeScript?II 1st Strand cDNA Synthesis试剂盒(TaKaRa)的使用说明进行。
1.2.5 qRT-PCR 使用qRT-PCR对样品的PChyd基因的相对表达水平进行检测。每个基因转录本的相对荧光定量使用SYBR?Premix Ex TaqTM II(TaKaRa)试剂进行,并在Bio-Rad CFX96(Bio- Rad,Hercules,CA,USA)中进行反应。荧光定量反应使用96孔板,每个孔包含20 μL反应液:10 μL SYBR?Premix Ex TaqTM II、每条引物0.4 μL(0.2 μmol/L)、1 μL(100 ng)cDNA模板、8.2 μL不含核酸酶的无菌水。反应条件如下:95 ℃ 30 s 1个循环,95 ℃ 5 s和60 ℃ 30 s反应40个循环。蝉拟青霉β-actin基因作为内参基因,相对表达水平使用2-ΔΔCT方法进行分析[18]。所有的实验进行3次重复。
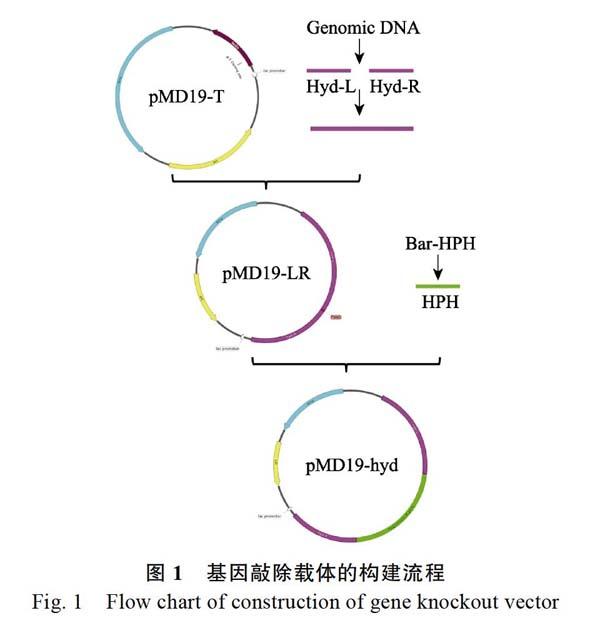
1.2.6 敲除载体构建 分别设计引物扩增敲除基因的上下臂片段及抗性基因(表1),按照图1所示进行该基因敲除载体的构建,构建好的载体送往安徽通用生物公司进行测序验证。具体实验方法如下:首先进行Overlap PCR反应,构建含有PChyd左、右臂的片段(引物提前设计同源区域及PmeI酶切位点),回收PCR产物用于TA克隆,TA克隆后的质粒经PmeI酶切处理后(酶切后的产物需去磷酸化处理)与HPH进行T4连接,挑取连接转化后的大肠杆菌菌落进行PCR验证。
1.3数据处理
采用GraphPad Prism 7.0和Data Processing System(DPS)软件进行数据处理和绘图。数据均为平均值±标准误,采用SPSS软件进行差异显著性分析。
2 结果与分析
2.1 PChyd基因克隆与生物信息学分析
以蝉拟青霉的基因组DNA和cDNA为模板,利用设计的特异性引物PC29和PC30进行Pchyd基因的扩增。凝胶电泳结果显示,从DNA和cDNA
模板中分别扩增出大约400 bp和300 bp片段(图2),两者之间有100 bp左右的差异,暗示该基因的序列中存在非编码区域。将2个PCR产物进行测序,测序结果如图3所示。蝉拟青霉PChyd基因DNA序列长度为417 bp,比mRNA序列大114 bp,该基因中存在2个非编码区域(图3)。将测序序列利用NCBI进行比对,发现该基因编码的蛋白属于疏水蛋白hydrophobin-2超家族,并且产物测序结果与基因组序列相一致,可以确认该基因为蝉拟青霉疏水蛋白基因PChyd。
M:1000 bp DNA Marker;—:为不添加模板的扩增,作为阴性对照;DNA:以蝉拟青霉基因组DNA为模板扩增;cDNA:以蝉拟青霉cDNA为模板扩增。
M: 1000 bp DNA Marker; —: Negative control (without DNA template); DNA: Genomic DNA as template; cDNA: cDNA as template.
圖2蝉拟青霉PChyd基因扩增电泳检测
绿色突出部分为起始密码子,红色突出部分为终止密码子。
The green highlight is the start codon and the red highlight is the stop codon.
2.2 PChyd基因序列生物信息学分析
PChyd的开放阅读框(ORF)序列全长303 bp,编码蛋白氨基酸序列全长100 aa(图3、图4),分子量为10.58 kDa,pI为5.68。结构域分析显示该蛋白包含信号肽区域和疏水蛋白功能区域。信号肽区域包含22 aa,疏水蛋白功能区域包含70 aa。利用MEGA 6.0软件对PChyd基因构建系统发育树(图5),结果显示真菌疏水蛋白hyd基因可分为小丛壳目(Glomerellales)和肉座菌目(Hypocreales)2个组,而肉座菌目(Hypocreales)
组疏水蛋白hyd基因又可分为3个亚组,分别包括肉座菌科(Hypocreaceae)、生赤壳科(Bionectri aceae)和虫草菌科(Cordycipitaceae)。蝉拟青霉PChyd与其他虫草菌科的真菌聚在一个分支上,与粗糙虫草菌(Cordyceps confragosa)的亲缘关系最近。将hyd基因系统发育树中的虫草菌科序列进行氨基酸序列比对(图6),结果发现虫草菌科的hyd基因保守度较高,完全保守的氨基酸有56个。
采用邻接法并进行1000次重复构建系统发育树;星号标记的为蝉拟青霉疏水蛋白。
Phylogenetic tree was constructed using neighbor-joining method, and percent bootstrap support from 1000 iterations;P. cicadaehydrophobin is marked as star.
2.3 PChyd表达模式分析
利用qRT-PCR方法对PChyd基因在不同培养条件(PDA和CM)或不同发育阶段(AP、BS和C)的表达模式进行检测(图7)。结果表明,PChyd基因在PDA、AP、BS中相对表达量分别为1.029±0.281、0.855±0.221、1.284±0.373。统计分析显示,三者之间差异不显著,但均显著高于CM(0.056±0.005)和C(0.161±0.045)的相对表达量。其中在BS状态下,PChyd基因表达量最高,表明该基因可能在蝉拟青霉附着胞(AP)和芽生孢子(BS)阶段具有重要作用。
2.4 PChyd敲除载体的构建
以蝉拟青霉基因组DNA为模板,使用引物PC31/PC32和PC33/PC34分别对PChyd基因的左、右臂片段进行扩增,结果如图8所示。通过PCR获得了长度为1182 bp的左臂和长度为874 bp的右臂。经Overlop PCR后将左、右臂融
PDA:在PDA中生长的菌丝体;CM:在CM培养基中生长的菌丝体;AP:诱导的附着胞;BS:诱导的芽生孢子;C:分生孢子。不同小写字母表示不同样品之间差异显著(P<0.05)。
PDA: Mycelium grown in PDA; CM: Mycelium grown in complete medium; AP: Induced appressorium; BS: Induced blastospore;C: Conidia. Different lowercase letters indicatesignificant differences at the 0.05 level.
合(片段大小为2008 bp),融合产物进行TA克隆构建pMD19-LR,TA克隆后的质粒经PmeI酶切处理和去磷酸化处理后,与HPH(1348 bp)进行T4连接,构建pMD19-hyd(载体理论大小为3356 bp),使用引物PC31/PC34进行菌落PCR验证,结果如图9所示。从左往右的第3、4、9泳道均能扩增出3500 bp左右的片段,该片段可能为插入HPH片段的敲除载体pMD19-hyd。经测序验证,该片段大小为3356 bp,与设计载体大小一致,包括1158 bp左臂、1348 bpHPH和850 bp右臂。测序结果确认该片段测定序列与设计序列一致,证明已成功构建PChyd的敲除载体,可用于后续转化实验。
3 讨论
在农业上,昆虫病原真菌作为一种重要的微生物资源,相较于化学农药更为安全环保,已广泛应用于农林虫害的生物防治[19]。了解昆虫病原真菌毒力相关基因及其致病机理,对于构建基因工程生防菌、提高防治效果和挖掘应用潜力极其重要。当前,白僵菌与绿僵菌毒力基因的研究已有大量报道,但有关蝉拟青霉致病机理、毒力相关基因研究尚未见报道。在前期研究中,本课题组对蝉拟青霉菌株(ZJ1611)基因组进行了测序。据已报道的白僵菌与绿僵菌的毒力基因特征,对蝉拟青霉毒力相关基因进行了筛选,共筛选出41类蛋白,共464个毒力相关基因。昆虫病原真菌的侵染过程可以概述为4个阶段:粘附阶段、萌发和穿透阶段、血腔中的繁育阶段、菌丝穿出虫体并产孢阶段[20]。根据毒力相关基因可能参与的昆虫病原真菌侵染昆虫的过程,前期筛选出3种可能参与粘附阶段的基因,分别是疏水蛋白(hyd rophobin)基因、细胞壁蛋白(cell wall protein)基因和MAP激酶(mitogen-activated protein kinase)基因。本研究选取1个可能参与侵染初期的毒力相关基因——疏水蛋白基因进行深入研究。以蝉拟青霉为供试材料,对PChyd基因进行克隆,并对该基因的核苷酸序列和氨基酸序列进行生物信息学分析。结果发现,该基因编码的蛋白属于hydrophobin-2超家族,并且多重序列比对发现该基因与其他几种虫草菌科菌株的疏水蛋白氨基酸序列的保守度较高,功能结构域分析也发现该基因具有疏水蛋白典型的信号肽和疏水蛋白功能区域[21-22]。这些结果都表明该基因属于疏水蛋白基因。
疏水蛋白是一类由高等丝状真菌在某一特定时期分泌产生的、具有特殊理化性质的小分子量(<20 kDa)蛋白质[23]。在昆虫病原真菌中,疏水蛋白参与了其对昆虫的侵染过程,是昆虫病原真菌重要的毒力相关基因[24]。早期研究已在多个昆虫病原真菌中发现了疏水蛋白基因。例如,在金龟子绿僵菌(Metarhizium anisopliae)、粉拟青霉(Paecilomyces farinosus)、球孢白僵菌(Beau veria bassiana)中,分别发现了疏水蛋白基因ssgA、pfah1、mHyd2[25-27]。但這些报道未对疏水蛋白基因在昆虫病原真菌致病机理方面进行阐述。随着真菌基因敲除技术的逐步成熟,疏水蛋白在昆虫侵染过程中的功能有了进一步研究。例如,通过对球孢白僵菌的疏水蛋白基因hyd1和hyd2敲除发现,突变菌株Δhyd1孢子疏水性降低,表面的碳水化合物表位和β-1,3-葡萄糖分布产生变化,毒力降低,但孢子粘附性未受影响。突变菌株Δhyd2孢子表面疏水性和粘附性均降低,但毒力不受影响。菌株Δhyd1、Δhyd2孢子的疏水性、粘附性和毒力均降低[28]。在对棕色绿僵菌(Metar hizium brunneum)的3个疏水蛋白基因敲除后发现,3个突变菌株的产孢能力下降,且分生孢子和芽生孢子侵染甜菜夜蛾(Spodoptera exigua)幼虫的毒力下降。除突变体Δhyd3外,其余2个突变体疏水性不变[29]。这些研究都表明,疏水蛋白基因在昆虫病原真菌侵染昆虫初期(第1阶段)和芽生孢子(第2阶段)中扮演着重要的角色。为分析蝉拟青霉疏水蛋白基因PChyd可能的功能,本研究对其在不同培养条件(PDA、CM)或不同发育阶段(AP、BS、C)的表达情况进行了检测,结果发现PChyd基因在AP(诱导的附着胞,侵染初期的侵染结构)、BS(诱导的芽生孢子,参与了昆虫血腔中定殖过程)中都显示了较高的表达量,与早期研究结果较一致。黄姗等[30]研究发现,虫生真菌莱氏野村菌hyd基因表达量随着分生孢子的产生而升高,到产孢量达到最大的第8天时,表达量最高,之后随着产孢量的下降,基因的表达量降低,推测该基因在莱氏野村菌分生孢子的形成过程中起着重要作用。而PChyd基因在C(分生孢子)中相对表达量较低,推测这种低水平的表达可能与静息细胞的代谢活性降低有关。Junges等[16]在金龟子绿僵菌(M. anisopliae)中也曾发现这种现象。
综上所述,在前期研究的基础上,本研究对蝉拟青霉疏水蛋白基因PChyd进行了克隆,对其序列进行了生物信息学分析,并分析了其在不同培养条件或不同发育阶段的表达模式,推测其可能参与病原真菌的生长、粘附、定值侵染过程,同时成功构建了该基因的敲除载体,为进一步研究该基因的致病机理奠定了基础,也为该菌的生防菌改造和应用提供了理论依据。
参考文献
- Meng X, Hu J, Ouyang G. The isolation and identification of pathogenic fungi from Tessaratoma papillosa Drury (Hemi ptera: Tessaratomidae)[J]. Peer J, 2017, 5(10): e3888.
- Zeng W, Yu H, Ge F, et al. Distribution of nucleosides in populations of Cordyceps cicadae[J]. Molecules, 2014, 19(5): 6123-6141.
- Fang M, Chai Y, Chen G, et al. N6-(2-hydroxyethyl)- adenosine exhibits insecticidal activity against Plutella xylostella via adenosine receptors[J]. PloS One, 2016, 11(9): e0162 859.
- 万永红, 蔡开明, 韦 曙. 蝉花的本草考证与生物学研究[J]. 江苏林业科技, 2013, 40(3): 50-53.
- 陈祝安, 黄基荣, 许益伟, 等. 蝉拟青霉防治菜粉蝶幼虫试验[J]. 生物防治通报, 1990(3): 131-133.
- 谭艾娟, 欧 翔, 刘爱英. 蝉拟青霉对蚕豆蚜虫致病性的初步研究[J]. 天津农业科学, 2009, 15(3): 50-52.
- 李 忠, 金道超, 邹 晓, 等. 蝉拟青霉对蚜虫的致病性研究[J]. 安徽农业科学, 2007(25): 7882-7883.
- 邹 曉, 刘爱英, 梁宗琦. 虫生真菌蝉拟青霉诱变株对温室白粉虱的致死因素分析[J]. 植物保护, 2007, 33(2): 73-76.
[9] Kershaw M J, Talbot N J. Hydrophobins and repellents: proteins with fundamental roles in fungal morphogenesis[J]. Fungal Genetics and Biology, 1998, 23(1): 18-33.
[10] Berger B W, Sallada N D. Hydrophobins: multifunctional biosurfactants for interface engineering[J]. Journal of Biological Engineering, 2019, 13: 10.
[11] Li W F, Gong Y B, Xu H J,et al. Identification properties of a recombinant class I hydrophobin rHGFI[J]. International Journal of Biological Macromolecules, 2015, 72: 658-663.
[12] Tao Y X, Chen R L, Yan J J,et al. A hydrophobin gene,Hyd9, plays an important role in the formation of aerial hyphae and primordia inFlammulina filiformis[J]. Gene, 2019, 706: 84-90.
[13] Zhang R Y, Hu D D, Gu J G,et al. Purification of a novel hydrophobin PN1 involved in antibacterial activity from an edible mushroomPleurotus nebrodensis[J]. European Journal of Plant Pathology, 2015, 143(4): 823-831.
[14] Dubey M K, Jensen D, Karlsson M. Hydrophobins are required for conidial hydrophobicity and plant root colonization in the fungal biocontrol agentClonostachys rosea[J]. BMC Microbiology, 2014, 14(1): 18.
[15] Duan Z B, Chen Y X, Huang W,et al. Linkage of autophagy to fungal development, lipid storage and virulence inMetar hizium robertsii[J]. Autophagy, 2013, 9(4): 538-549.
[16] Junges ?, Boldo J T, Souza B K,et al. Genomic analyses and transcriptional profiles of the glycoside hydrolase family 18 genes of the entomopathogenic fungusMetarhizium anisopliae[J]. PloS One, 2014, 9(9): e107864.
[17] Rio D C, Ares M J, Hannon G J,et al. Purification of RNA using TRIzol (TRI reagent)[J]. Cold Spring Harbor Protocols, 2010(6): 5439.
[18] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2?ΔΔCTmethod[J]. Methods, 2001, 25(4): 402-408.
[19] Hajek A E, Delalibera I. Fungal pathogens as classical biological control agents against arthropods[J]. BioControl, 2010, 55(1): 147-158.
[20] Butt T M, Coates C J, Dubovskiy I M,et al. Entomopathogenic fungi: new insights into host-pathogen interactions[J]. Advances in Genetics, 2016, 94: 307-364.
[21] He R L, Li C, Feng J,et al. A class II hydrophobin gene,Trhfb3, participates in fungal asexual development ofTrichoderma reesei[J]. FEMS Microbiology Letters, 2017, 364(8): fnw297.
[22] Gandier J A, Langelaan D N, Won A,et al. Characterization of a Basidiomycota hydrophobin reveals the structural basis for a high-similarity Class I subdivision[J]. Scientific Reports, 2017, 7: 45863.
[23] Berger B W, Sallada N D. Hydrophobins: multifunctional biosurfactants for interface engineering[J]. Journal of Biological Engineering, 2019, 13: 10.
[24] Valero-Jimenez C A, Wiegers H, Zwaan B J,et al. Genes involved in virulence of the entomopathogenic fungusBeau veria bassiana[J]. Journal of Invertebrate Pathology, 2016, 133: 41-49.
[25] Bidochka M J, Koning J D, Leger R J S. Analysis of a genomic clone of hydrophobin (ssgA) from the entomopathogenic fungusMetarhizium anisopliae[J]. Mycological Research, 2001, 105(3): 360-364.
[26] Lunkenbein S, Takenberg M, Nimtz M,et al. Characterization of a hydrophobin of the ascomycetePaecilomyces farinosus[J]. Journal of Basic Microbiology, 2011, 51(4): 404-414.
[27] Kirkland B H, Keyhani N O. Expression and purification of a functionally active class I fungal hydrophobin from the entomopathogenic fungusBeauveria bassianainE. coli[J]. Journal of Industrial Microbiology and Biotechnology, 2011, 38(2): 327-335.
[28] Zhang S Z, Xia Y X, Kim B,et al. Two hydrophobins are involved in fungal spore coat rodlet layer assembly and each play distinct roles in surface interactions, development and pathogenesis in the entomopathogenic fungus,Beauveria bassiana[J]. Molecular Microbiology, 2011, 80(3): 811-826.
[29] Sevim A, Donzelli B G, Wu D,et al. Hydrophobin genes of the entomopathogenic fungus,Metarhizium brunneum, are differentially expressed and corresponding mutants are decreased in virulence[J]. Current Genetics, 2012, 58(2): 79-92.
[30] 黄 姗, 王中康, 陈 环, 等. 莱氏野村菌疏水蛋白基因Nrhyd的克隆及其表达特征分析[J]. 菌物学报, 2012, 31(3): 350-358.

