稻瘟病菌丝氨酸/苏氨酸磷酸酶MoPpz1的功能研究分析
谢雨漫 张甜 蔡燕 张连虎 张冬梅


摘 要:稻瘟病菌(Magnaporthe oryzae)是一種在水稻不同生育期均能引起病害的真菌。在真核生物中,蛋白激酶CK2高度保守,包含2个调节亚基和2个催化亚基。稻瘟病菌中MoCKb1和MoCKb2分别编码MoCK2的2个调节亚基,MoCKa编码稻瘟病菌MoCK2的催化亚基。运用反向遗传学策略和同源重组原理,对MoCKa-GFP的pull-down实验结果中获得的一个丝氨酸/苏氨酸磷酸酶MoPpz1进行功能分析。经过生物信息学研究分析发现Ppz1在不同的真菌中具有不同的功能,同时与其他模式真菌的Ppz1蛋白序列具有较高同源性。在获得基因敲除突变体后,通过表型分析发现,与野生型Ku80相比,ΔMoppz1突变体菌落的营养生长和产孢量等方面均无明显差异,但分生孢子的萌发和附着胞的形成滞后于野生型菌株,且对水稻的致病能力减弱。激光共聚焦显微分析表明,MoPpz1定位在菌丝、分生孢子和附着胞的细胞质中。综上所述,蛋白磷酸酶MoPpz1可能参与稻瘟病菌分生孢子萌发、附着胞形成以及对水稻致病性的调控。
关键词:稻瘟病菌;基因敲除;ΔMoppz1;功能分析中图分类号:S435.111.4+1 文献标识码:A
Functional Analysis of Serine/Threonine Phosphatase MoPpz1 in Magnaporthe oryzae
XIE Yuman, ZHANG Tian, CAI Yan, ZHANG Lianhu, ZHANG Dongmei*
College of Plant Protection, Fujian Agriculture and Forestry University / State Key Laboratory of Ecological Pest Control for Fujian and Taiwan Crops, Fuzhou, Fujian 350002, China
Abstract: Magnaporthe oryzae is a fungal pathogen causing blast disease in different stages of rice. In eukaryotes, the highly conserved protein kinase CK2 contains two regulatory subunits and two catalytic subunits. MoCK2, CK2 homologus in M. oryzae,is encoding by three genes, MoCKb1 and MoCKb2 encode two different regulatory subunits, and MoCKa encodes its catalytic subunit. MoPpz1, one of serine/threonine phosphatase obtained by pull-down assay of MoCKa-GFP inM. oryzae, was researched at its function by reverse genetic approache and homologous recombination principle in our study. It was found that Ppz1 had different functions in various fungi by bioinformatics analysis, and showed that Ppz1 and its homolog proteins in other model fungi had highly identity in the protein sequences.ΔMoppz1mutant obtained by gene knock-out and genotyping screen, while the mutant was not affected in vegetative growth and conidial production, the mutant showed development delay of conidium from germination to appressorium and reduced pathogenicity to rice after phenotypic assay comparing with wildtype strain Ku80. Confocal laser scanning microscopy analysis showed that MoPpz1 was localized in the cytoplasm of hyphae, conidium and appressorium. In conclusion, the protein phosphatase MoPpz1 may be involved in the regulation of conidial germination, appressorial formation inM. oryzaeand pathogenicity to rice.
Keywords: Magnaporthe oryzae; gene knockout;ΔMoppz1; functional analysis
DOI: 10.3969/j.issn.1000-2561.2020.07.019
在真核细胞中,蛋白激酶一般負责蛋白质的磷酸化,而蛋白磷酸酶负责蛋白质的去磷酸化。它们相反方向的作用不仅共同调控着蛋白质的磷酸化水平,而且调节细胞各种生理活动,具体包括细胞间通讯、细胞增殖与分化、信号转导和胞内转运等[1-4]。蛋白的磷酸化主要发生在3个含有羟基的丝氨酸、苏氨酸和酪氨酸上。同理,根据作用底物的位点不同,磷酸酶分为酪氨酸磷酸酶和丝氨酸/苏氨酸磷酸酶。相比蛋白激酶的研究进展情况,目前对蛋白磷酸酶的研究还相对不足[5-6]。对蛋白磷酸酶进行深入研究将有利于从去磷酸化的角度来阐释细胞的生理机制。
蛋白激酶CK2是真核生物中一类高度保守的四亚基复合体,包括2个催化亚基和2个调节亚基。在稻瘟病菌中,有3个基因分别编码蛋白激酶CK2,其中1个基因MGG_03696(命名为MoCKa)编码CK2的2个催化亚基,另外2个基因MGG_00446(命名为MoCKb1)和MGG_05651(命名为MoCKb2)分别编码CK2的2个调节亚基[7-8]。本研究对稻瘟病菌MoCKa的pull-down实验获得的1个丝氨酸/苏氨酸磷酸酶MGG_00149展开功能研究。MGG_00149在酵母中的同源蛋白为Ppz1,故将其命名为MoPpz1。Ppz1与磷蛋白质磷酸酶家族(PPPs)中常见的PP1相比,Ppz1磷酸酶仅限于真菌[6,9,10-11]。在不同的真菌中,Ppz1具有不同的功能。在酿酒酵母(Saccharomyces cerevisiae)中,Ppz1的缺失使酵母耐受钠离子和锂离子的毒性增加,从而影响细胞壁完整性、细胞周期、翻译效率和渗透压稳定性等重要的细胞生理过程[9,12-16]。而裂殖酵母(Schizosaccharomyces pombe)Ppz1调节其对盐的耐受性[17]。在粗糙脉孢菌(Neurospora crassa)中,Ppz1调节耐盐性、细胞壁完整性和细胞周期等[18]。在白色念珠菌(Candida albicans)中,Ppz1与阳离子平衡、细胞壁完整性和致病性有关[19]。在构巢曲霉(Aspergillus nidulans)中,Ppz1虽然不影响耐盐性和细胞壁完整性,但与在酿酒酵母(S. cerevisiae)和白色念珠菌(C. albicans)等其他模型生物中一样,Ppz1缺失都会增加对氧化胁迫的敏感性[20]。
稻瘟病是世界范围内危害水稻的三大病害之一。稻瘟病菌是阐明植物真菌病害分子基础的重要模式生物[21]。因此,运用反向遗传学策略,利用同源重组原理,对基因MoPpz1进行基因敲除和基因回补;参照野生型,分析ΔMoppz1突变体和ΔMoppz1-Com(敲除和回补)在营养生长、产孢量和对水稻的致病性等生物性状方面的异同,进而阐释其生物学功能。通过对该基因功能的研究和分析,以期对稻瘟病菌致病机制研究和稻瘟病防治提供一定的理论基础。
1 材料与方法
1.1 材料
1.1.1 供试植物 实验材料易感病水稻品种CO39,保存于福建农林大学功能基因组学研究中心(真菌实验室)。
1.1.2 供试菌株和载体 稻瘟病菌野生型菌株Guy11及背景菌株Ku80,基因敲除所获得的突变体及回补菌株等均保存于福建农林大学功能基因组学研究中心(真菌实验室)。带有潮霉素磷酸转移酶基团(HPH)的载体pBS-HYG用于构建ΔMoppz1突变体敲除载体(pBS-HYG-ko)。pKNTG-GFP用于构建在Ku80背景下的敲除的ΔMoppz1突变体的回补载体(pKNT-GFP-com)。所有菌株和载体均保存于福建农林大学功能基因组学中心(真菌实验室)。
1.1.3 试剂及测序 无水乙醇、氯仿及苯酚等常规试剂均从国药集团化学试剂(北京)有限公司购买;所用引物均由擎科生物技术(广州)有限公司和生工生物工程股份(上海)有限公司生物合成;质粒测序由擎科生物技术(广州)有限公司完成;凝胶DNA纯化回收试剂盒以及质粒提取试剂盒均由天根生化科技(北京)有限公司和美基生物科技(广州)有限公司提供;限制性内切酶由诺唯赞生物技术(南京)有限公司提供;普通Taq酶、KOD plus Neo酶、T4连接酶和多片段无缝克隆酶等均由Takara公司(北京)提供;Southern杂交试剂盒由泰京生物技术(厦门)有限公司代为订购。
1.2 方法
1.2.1 生物信息学分析 根据NCBI数据库(https://www.ncbi.nlm.nih.gov/)中找到丝氨酸/苏氨酸蛋白磷酸酶MoPpz1蛋白序列,并在NCBI数据库中进行BLAST对比分析,得到其在各个模式真菌中的同源蛋白,再用MEGA 7.0软件,采用Neighbor-joining方法构建进化树。
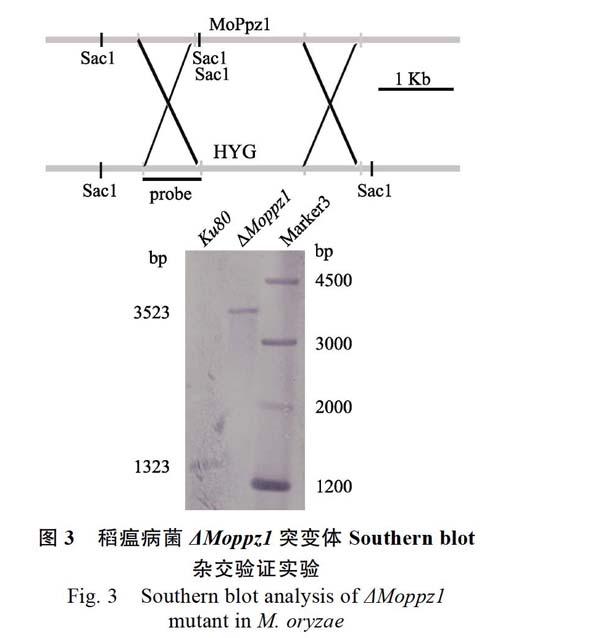
1.2.2 重組片段的扩增和转化子的筛选 采用同源重组的方法进行目的基因敲除。在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中找到目的基因的DNA序列,在其开放阅读框(ORF)区域上下游分别选择长度为1000 bp左右的片段(命名为A、B片段),设计引物MoPpz1-AF和-AR、MoPpz1-BF和-BR,分别添加合适的酶切位点,进行目的基因上下游片段PCR扩增,通过酶切、回收和连接实验将上下游同源片段连接到有潮霉素磷酸转移酶基团(HPH)标签的载体pBS-HYG的两端,进行基因敲除载体的构建。然后,在Ku80背景下,制备原生质体,并进行原生质体转化,通过潮霉素选择压力进行转化子的初步筛选。提取稻瘟病菌转化子DNA,引物MoPpz1-OF和-OR扩增MoPpz1部分ORF片段;引物MoPpz1-UA-F和H853扩增A片段上游和潮霉素内部片段。ORF扩增不到片段且UA扩增得到片段的转化子,进一步经过Southern blot验证确定基因敲除转化子。
在NCBI数据库(https://www.ncbi.nlm.nih. gov/)上找到基因ORF区上游3000 bp的基因序列,然后在网站promoter 2.0(http://www.cbs.dtu. dk/services/Promoter/)进行启动子预测,根据预测的结果、ORF和所选择的载体进行引物设计和载体构建。互补载体构建选用多片段无缝克隆方法,将片段分别进行扩增后,再用多片段无缝克隆酶将多片段进行连接,将构建好的载体转入敲除突变体原生质体中,经分子验证和荧光检测获得正确的回补转化子。该实验所用引物序列见表1。
1.2.3 表型分析 菌落形态观察及生长速率的测定:在实验相关菌株SYM平板的菌落外缘,用直径0.5 cm的打孔器打孔,取直径0.5 cm的菌丝块,分别接种在新的SYM平板中央,在培养箱中倒置培养10 d后,测量并记录菌落生长的直径,然后拍照。
产孢量的统计:用2 mL无菌水洗下培养基表面的孢子,再用擦镜纸过滤到2 mL离心管中后,用无菌水将孢子液定容至2 mL。最后,吸取10 μL孢子液于血球计数板上,用血球计数板在显微镜下统计孢子数目。
孢子萌发率和附着胞形成率的统计:用无菌水收集孢子液并将浓度调至15×104个/mL左右。
用10 μL无菌水将疏水盖玻片(Fisher brand公司产品)固定在载玻片上(防止疏水盖玻片在实验过程中随意滑动),再在疏水玻片表面滴上10 μL孢子液,放在保湿盒中进行保湿和黑暗处理,分别在4、8、12 h时在显微镜下观察孢子萌发率和附着胞形成率并记录。
水稻致病性测定:用含0.025% (W/V) Tween 20的无菌水收集孢子液并将浓度调至8×104个/mL左右。对3叶1心时期的水稻易感病品种CO39进行喷雾接种,黑暗保湿24 h后,光照保湿5~7 d。观察水稻发病实际情况后,再对实验结果进行扫描保存。
以上实验均重复3次,每次每个菌株均3个重复,并根据实验所得数据进行计算和处理。
2 结果与分析
2.1 稻瘟病菌MoPpz1生物信息学分析
对稻瘟病菌Ppz1与其他不同真菌(镰刀菌、酵母菌、粗糙脉孢菌和灰霉菌等)Ppz1同源蛋白用MEGA 7.0采用Neighbor-joining构建进化树(图1)。从该进化树可以看出MoPpz1和NcPpz1在同一个分支上,说明这两者的亲缘关系较近。同时,稻瘟病菌MoPpz1与这些真菌同源蛋白(镰刀菌、酵母菌、粗糙脉孢菌和灰霉菌等)氨基酸序列比对分析结果显示,在不同模式的真菌中,MoPpz1蛋白序列高度保守(图2)。
2.2 稻瘟病菌MoPpz1基因功能分析
2.2.1 稻瘟病菌MoPpz1基因敲除突变体和互补菌株的筛选和验证 利用带潮霉素磷酸转移酶基团(HPH)标签的载体pBS-HYG构建敲除载体(pBS-HYG-ko),转入菌株Ku80原生质体中,经过一系列的筛选和验证,获得了敲除突变体(图3,即ΔMoppz1突变体的Southern blot验证)。同理,把构建好的互补载体(pKNT-GFP-com)转入敲除突变体的原生质体中,筛选和验证后,最终获得互补菌株。
2.2.2 菌落生长速度和产孢量统计 根据对在SYM平板上生长10 d的菌落进行半径测量和拍照,发现稻瘟病菌MoPpz1基因敲除不影响菌落的生长(图4)。这说明MoPpz1基因缺失不影响稻瘟病菌的营养生长。同时,对ΔMoppz1突变体的产孢量进行了统计,发现MoPpz1基因的缺失不影响产孢量(表2)。
2.2.3 孢子萌发率和附着胞形成率 通过对野生型、突变体和互补菌株在4、8、12 h不同时间段的孢子萌发率和附着胞形成率实验发现,突变体的孢子萌发率在萌发前期滞后于野生型,在萌发后期和野生型相似,而突变体的附着胞形成在整个发育时间段均滞后于野生型,实验结果表明MoPpz1基因缺失影响稻瘟病菌的孢子萌发和附着胞形成(表3,表4)。
2.2.4 致病性分析 用相关菌株的孢子悬浮液对活体水稻叶片进行致病性分析。通过对水稻病斑观察发现(图5),与野生型产生的典型的梭形病斑相比,突变体影响病斑在水稻叶片上的扩展,突变体产生的病斑多为细点状,同时,统计水稻叶片病斑数量也证明了在ΔMoppz1突变体对水稻进行活体喷雾接种后,ΔMoppz1突变体产生的扩展病斑数量更少(表5)。这些均说明MoPpz1基因缺失影响其对水稻的致病性。
2.2.5 定位分析 为了确定稻瘟病菌MoPpz1基因在细胞内的定位情况,构建了GFP在N端的载体MoPpz1-GFP,转入野生型的原生质体后,经过筛选和验证得到了突变体。激光共聚焦显微分析确定了该蛋白在菌丝(图6)、分生孢子(图7)和附着胞(图7)的定位均在细胞质中。
3 讨论
稻瘟病菌中编码蛋白激酶CK2包括1个催化亚基(MoCKa)和2个调节亚基(MoCKb1、
MoCKb2)。该研究中的MoPpz1是通过MoCKa的pull-down实验中获得的一系列基因中的一个丝氨酸/苏氨酸磷酸酶。说明MoPpz1可能和MoCKa之间有互作。通过酵母双杂交实验验证发现MoPpz1和MoCKa并无直接互作;同时,也验证了MoPpz1和蛋白激酶CK2 2个调节亚基(MoCKb1、MoCKb2)的互作情况,证实MoPpz1与调节亚基之间也无直接互作。在细胞内,由于调节亚基和催化亚基构成全酶发挥功能,所以可以认为它们可能是通过MoCK2全酶或其他组分蛋白或某个接头蛋白与MoPpz1间接互作。
另外,生物信息学分析发现,稻瘟病菌Mo Ppz1与粗糙脉孢菌Ppz1亲缘关系较近,在进化上是保守的,但是在不同的真菌中,Ppz1具有不同的功能。例如,在白色念珠菌(C. albicans)和烟曲霉(A. fumigatus)中的Ppz1是决定致病性的因素,而在玉米黑粉菌(Ustilago maydis)中,Ppz1不是决定致病性的因素[11]。研究发现稻瘟病菌ΔMoppz1突变体在易感病水稻叶片上多为细点状病斑,这也说明稻瘟病菌Ppz1蛋白在对水稻致病性方面发挥了一定作用。
表型分析结果显示稻瘟病菌MoPpz1基因缺失不影响其营养生长和产孢数量,但是突变体的孢子萌发率在萌发前期滞后于野生型,附着胞形成率在整个发育时间段均滞后于野生型。这表明MoPpz1与稻瘟病菌的孢子萌发和附着胞形成过程直接相关。MoPpz1基因敲除突變体进行基因回补时,在MoPpz1基因N端融合了1个GFP荧光标签。激光共聚焦显微分析发现,无论在菌丝、孢子还是附着胞,MoPpz1均定位在细胞质中。今后的研究中可以进一步探索MoPpz1基因敲除突变体对减弱水稻致病性是否与穿透植物细胞表皮的能力相关;通过水稻叶鞘侵染实验等进行深入研究,从该基因敲除是否影响稻瘟病菌在植物细胞内的侵染生长和拓展的角度,解释稻瘟病菌MoPpz1基因对水稻致病力减弱,进而为稻瘟病菌防治提供一定的理论依据。
参考文献
- Lim S, Smith K R, Lim S T, et al. Regulation of mitochondrial functions by protein phosphorylation and dephosphorylation[J]. Cell and Bioscience, 2016, 6: 25.
- Korrodi-Gregório L, Esteves S L, Fardilha M. Protein phosphatase 1 catalytic isoforms: specificity toward interacting proteins[J]. Translational Research, 2014, 164(5): 366-391.
- Chen M J, Dixon J E, Manning G. Genomics and evolution of protein phosphatases[J]. Science Signaling, 2017, 10(474): eaag1796.
- Delong A. Switching the flip: protein phosphatase roles in signaling pathways[J]. Current Opinion in Plant Biology, 2006, 9(5): 470-477.
- Shi Y. Serine/threonine phosphatases: mechanism through structure[J]. Cell, 2009, 139(3): 468-484.
- 云英子. 禾谷镰刀菌磷酸酶组功能研究[D]. 杭州: 浙江大学, 2015.
- Zhang L, Zhang D, Chen Y, et al. Magnaporthe oryzae CK2 accumulates in nuclei, nucleoli, at septal pores and forms a large ring structure in appressoria, and is involved in rice blast pathogenesis[J]. Frontiers in Cellular and Infection Microbiology, 2019, 9: 113.
- 张连虎. 稻瘟病菌中蛋白激酶MoCK2对产孢以及致病性的重要调控作用[D]. 福州: 福建农林大学, 2019.
- Molero C, Casado C, Ari?o J. The inhibitory mechanism of Hal3 on the yeast Ppz1 phosphatase: A mutagenesis analysis[J]. Scientific Reports, 2017, 7(1): 8819.
- Ari?o J, Velázquez D, Casamayor A. Ser/Thr protein phosphatases in fungi: structure, regulation and function[J]. Microbial Cell, 2019, 6(5): 217-256.
[11] Zhang C, de la Torre A, Pérez-Martín J,et al. Protein phosphatase Ppz1 is not regulated by a Hal3-like protein in plant pathogenUstilago maydis[J]. International Journal of Molecular Sciences, 2019, 20(15): 3817.
[12] Posas F, Camps M, Ari?o J. The PPZ protein phosphatases are important determinants of salt tolerance in yeast cells[J]. The Journal of Biological Chemistry, 1995, 270(22): 13036- 13041.
[13] Lee K S, Hines L K, Levin D E. A pair of functionally redundant yeast genes (PPZ1 and PPZ2) encoding type 1-rela ted protein phosphatases function within the PKC1-mediated pathway[J]. Molecular and Cellular Biology, 1993, 13(9): 5843-5853.
[14] Clotet J, Garí E, Aldea M,et al. The yeast ser/thr phosphatases sit4 and ppz1 play opposite roles in regulation of the cell cycle[J]. Molecular and Cellular Biology, 1999, 19(3): 2408- 2415.
[15] Yenush L, Merchan S, Holmes J,et al. pH-Responsive, posttranslational regulation of the Trk1 potassium transporter by the type 1-related Ppz1 phosphatase[J]. Molecular and Cellular Biology, 2005, 25(19): 8683-8692.
[16] Merchan S, Bernal D, Serrano R,et al. Response of theSaccharomyces cerevisiaeMpk1 mitogen-activated protein kinase pathway to increases in internal turgor pressure caused by loss of Ppz protein phosphatases[J]. Eukaryot Cell, 2004, 3(1): 100-107.
[17] Balcells L, Gomez N, Casamayor A,et al. Regulation of salt tolerance in fission yeast by a protein-phosphatase-Z-like Ser/Thr protein phosphatase[J]. European Journal of Biochemistry, 1997, 250(2): 476-483.
[18] Vissi E, Clotet J, de Nadal E,et al. Functional analysis of theNeurospora crassaPZL-1 protein phosphatase by expression in budding and fission yeast[J]. Yeast, 2001, 18(2): 115-124.
[19] Adám C, Erdei E, Casado C,et al. Protein phosphatase CaPpz1 is involved in cation homeostasis, cell wall integrity and virulence ofCandida albicans[J]. Microbiology, 2012, 158(Pt 5): 1258-1267.
[20] Leiter ?, González A, Erdei ?,et al. Protein phosphatase Z modulates oxidative stress response in fungi[J]. Fungal Genetics and Biology, 2012, 49(9): 708-716.
[21] Dean R A, Talbot N J, Ebbole D J, et al. The genome sequence of the rice blast fungusMagnaporthe grisea[J]. Nature, 2005, 434(7036): 980-986.

