威兰胶发酵液脱除菌体的酶解工艺研究
刘建国,谭雯斐,姚传凯,朱虎
(中国石油大学(华东)化学工程学院,山东青岛266580)
威兰胶是一类微生物多糖[1],因其具有高稳定性、高粘度、剪切稀释性等优异特性,使其成为继黄原胶和结冷胶之后更具市场前景的微生物胞外多糖[2]。另外,由于威兰胶发酵液粘度高,杂质多,导致威兰胶现有提取工艺(如醇析法、盐醇析法、膜分离法等)效率低下,分离成本高[3]。特别是经上述提取工艺获得的威兰胶产品中含有大量的菌体及杂蛋白,限制了其在食品、化妆品以及医药等领域的应用[4]。
本文选用鞘氨醇单孢杆菌(Sphingomonassp.WG)作为威兰胶的生产菌株[5-6],利用溶菌酶为催化剂,对脱除威兰胶发酵液中菌体的酶解工艺进行了深入研究,获得了最适反应条件,为最终的威兰胶产品在医药、化妆品及食品行业中的应用奠定创造了条件。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种及培养基
鞘氨醇单孢杆菌:由作者所在实验室从海水样品中筛选获得,现保藏于中国典型培养物保藏中心(保藏号:CCTCC No.M2013161)。
培养基组成:酵母膏2 g/L,葡萄糖40 g/L,K2HPO44 g/L,KH2PO42 g/L,MgSO40.1 g/L,pH调为7.0~7.2。
1.1.2 试剂
溶菌酶(10 000 U/mg,美国Sigma公司),乙醇(体积分数95 %,工业级),三氯乙酸、葡萄糖、磷酸氢二钾、磷酸二氢钾、无水硫酸镁等购买于国药集团化学试剂有限公司,均为分析纯。
1.2 仪器与设备
UV-2450型紫外分光光度计(日本Shimadzu公司);HYG-C型多功能组合摇床(太仓市实验设备厂);SW-CJ-1F型超净工作台(苏州安泰空气技术有限公司);3-15K型离心机(德国Sigma公司);RET BASIC型加热磁力搅拌器(德国IKA公司);MS 3型漩涡混合器(德国IKA公司);DHG-9146型电热恒温干燥箱(上海精宏实验设备有限公司);IDK13-2006型低温恒温槽(上海精宏实验设备有限公司)。
1.3 方法
1.3.1 培养方法
将鞘氨醇单孢杆菌种子液以体积分数5 %转接至培养基中,在32.5 ℃、175 r/min下发酵72 h得到黄色粘稠状的威兰胶发酵液。
1.3.2 菌体含量测定
本文利用三氯乙酸溶液(5 %)提取菌体中的总核酸进行菌体含量测定,操作过程如下:
取威兰胶发酵液(或溶菌酶处理后的发酵液)5 mL,在室温下离心15 min(12 000×g),取沉淀;用5 mL去离子水将沉淀悬浮,充分混匀后再次离心,以去除残留的培养基,重复此清洗过程3次,获得最终的沉淀物;然后,将沉淀物放入20 mL的三氯乙酸溶液(5 %)中混匀,在80 ℃水浴中静置30 min后,立即放入冰水中冷却;将混合溶液在4 ℃下离心10 min(8 000×g),取上清液,测定其在260 nm波长处的吸光值(A260 nm)。
菌体去除率(η)根据式(1)、(2)计算获得:
(1)
(2)
其中,CNA为总核酸浓度(mg/mL);A260nm为吸光度;n为稀释倍数;0.022为总核酸浓度为1 mg/mL时的吸光度。
1.3.3 威兰胶的制备
取一定体积的发酵液,与5.5倍体积的酒精(95 %)充分混匀后,在室温下放置6 h,经过滤得到沉淀物;利用适量的酒精(95 %)对沉淀物进行洗涤,以去除可能粘附的盐离子和培养基,再分别经过烘干、粉碎和筛分(200目),获得威兰胶粉末。
1.3.4 溶菌酶降解菌体的反应过程
本文利用溶菌酶降解威兰胶中菌体的反应过程在密闭的夹层玻璃反应器中进行。夹层中的恒温水浴控制反应的温度,而搅拌速率则由磁力搅拌器加以调控。反应开始前,先向反应器中加入30 mL威兰胶发酵液,设定反应温度及搅拌速率,然后加入适量的溶菌酶溶液,并利用橡胶塞将反应器密封(减少溶剂的挥发),同时开始计时。
2 结果与分析
2.1 反应温度对菌体去除率的影响
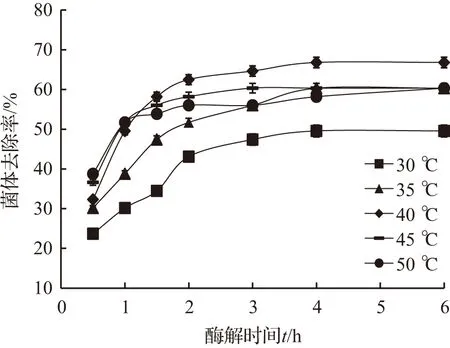
图1 反应温度对菌体去除率的影响Fig.1 Effect of reaction temperature on the bacteria removal rate
反应温度对菌体去除率的影响见图1。
反应温度是影响酶活的重要因素[7],根据溶菌酶的产品说明,本实验设定拟考察的酶解温度范围是30~50 ℃,其他反应条件为pH 6.0、加酶量2 %、搅拌速率500 r/min。
图1中的实验结果表明,在反应初期(反应时间<2 h),菌体去除率增长较快,但随着反应时间的延长,菌体去除率的增长开始变的缓慢,最后趋于平稳。此外,在考察的30~50 ℃范围内,菌体去除率随着反应温度的升高呈现出先增加后降低的趋势,并在40 ℃时获得最大值(65.2 %)。酶都存在一个最适的催化温度和一个能够维持其活性的温度范围,当温度超过此范围时,酶的空间立体结构就会发生变化,导致活性丧失。根据图1所示的结果,本实验确定40 ℃作为最佳反应温度。
2.2 溶液pH值对菌体去除率的影响
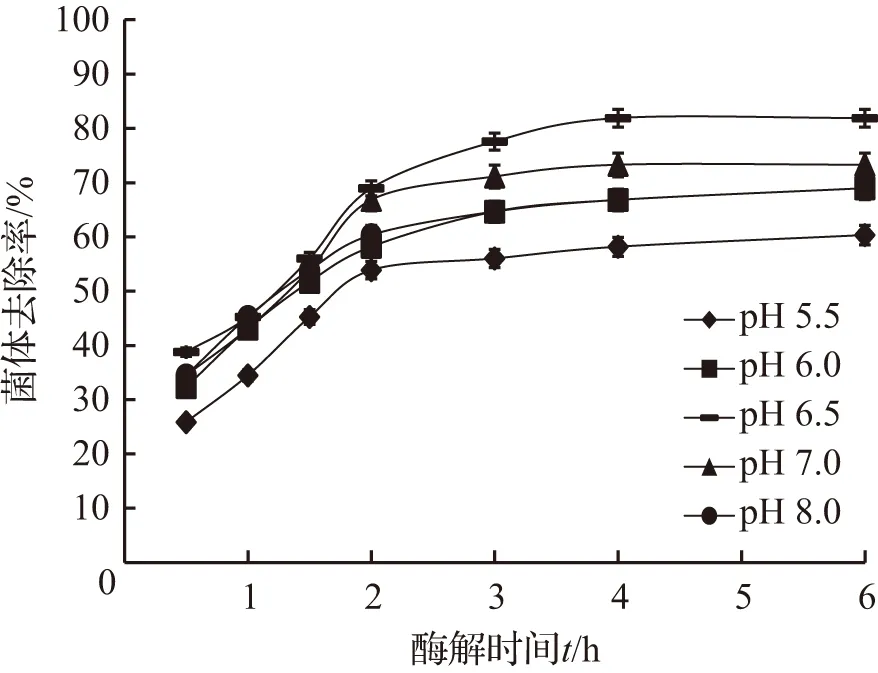
图2 溶液pH值对菌体去除效果的影响Fig.2 Effect of solution pH on the bacteria removal rate
反应体系的pH值也是影响酶活的重要因素[8],因此本实验考察了溶液pH值(pH 5.5~8.0)对菌体去除率的影响,其他反应条件为:40 ℃、加酶量2 %、搅拌速率500 r/min,实验结果如图2所示。
由图2可以看出,在所考察的溶液pH值范围内,随着pH值的升高,菌体去除率呈现出先增加后降低的趋势,并在pH 6.5时获得最大值(81.9 %)。另外,菌体去除率随时间的变化规律与图1基本相同,即在反应初期(反应2 h内),菌体去除率增长较快,但随着反应时间的延长,去除率增长趋缓,当反应时间超过4 h后趋于平稳。因此确定适宜的反应体系pH值为6.5。
2.3 加酶量对菌体脱除率的影响

图3 溶菌酶用量对菌体去除率的影响Fig.3 Effect of enzyme amount on the bacteria removal rate
为了降低酶解过程的成本,本实验考察了溶菌酶用量对菌体去除率的影响,其他反应条件为:40 ℃、pH 6.5、搅拌速率500 r/min,结果如图3所示。
实验结果表明,在反应初期(反应时间<2 h),随着溶菌酶用量的增加,菌体去除率逐渐升高;但是当反应时间超过2 h后,即使溶菌酶用量从1 %增加至6 %,菌体去除率却无明显变化。因此,从降低生产成本的角度考虑,确定1 %的溶菌酶用量为最佳反应条件。
2.4 搅拌速率对菌体去除率的影响

图4 搅拌速率对菌体去除率的影响Fig.4 Effect of stirring speed on the bacteria removal rate
考虑到威兰胶溶液的高粘度会影响酶催化反应的传质过程,而搅拌不仅能够改善反应体系的传质效果,同时还能降低威兰胶溶液的粘度(即威兰胶的剪切稀释性能)。因此,本实验考察了搅拌速率(400~800 r/min)对菌体去除率的影响,结果见图4。
由图4可以看出,在反应初期(反应时间<2 h),菌体去除率基本上随着搅拌速率的增加而升高;当反应时间超过2 h后,菌体去除率增势减缓,最后趋于稳定,且菌体去除率在搅拌速率为600 r/min时获得最大值(86.2 %)。这是因为在反应初期,搅拌速率的增加使得威兰胶溶液的粘度逐渐降低,这有利于反应体系的传质过程,增加了溶菌酶与菌体的接触机会。此外,威兰胶溶液的剪切稀释性能只在一定的搅拌速率范围内最为显著,当搅拌速率超过一定数值后,效果则变得不明显。因此,确定搅拌速率为600 r/min为最佳反应条件。
2.5 威兰胶醇析工艺对菌体的去除效果
乙醇沉淀法(即醇析法)是提取威兰胶的常用工艺,该工艺涉及有机溶剂的使用和烘干等,这些操作均能够对菌体的破碎起到一定的效果。因此,本文采用乙醇沉淀法,以未经酶解处理和经过酶解处理的威兰胶发酵液为原料,对威兰胶进行了提取,并测定了各样品中的菌体含量。结果表明,从未经酶解处理的发酵液提取的威兰胶样品中,残留有60.3 %的菌体,而从经过酶解处理的发酵液提取的威兰胶样品中仅剩余6.4 %的菌体。这说明利用溶菌酶对威兰胶发酵液进行脱除菌体的操作,大幅度降低了威兰胶产品中菌体的含量,提高了威兰胶的品质。
3 结论
本文以溶菌酶为催化剂,对鞘氨醇单孢杆菌(Sphingomonassp.WG)生产的威兰胶发酵液进行了脱除菌体的酶解工艺研究,考察了反应温度、pH值、酶用量和搅拌速率对菌体去除率的影响,获得最佳酶解工艺为40 ℃,pH 6.5,溶菌酶加入量1.0 %,搅拌速率600 r/min。在此条件下,威兰胶发酵液中蛋白质的去除率为89.2 %。该发酵液经醇沉工艺提取后,威兰胶产品中菌体去除率为93.6 %,与未经酶解工艺处理的威兰胶产品相比,菌体含量降低了53.9 %。

