松江鲈IL 15 Rα的结构特征与表达分析
林日锦,隗涵涵,钟金妙,刘莹莹
(山东大学(威海)海洋学院,山东威海 264209)
白细胞介素15(IL 15)是4α螺旋细胞因子家族中的主要成员之一[1],通过与膜受体复合物IL 15R的相互作用,在适应性免疫系统中发挥重要生物功能。IL 15R包括3个亚基:IL 15Rα、IL 15 Rβ及IL 15 Rγc。β链及γc链为IL 15与白细胞介素2(IL 2)的共享亚基,也是两者在结构与功能特征上重叠的基础[2-4];α链具有特异性,介导不同的信号通路,使IL 2与IL 15产生不同生理效应。IL 15Rα的mRNA存在于各种免疫或非免疫细胞和组织[5]。转录水平的IL 15Rα存在多种可变剪接形式,并能引发不同的信号通路[6]。蛋白水平上的IL 15R除以膜蛋白形式分布在细胞膜表面外,还能自发地或经诱导后从膜表面脱落形成可溶性受体,并通过拮抗作用抑制IL 15与膜受体的结合[7]。
IL 15Rα因其与IL 15的高亲和力及特异结合能力而最初分离于人体[8-9]。人的IL 15Rα由7个外显子组成,编码263个aa的蛋白多肽[9],且其胞外区段具有特殊的sushi结构域,在与IL 15的结合中发挥关键作用[10]。在哺乳动物中IL 15Rα结构与功能相关研究较多,在非哺乳动物中,鸡(Gallusgallus)的IL 15Rα首次被发现,其IL 15Rα亚基类似于哺乳动物,参与IL 15信号介导[11]。在2006年之前,还未见有关鱼类IL 15Rα的研究报道。红鳍东方鲀(Takifugu rubripes)IL 15Rα同源基因的克隆鉴定是鱼类中的首例[12];从虹鳟(Oncorhynchusmykiss)中也克隆到了鱼类的IL 15Rα基因,并发现3种选择剪接方式,其后也从其他硬骨鱼中鉴定或预测到了IL 15Rα[13]。
本次研究材料为松江鲈(Trachidermus fasciatusHeckel),松江鲈隶属于鲉形目(Scorpaeniformes),杜父鱼科(Cottidae),松江鲈属,是一种近海溯河洄游的肉食性鱼类,已被列为国家Ⅱ级保护动物[14-15]。目前,有关松江鲈IL 15Rα基因的研究尚未见报道。本实验克隆得到松江鲈IL 15Rα基因(命名为TfIL 15Rα),对其序列结构特征进行了分析,利用qRT PCR技术研究了IL 15Rα的mRNA在鱼体内的分布和免疫刺激后基因应答情况,并对其与IL 15免疫刺激后的表达情况进行了系统分析比较。
1 材料与方法
1.1 材料与组织样品制备
实验动物为取自山东省文登埠口松江鲈自然保护区9~10月龄的松江鲈(体质量约15~23 g)。实验前经充气海水(12~14℃)饲养一周后进行正常组织的RNA提取:先挑选健康个体进行麻醉,心脏取血后解剖取其心脏、肝脏、鳃、肠、皮肤、肾脏、脾脏、脑、卵等组织,立即放入Trizol中研磨。
进行脂多糖(lipopolysaccharides,LPS)刺激实验时,将100条生长状况相同的松江鲈平均分成两组,实验组腹腔注50μL(0.04 mg·kg-1)的LPS,对照组注射同体积无菌生理盐水。经LPS刺激后分别于0、2、6、12、24、48、72、96 h麻醉取样(每次6条),各从血、皮肤、肝脏和脾脏中提取总RNA。
1.2 总RNA的提取和cDNA合成
从各组织样品中提取总mRNA是以Trizol(Invitrogen公司)的实验说明为依据进行操作,并参照CLONTECH公司SMART的指导说明书进行反转录合成cDNA第一链,引物见表1。
1.3 TfIL 15RαcDNA的全长克隆
从构建的cDNA文库中获得TfIL 15Rα基因的EST序列,利用primer设计特异性引物,分别进行3′ 和5′ RACE(表1)。PCR反应条件为94℃预变性5 min,94℃变性30 s,55℃复性30 s,72℃延伸40 s,进行30个循环后,72℃延伸7 min。然后将PCR纯化产物与pMD 18T载体进行连接、克隆测序,获得5′端和3′端序列片段。
1.4 TfIL 15Rα基因的序列分析
TfIL 15RαcDNA的全长通过软件BioEdit对EST序列及5′ 和3′ 端序列片段进行拼接获得;基因的蛋白翻译、等电点及分子量预测通过在线软件Expasy(http://www.au.expasy.org/)进行;使用http://www.cbs.dtu.dk/services/NetNGlyc/和PROSITE服务器(http://www.Expasy.org/prosite)对蛋白N 糖基化位点及可能的基序(motif)进行预测。通过SMART(http://smart.embl heidelberg.de/)对蛋白的信号肽、跨膜区段和sushi结构域进行预测;同源序列从NCBI下载后由Clustal W进行比对分析;并利用MEGA7.0软件进行TfIL 15Rα序列的系统发育分析。

表1 PCR引物名称及序列Tab.1 PCR primers and sequences
1.5 组织表达分析
应用qRT PCR来分析TfIL 15的组成型表达及刺激后表达模式的变化。设计特异性qRT PCR引物,模板为正常组织及不同时间点试验组和对照组的cDNA,内参基因选择β actin,按此进行反应。反应和分析使用7300实时荧光定量PCR仪(Applied Biosystems ABI,美国)进行。反应条件为:94℃3 min;94℃15 s,60℃60 s,40个循环[18]。反应结束后进行熔解曲线分析。每个样品cDNA进行3个平行实验。基因的相对表达量根据2 ΔΔCt法计算,使用T检验的方法进行差异显著性分析,P<0.05时认为是可接受的显著性差异标准。
2 结果与分析
2.1 TfIL 15Rα基因克隆及序列分析
松江鲈TfIL 15Rα的cDNA全长为998 bp(GenBank登录号:MT293626),包括5′ 非编码区(5′ UTR)85 bp,开放阅读框(ORF)663 bp和3′UTR 250 bp(图1)。基因ORF编码氨基酸220aa,其中前27aa为信号肽序列,成熟肽全长193aa。松 江 鲈TfIL 15Rα为 膜 受 体,经TMHMM2.0软件预测TfIL 15Rα蛋白包含145aa的胞外区,23aa的跨膜区(173~195 aa)及25aa的胞内区,且其胞外区只有一个sushi结构域(31~95 aa)。成熟肽含有1个可能的N糖基化位点:NDTQ,40~43;4个casein kinase II phosphorylation位点(5~8 aa,159~162 aa,199~202 aa,207~210 aa);两个N myristoylation位点(21~22 aa,117~122 aa);1个Protein kinase C phosphorylation位点(55~57 aa);各有1个c AMP and cGMP dependent protein kinase phosphorylation位点(100~103 aa及196~199 aa),这提示松江鲈IL 15Rα可经过不同修饰而产生结构的变化。
将TfIL 15Rα与其他物种同源序列进行比对(表2),发现TfIL 15Rα与三刺鱼(Gasterosteus aculeatus)的同源性最高为46%,其次为牙鲆(Paralichthysolivaceus)40%,与斑马鱼(Danio rerio)同源性为19%,与鱼类序列同源性为19%~46%,与哺乳类的同源性为23%~34%,相似性较低。多序列比对发现,同源区主要集中在sushi结构域部分,该区域所有物种的4个半胱氨酸(Cys)高度保守。此外,鱼类还有另外两个保守的Cys(图2)。

图1 TfIL 15Rα的cDNA序列及其编码序列Fig.1 Nucleotide and deduced am ino acid sequences of TfIL 15Rα

表2 脊椎动物IL 15同源性比对分析Tab.2 Am ino acid identity of TfIL 15Rαw ith other vertebrate IL 15 Rα
以NJ法构建系统发育树(图3),其结果显示松江鲈IL 15Rα与三刺鱼同源性较高,总体上与其他鱼类共聚为一支,而鸟类与哺乳动物聚为另一大支。
2.2 TfIL 15Rα组织表达模式分析
qRT PCR结果表明,TfIL 15 mRNA于松江鲈血、心、肝、鳃、肠、肾和卵等组织器官中均广泛表达。其中,鳃中的表达量最高,其次为肠和卵(图4)。
2.3 LPS刺激后各组织中TfIL 15基因的表达变化
腹腔注射LPS后,血液、皮肤、肝脏和脾脏中的TfIL 15RαmRNA表达量均上调(图5)。在皮肤中,TfIL 15RαmRNA的表达量于刺激后2 h明显上调,达到对照组的14倍,其后显著下调,并一直维持在较低表达水平;在血液中,TfIL 15Rα mRNA表达量同样于刺激后2 h迅速达到最高峰,为对照组的52倍,刺激后6 h与刺激后2 h相比,TfIL 15RαmRNA表达水平呈现较为显著的下降;在肝中,刺激后2 h,TfIL 15RαmRNA表达量上调至对照组的21倍,其后下降,并维持在较低水平,直到96 h再次上调表达,为对照组的25倍;在脾脏中,刺激后2 h TfIL 15RαmRNA表达量小幅度上调,至12 h达到最大表达量,为对照组的2倍,此后又下调表达,但变化幅度较小。

图3 基于不同物种IL 15 Rα的氨基酸序列构建的系统发育树Fig.3 Phylogenetic tree constructed w ith am ino acid sequences of IL 15 Rαfrom various species
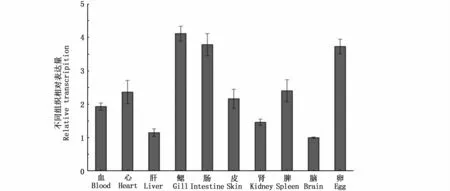
图4 TfIL 15Rα基因在正常组织中的表达模式Fig.4 Constitutive expression of TfIL 15RαmRNA in different tissues

图5 LPS刺激后TfIL 15Rα在不同组织的表达模式变化Fig.5 Temporary expression of TfIL 15RαmRNA in different tissues post LPS challenge
3 讨论
本研究成功克隆了松江鲈IL 15Rα基因的cDNA全长,并命名为TfIL 15Rα。TfIL 15Rα编码220aa的多肽,其中信号肽长27aa,成熟肽全长193aa。与松江鲈IL 15Rα不同,哺乳类的IL 15 Rα成 熟 肽 长 度 为231~237aa[8],鸡 的 为203aa[9]。成熟肽包括145aa的胞外区段(28~147),23aa的跨膜区段(173~195)和25aa的胞内区段(196~220),说明TfIL 15Rα编码的蛋白与哺乳动物IL 15Rα类似,是一种膜型受体蛋白[7]。在胞外区段存在一个特殊的sushi结构域(31~95),与IL 15具有高亲和力,在与细胞因子的结合中发挥重要作用。
经氨基酸序列比对发现,不同物种的同源相似区主要集中在sushi结构域,这与其承担着最重要的配体结合能力相关[16]。sushui结构域内的4个半胱氨酸具有高度保守性,在哺乳动物及鱼类中都有存在,并形成两对结构域内二硫键,使sushui区结构相似,这是其发挥配体结合功能的重要位点。另外,在松江鲈、暗绿鲀、红鳍东方鲀等鱼类的IL 15Rα中,还存在两个空间位置邻近的半胱氨酸,可能还能够参与形成鱼类特异的二硫键,从而使结构域稳定性得以增强[17]。总体上看,TfIL 15Rα与三刺鱼的同源性最高,但也只有46%。与鱼类序列同源性为19%~46%,变异程度比较大,这也解释了目前鱼类IL 15R研究较少的原因。
qRT PCR结果显示,TfIL 15Rα广泛表达于松江鲈各个组织器官中,包括血、心、肝、鳃、肠、皮、肾、脑、卵等,与哺乳动物及红鳍东方鲀、虹鳟等鱼类中IL 15Rα的表达具有相似性。TfIL 15Rα的广泛性表达模式类似实验前期研究的松江鲈TfIL 15的表达[21],表明IL 15Rα可能在机体正常生理过程中发挥重要的作用。值得注意的是,在卵中,TfIL 15Rα也表现出了与TfIL 15相似的较高的转录水平表达。IL 15/IL 15Rα表达模式的相似性,与IL 15/IL 15Rα信号转导系统能在这些场所发挥作用是相关的。
在分析TfIL 15Rα正常组织分布情况的基础上,我们以LPS为刺激物进行刺激实验,进一步分析了TfIL 15Rα在机体免疫中的作用。结果显示,在血液、皮肤和肝脏中,LPS刺激后2 h,TfIL 15Rα迅速上调至最高峰,在脾脏中12 h达到表达高峰,比血液、皮肤和肝脏稍有延迟。血液系统作为全身循环系统,承载各种免疫细胞和细胞因子;皮肤作为机体首先接触外界复杂水体环境的免疫组织,是最直接和快速的LPS应答和反应器官;而肝脏是鱼类多种重要免疫相关蛋白的合成场所,故经LPS刺激后短时间内能检测到TfIL 15Rα的上调表达。值得注意的是,在肝脏中,96 h再次出现一个新的表达高峰,这与松江鲈IL 15在肝中的表达情况相似[18],这是因为TfIL 15Rα作为TfIL 15特异受体,参与免疫相关信号通路激活与传导,故两者表达变化模式类似。96 h再次达到高峰推测是因为LPS刺激后鱼类先天免疫应答系统快速做出反应,激活一群免疫细胞,激活的免疫细胞分泌细胞因子,再次激活另一群免疫细胞,进行二次免疫应答。脾脏是各种淋巴细胞和白细胞等免疫细胞产生、储存和成熟的主要场所,因而上调时间有所滞后。小鼠感染肺炎后肺泡巨噬细胞和气道上皮细胞也同时上调表达IL 15和IL 15Rα[21]。IL 15的产生细胞,尤其是单核细胞和树突状细胞,可同时表达IL 15和IL 15Rα[22]。因此,松江鲈IL 15和IL 15Rα相似的上调表达模式提示,这两个基因可能通过其结合,从而在抗微生物感染的免疫反应中发挥作用。

