饲料中β 胡萝卜素添加量对脊尾白虾生长及抗氧化酶活性的影响
王 玉,柳 森,段健诚,王林华,邓高威,张庆起,阎斌伦,2,4,高 焕,2,4
(1.江苏海洋大学海洋科学与水产学院,江苏省海洋生物技术重点实验室,连云港 222005;2.江苏省海洋资源开发研究院,连云港 222005;3.连云港赣榆佳信水产开发有限公司,连云港 222100;4.江苏省农业种质资源保护与利用平台,南京 210014)
脊尾白虾(Exopalaemoncarinicauda)是我国水产养殖的重要品种之一[1]。在山东、江苏、浙江等沿海地区脊尾白虾的养殖面积已达2万hm2,年产量超过4.5万t[2]。但随着养殖分布和产量的不断扩大,脊尾白虾的种质退化非常明显,色质、存活率、抗氧化能力均有显著的下降[3]。因此开发新型饲料、改善脊尾白虾的色泽、促进脊尾白虾生长等对脊尾白虾养殖业的发展有重要作用。
研究表明类胡萝卜素对水产动物有重要影响,如改善水产动物体色和肉质、提高水产动物繁殖力、促进生长、提高抗氧化能力等[4]。而水产动物本身不能合成类胡萝卜素,只能从食物中获取[5],所以类胡萝卜素作为一种饲料添加剂在水产配合饲料中应用广泛。作为类胡萝卜素中最为重要的具有维生素A活性的一种,β 胡萝卜素对提升水产动物的生理功能有广泛作用[5],例如饲料中添加β 胡萝卜素可提高锦鲤(Cyprinuscarpio haematopterus)的色质、中华绒螯蟹(Eriocheirsinensis)的繁殖力和孵化率、鲑鱼属鱼类(Oncorhynchus)和鳟属鱼类(Salmo)的卵子质量、斑马鱼(Daniorerio)的抗氧化能力[6-9]。
本文拟使用不同剂量的β 胡萝卜素饲喂脊尾白虾仔虾,探究饲料中β 胡萝卜素的添加量对脊尾白虾的生长和抗氧化酶活性的影响,以期获得脊尾白虾饲料中β 胡萝卜素的最佳添加量,为脊尾白虾人工养殖提供参考。
1 材料与方法
1.1 材料与试剂
脊尾白虾仔虾(0.29±0.01)g由江苏连云港赣榆佳信水产开发有限公司提供。β 胡萝卜素添加剂(β 胡萝卜素含量1%)购自武汉秉德生物科技有限公司。超氧化物歧化酶(SOD)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)和过氧化氢酶(CAT)的测定所用试剂盒由南京建成生物工程研究所生产。
1.2 实验方法
1.2.1 实验设计
选取大小均匀、体格健壮、活动力强的脊尾白虾仔虾450尾,随机分成5组,每组设置3个重复,每个重复30尾,放入提前配备好海水的60 L(50 cm×40 cm×30 cm)小型硬塑料水箱内(箱中注水体积为箱容积的三分之二),β 胡萝卜素添加剂按0 g·kg-1(A组,对照)、0.5 g·kg-1(B组)、1.0 g·kg-1(C组)、1.5 g·kg-1(D组)、2.0 g·kg-1(E组)浓度加入基础饲料中投喂,脊尾白虾基础饲料的配置方案和成分含量参见表1。
1.2.2 实验饲料制备
根据表1配方,分别将各组原料混合均匀,超细粉碎,加入一定量的清水搅拌,再用绞肉机挤压出2 mm的颗粒,紧接着将挤压出的饲料放入60℃烘箱中3 h,再用搅拌机将饲料粒打碎,用筛绢网筛选出0.2~0.8 mm的饲料颗粒,置于-4℃冰箱保存备用。

表1 实验饲料配方和营养水平Tab.1 Test feed formula and nutritional level
1.2.3 饲养管理
养殖期间,自然光照,全天24 h充氧,溶氧量>5mg·L-1,盐度为23.0±0.1,pH为7.8±0.2,水温为16.0~20.0℃。实验开始前将脊尾白虾仔虾饥饿24 h,以达到清理虾肠道的目的。饲喂时间为早晚各喂一次,分别为早晨8∶00和下午6∶00,投喂量为初始脊尾白虾体质量的3%,实际投喂量根据脊尾白虾的生长状况和吃食情况进行适当的增减。投喂前每天进行清污,同时观察虾的生活状态,如果发现死虾,及时捞出,并做好记录。投喂饲料后0.5 h,对虾的进食情况进行观察,虾的头部如果出现灰色小点说明虾进食完成,根据情况吸出残饵,防止虾过度进食。在早晨投喂1 h以后进行换水,换水量为水体积的1/3,2 d换一次,换水前备好已配盐度并经曝气的海水。每天观察增氧机运行情况,防止虾因缺氧造成死亡。饲养周期为30 d。
1.3 样本采集与制备
饲养结束后,饥饿脊尾白虾24 h,将各个分组的存活虾全部捞出,分别装入袋子中,标好分组号,然后用纸巾吸掉体表的水分,测定各组实验虾总质量,取平均值得各组虾终末质量。用手术解剖刀片去壳、取肉、切碎,用电子天平准确称取0.2 g待测机体的肌肉组织,按质量(g)∶体积(mL)=1∶9的比重,用移液枪加入9倍体积的生理盐水,在冰水浴中用机械匀浆器匀浆,每次匀浆10 s,间隔休息30 s,匀浆3~5次,于冷冻离心机中5 000 r·min-1离心10 min,取上清液按1∶9的比例用生理盐水稀释成1%组织匀浆,放入冰箱中-20℃保存待测,并于24 h内测完酶活,酶活测定方法严格按照说明书进行。
1.4 指标测定
存活率(SR)、特定生长率(SGR)、质量增加率(WGR)具体计算公式如下:
存活率(%)=st/s0×100%
特定生长率(%·d-1)=(lnwt-lnw0)/t×100%
质量增加率(%)=(wt-w0)/w0×100%式中,wt是实验结束时脊尾白虾的平均体质量(g),w0是实验初始脊尾白虾的平均体质量(g),st是实验结束时脊尾白虾存活数量(尾),s0为实验初始投放脊尾白虾数量(尾),t为实验周期(d)。
1.5 数据处理方法
所有测得的数据均采用平均值±标准差(Mean±SD)表示。利用SPSS 18.0软件进行单因素方差分析,并采用LSD法进行多重比较分析,P<0.05表示差异显著。
2 结果与分析
2.1 添加β 胡萝卜素对脊尾白虾生长的影响
添加β 胡萝卜素对脊尾白虾生长有显著的影响,显著性检验结果见表2,其中脊尾白虾的特定生长率(SGR)、质量增加率(WGR)、存活率(SR)在浓度0.5~1.5 g·kg-1范围内显著高于对照组(P<0.05),β 胡萝卜素添加量在0.5 g·kg-1、1.0 g·kg-1、1.5 g·kg-1时,SGR分别增加11.94%、6.29%、10.69%,WGR分别增加89.88%、65.24%、80.94%,SR分 别 增 加83.35%、50.01%、60.01%,均显著高于对照组(P<0.05)。但添加浓度达到2.0g·kg-1时,与对照组相比,SGR不再增加,SR则有下降的趋势,下降幅度达16.65%。比较各添加浓度组,β 胡萝卜素添加量在0.5 g·kg-1时β 胡萝卜素对脊尾白虾生长的效果最佳,SGR、WGR、SR增加幅度达到最高(11.94%、89.88%、83.35%),并明显高于对照组(P<0.05)。

表2 饲料中β 胡萝卜素添加量对脊尾白虾生长的影响(平均值±标准差)Tab.2 Effect ofβ carotene addition in feed on grow th performance of Exopalaemon carinicauda(M ean±SD)
2.2 添加β 胡萝卜素对脊尾白虾抗氧化酶活性的影响
通过测定脊尾白虾肌肉组织中超氧化物歧化酶(SOD)、酸性磷酸酶(ACP)、碱性磷酸酶(AKP)和过氧化氢酶(CAT)活性,表明β 胡萝卜素的添加量对脊尾白虾抗氧化酶活性有显著的影响(表3)。β 胡萝卜素的添加量在0.5~1.5 g·kg-1范围内,脊尾白虾的抗氧化能力均有一定程度的提升。β 胡萝卜素添加量在0.5 g·kg-1、1.0 g·kg-1、1.5 g·kg-1时,相对于对照组,SOD分别增加10.41%、33.04%、18.81%,ACP分别增加46.50%、38.09%、57.76%,CAT分别增加148.82%、105.29%、102.94%;其中SOD在β 胡萝卜素添加量1.0 g·kg-1时最高,达到60.84 U·mgprot-1,ACP在β 胡萝卜素添加量1.5 g·kg-1时最高,达到66.97 U·mg-1,CAT在β 胡萝卜素添加量0.5 g·kg-1时最高,达到4.23 U·mgprot-1;而AKP分 别 下 降41.04%、12.74%、37.74%。β 胡萝卜素的添加量达到2.0 g·kg-1时,脊尾白虾的抗氧化能力并没有提升,SOD、ACP和CAT与对照组无明显差异(P>0.05),相反AKP出现了显著增加,相比对照组提高了35.61%。
3 讨论
3.1 β 胡萝卜素对脊尾白虾生长的影响
本研究通过测定脊尾白虾的特定生长率、质量增加率、存活率,发现一定浓度的β 胡萝卜素对脊尾白虾的生长有显著促进效果,其中添加量在0.5 g·kg-1时,特定生长率、质量增加率、存活率分别提高了11.94%、89.88%、83.35%,揭示了β 胡萝卜素作为水产动物饲料添加剂的可行性。β 胡萝卜素对水产动物生长影响的研究已有多次报道,例如杨新瑜和刘贵军[10]以4%的β 胡萝卜素添加在饲料中投喂89尾均重128 g的中华鳖(Trionyxsinensis)73 d,结果发现,添加β 胡萝卜素的试验组成活率比对照组提高了13.5%,日增重提高了105.6%。袁春营和崔青曼[7]以添加50、100 mg·kg-1β 胡萝卜素的饲料饲喂中华绒螯蟹(Eriocheirsinensis)60 d,结果发现,中华绒螯蟹的存活率都达到了100%,质量增加率比对照组分别提高了13.08%、26.23%。白东清等[11]以添加1.0g·kg-1β 胡萝卜素(1%)的饲料饲喂锦鲤(Cyprinuscarpiohaematopterus)2个月,结果发现,锦鲤的增长率达到370.2%,显著高于对照组。这些研究结果说明饲料中适当添加β 胡萝卜素确实能促进水产动物生长。但是,本文研究也发现当β 胡萝卜素(1%)添加量达到2.0 g·kg-1时,脊尾白虾的存活率与对照组相比下降了16.65%。尽管较高剂量β 胡萝卜素导致脊尾白虾死亡的机制不明,但是不能否认β 胡萝卜素对脊尾白虾的积极调节效果。本实验规格(0.29±0.01)g的脊尾白虾饲料中β 胡萝卜素(1%)添加量为0.5 g·kg-1时,发现脊尾白虾生长效果最好,因此在水产养殖过程中探明脊尾白虾生长对β 胡萝卜素添加浓度的响应范围后,β 胡萝卜素可以作为养殖脊尾白虾的一种饲料添加剂。
3.2 饲料中添加β 胡萝卜素对脊尾白虾抗氧化酶活性的影响
本研究对脊尾白虾肌肉组织中超氧化物歧化酶、过氧化氢酶、酸性磷酸酶和碱性磷酸酶活性测定表明,β 胡萝卜素对脊尾白虾抗氧化性有显著影响,且依赖于β 胡萝卜素的添加浓度。一般认为超氧化物歧化酶通过歧化反应把动物机体中有害的超氧自由基转化成过氧化氢(H2O2)[12-13],再通过过氧化氢酶将过氧化氢转化成水,从而完成对机体的保护防御[14-15]。当β 胡萝卜素的添加量在0.5~1.5 g·kg-1范围内时,发现脊尾白虾的抗氧化能力有一定程度的提升,韩继卫等[16]以β 胡萝卜素饲喂三角帆蚌(Hyriopsiscumingii)时,发现随着β 胡萝卜素浓度的升高,SOD与CAT酶的活力先升高后降低,本文的结果与其相似。其他水产动物如仿刺参(Apostichopusjaponicus)的抗氧化能力随饲料中β 胡萝卜素含量(30~60 mg·kg-1)的增加而差异不明显,但添加达到90 mg·kg-1时SOD、CAT酶 活 性 出 现 下 降[17];脂 鲤(Hyphessobrycon caltistus)摄食添加类胡萝卜素的饲料后血清中的总抗氧化能力出现升高,SOD活力则降低[18];中华绒螯蟹摄食添加适量β 胡萝卜素饲料后体内SOD活性降低[7],本文结果与其有所差异,但这些研究都表明β 胡萝卜素与水产动物的抗氧化能力有一定的关联性。
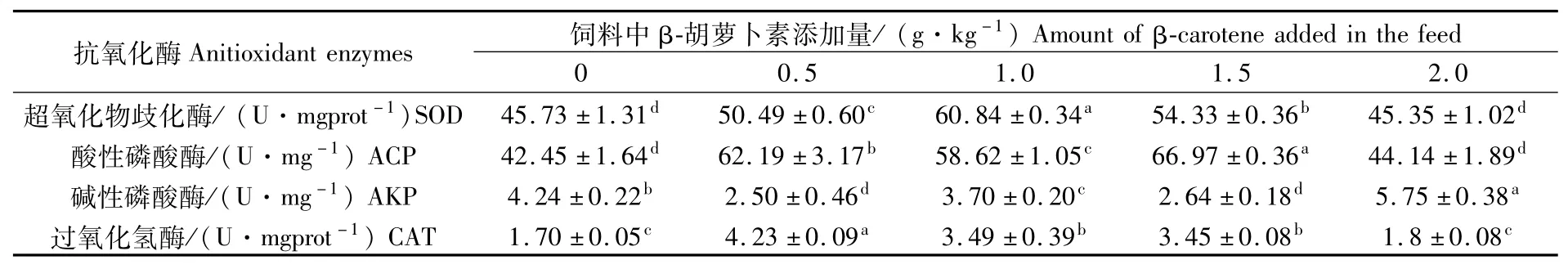
表3 饲料中β 胡萝卜素添加量对脊尾白虾抗氧化酶的影响(平均值±标准差)Tab.3 Effect ofβ carotene addition in feed on antioxidant enzymes in Exopalaemon carinicauda(M ean±SD)
酸性磷酸酶和碱性磷酸酶是甲壳类动物体内不可或缺的非特异性免疫酶,其免疫机制是直接参与磷酸基团的化学反应,降解生物机体体表的磷酸类物质[19-20],这种免疫机制是造成细胞活性氧的来源之一[21]。本研究发现添加β 胡萝卜素后各添加组酸性磷酸酶活性出现了一定程度的增加。张坤[22]研究发现饲料中添加含β 胡萝卜素含量高的胶红酵母可以显著提高刺参(Oplopanaxelatus)的酸性磷酸酶活性,冯任勇和周小秋[23]研究也发现维生素A(β 胡萝卜是一种维生素A源)提高了建鲤(C.carpiovar.jian)的酸性磷酸酶活性。在测定碱性磷酸酶活性时,本文发现β 胡萝卜素的添加量在0.5~1.5 g·kg-1范围内碱性磷酸酶活性出现下降,与酸性磷酸酶的结果相反。何海琪和孙凤[24]对中国明对虾(Penaeuschinensis)的研究表明对虾的碱性磷酸酶在肌肉中几乎测不出活性,而在肝胰脏中活性很高,并认为碱性磷酸酶具有组织特异性,因此尽管笔者测定发现添加一定范围剂量β 胡萝卜素的脊尾白虾肌肉碱性磷酸酶活性出现下降,但不能认为脊尾白虾免疫能力的下降。
另外,本研究通过分析β 胡萝卜素对脊尾白虾抗氧化酶活性的影响,发现除碱性磷酸性酶外,其他几个酶活性相对于对照组来说都有增强,但变化幅度与β 胡萝卜素的添加浓度不一致,与生长情况也不一致,表明β 胡萝卜素对脊尾白虾肌肉组织中超氧化物歧化酶、过氧化氢酶、酸性磷酸酶活性及脊尾白虾生长情况的影响在0.5~1.5 g·kg-1范围内是非线性的。这种不一致现象在三角帆蚌[16]、仿刺参[17]、建鲤[23]的研究中也被发现。因此本研究认为β 胡萝卜素对水产动物非特异性免疫能力的增强既依赖于β 胡萝卜素的浓度,也依赖于具体的生物种类。

