长江口中华绒螯蟹抱卵前后的标准代谢和窒息点
姬 慧,冯广朋,庄 平,耿 智,黄晓荣
(1.上海海洋大学水产与生命学院,上海 200090;2.中国水产科学研究院东海水产研究所,农业农村部东海与长江口渔业资源环境科学观测实验站,上海 200090)
中华绒螯蟹(Eriocheirsinensis)俗称河蟹,为我国重要的经济物种之一,长江水系野生中华绒螯蟹具有优异的养殖性能和经济价值[1]。野生中华绒螯蟹具有索饵洄游和生殖洄游的习性,其生活史的不同阶段受水域环境影响较大。天然水域环境中的氧含量往往影响水生动物的代谢、生长和繁殖,水体严重缺氧时甚至会导致水生动物死亡[2]。人类活动增加了水体的营养输入,改变了沿海水域溶氧的含量,水体夏季缺氧和底层缺氧的情况在世界范围内普遍存在[3]。墨西哥湾北部海域低氧发生后,大型底栖动物群落的丰度和物种多样性降低[4];在德克萨斯湾的河口水域中,鱼类大量死亡的主要原因是由物理和生物因素所引起的溶氧浓度降低[5]。长江口是中华绒螯蟹最主要的天然产卵场,受径流量和风的影响,其缺氧面积在扩大[6]。近几年来,河口富营养化的程度加剧,造成该水域浮游植物生物量增加,降低了水体的透明度,导致溶解氧含量降低[7-10]。
研究环境因子对生物体生理代谢影响最常用的方法是标准代谢[11]。迄今为止,对甲壳类标准代谢的研究主要集中在生物因素(体质量、饥饿、摄食、维生素)[12-16]和非生物因素(温度、盐度、氧张力、维生素)[17-21]方面。衡量水生动物标准代谢的重要指标是耗氧率、排氨率及窒息点[22]。目前对中华绒螯蟹标准代谢的研究较少,迄今仅见中华绒螯蟹成蟹和幼蟹短时间内耗氧率和排氨率的研究[23-25]。长江口水体中溶解氧含量的降低是否会对中华绒螯蟹的产卵活动和代谢造成影响仍不清楚,中华绒螯蟹雌蟹抱卵前后对溶解氧的需求也未见相关报道。因此,本文通过研究长江口中华绒螯蟹抱卵前后的耗氧率、排氨率及窒息点,旨在揭示溶解氧含量与中华绒螯蟹抱卵前后代谢的关系及其对低氧所承受的阈值,为阐述中华绒螯蟹繁殖期的能量代谢机理及其繁殖生物学特性提供基础资料和参考数据。
1 材料与方法
1.1 实验材料
实验所用的中华绒螯蟹雌蟹采自长江口团结沙水域(121°57′34″E、31°23′33″N),抱卵前雌蟹和抱卵后雌蟹各30只,其采集时间分别为2018年11月和2019年1月。样品采集后,运回中国水产科学研究院东海水产研究所实验室暂养。实验前挑选出体质量相似、个体健壮、附肢完整的个体,在水温为(16±1)℃水族箱中暂养1 d,实验用水为曝气48 h以上的自来水,其中抱卵前体质量为(46.55±7.57)g、壳宽为(44.51±2.59)mm、壳长为(41.33±1.75)mm;抱卵后体质量为(69.40±15.92)g、壳宽为(48.83±3.92)mm、壳长为(41.17±4.07)mm,其中卵块质量为(16.52±3.64)g。
1.2 实验方法
分别以抱卵前雌蟹和抱卵后雌蟹为实验对象,设计2个试验组。每个试验组选取18只肢体健全、活性良好的蟹,将其分为3组,作为3个平行实验,每组6只蟹;实验开始时,每个试验组的3次平行同时进行,每次平行实验需用7个玻璃瓶,其中6个玻璃瓶中每个装1只蟹,作为代谢瓶,最后1个玻璃瓶不放蟹作为对照瓶。玻璃瓶均采用2 L带隔板的广口瓶,瓶内插入直径0.3 cm塑料管道,且管外带有铁夹密封;实验开始时将玻璃瓶放入恒温水浴箱[(16±1)℃]中,装满曝气去氯3 d以上的自来水,在每个代谢瓶中放入1只蟹,然后用液体石蜡进行液封,再用保鲜膜进行密封。实验均从上午8∶00开始,每2 h取1次样,采用50 mL注射器吸取水样进行相关指标测定,测定指标分别为溶氧(DO)和NH3N含量,实验共持续12 h。玻璃瓶初始浓度DO为(9.33±0.39)mg·L-1、NH3N为(0.04±0.01)mg·L-1。
溶氧(DO)测定采用温克勒(Winkler)碘量法(GB 7489 87),用纳氏试剂比色法(HJ535 2009)测定氨氮(NH3N)含量[26]。实验结束后,测量蟹湿体质量、壳长、壳宽等生物学指标。
1.3 耗氧率、NH3 N排泄率、耗氧量和排氨量的计算
中华绒螯蟹雌蟹耗氧率、NH3N排泄率、CO2排泄率、耗氧量和排氨量分别用下列公式计算[24]:
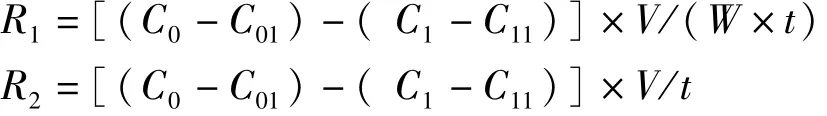
式中,R1为单位体质量耗氧率[mg·(g·h)-1],R2为溶氧量(mg·h-1),C0为实验开始时代谢瓶中溶氧(mg·L-1),C1为实验开始时对照瓶溶氧(mg·L-1),C01为实验结束时代谢瓶中溶氧(mg·L-1),C11为实验结束时对照瓶中溶氧(mg·L-1)。
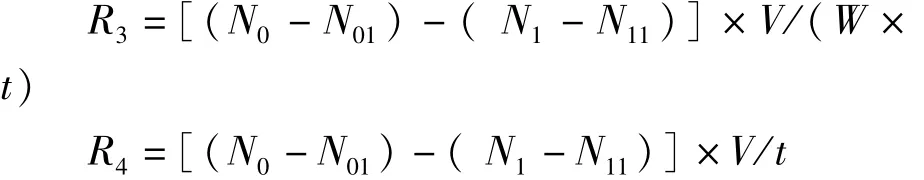
式中,R3为RNH3 N排出率或者RCO2排出率[mg·(g·h)-1];R4为排氨量(mg·h-1)。N0为实验结束时代谢瓶中NH3N含量(mg·L-1)或者CO2含量(mg·L-1),N01为实验开始时代谢瓶中NH3N含 量(mg·L-1)或 者CO2含 量(mg·L-1),N1为实验结束时对照瓶中NH3N含量(mg·L-1)或者CO2含量(mg·L-1),N11为实验开始时对照瓶中NH3N含量(mg·L-1)或者CO2含量(mg·L-1)。
V为玻璃瓶中水的体积(L),W为蟹湿体质量(g),t为实验持续时间(h)。
1.4 氧氮比和能耗率
根据耗氧率、CO2排出率及NH3N排泄计算其氧氮比和能耗率[27-28],计算公式如下:

式中,R1为耗氧率[mg·(g·h)-1];RCO2为CO2排出率[mg·(g·h)-1];RNH3 N为NH3N排泄率[mg·(g·h)-1];RE为能量代谢率[J·(g·h)-1]。
1.5 窒息点的检测
在静水密闭条件下,(16±1)℃水温下,随着代谢瓶中溶氧含量的下降,中华绒螯蟹雌蟹会逐渐死亡。判断其死亡的标准与三疣梭子蟹(Portunustrituberculatus)[24]基本一致,主要表现为蟹静卧瓶底不动,两只螯足掉落,步足僵硬、团脐向上张大等特点,在实验过程中,若有实验蟹出现以上特征,认定为实验蟹已死亡,立即抽取一定量水样,并测定水样中的溶氧量作为窒息点。分别记录50%和100%比例的蟹死亡时的溶解氧数值,作为临界窒息点[25]和窒息点[29]。
1.6 数据分析
用MSExcel 2016进行数据统计,采用SPSS 18.0软件的配对样本T检验来检测中华绒螯蟹雌蟹抱卵前后的窒息点、耗氧率、NH3N排泄率、氧氮比及能耗率的差异显著性(P<0.05)。
2 结果与分析
2.1 中华绒螯蟹雌蟹抱卵前后的窒息点
配对样本T检验结果显示,中华绒螯蟹雌蟹抱卵前后的窒息点、临界窒息点和第1只蟹死亡的溶氧浓度值存在显著性差异(P<0.05)(表1)。对于窒息点而言,抱卵前窒息点(2.591±0.652)mg·L-1显 著 大 于 抱 卵 后 窒 息 点(1.101±0.310)mg·L-1(P<0.05);对于临界窒息点而言,抱卵前临界窒息点(3.432±0.321)mg·L-1显 著 大于抱卵后(2.161±0.401)mg·L-1(P<0.05);对于第1只实验蟹死亡的溶氧浓度值,抱卵前(3.502±0.431)mg·L-1显著大于抱卵后(3.001±0.269)mg·L-1(P<0.05)。
2.2 中华绒螯蟹雌蟹抱卵前后的耗氧量和耗氧率
随着代谢瓶中溶氧含量降低(图1),发现在2 h之后代谢瓶中溶氧含量随时间的变化趋于平稳,溶氧与时间的回归方程分别为抱卵前雌蟹:y=0.204 3x+6.036 7(R2=0.921)和抱卵后雌蟹:y=0.250 9x+4.222(R2=0.965 7)。中华绒螯蟹雌蟹抱卵前后在12 h内耗氧量变化呈下降的趋势,且变化幅度由大变小(图2),在实验2 h时测定,抱卵后的耗氧量(5.992 mg·h-1)显著大于抱卵前(3.050 mg·h-1)(P<0.05);在实验开始4 h、6 h、8 h、10 h时测定,中华绒螯蟹雌蟹抱卵前后耗氧量无显著性差异(P>0.05),其中在实验4 h时,抱卵前的耗氧量(1.315 mg·h-1)首次大于抱卵后(0.897 mg·h-1),在实验6 h时,抱卵前后的耗氧量均达到最小,其值分别为0.149 mg·h-1和0.268 mg·h-1。
随着代谢瓶中溶氧含量的降低(图1),中华绒螯蟹抱卵前后的耗氧率均呈下降趋势,且变化幅度由大变小(图3)。配对样本T检验结果显示,在实验2 h、4 h、6 h、8 h、10 h时测定,中华绒螯蟹雌蟹抱卵前后的耗氧率差异不显著(P>0.05);其中在2 h时测定,抱卵前后耗氧率均达到最高,抱卵后耗氧率0.089 mg·(g·h)-1大于抱卵前0.066 mg·(g·h)-1;在实验4 h时测定,抱卵前耗氧率0.030 mg·(g·h)-1首次大于抱卵后0.015 mg·(g·h)-1;在实验6 h时测定,抱卵前后的耗氧率均降到最低,其值分别为0.003 mg·(g·h)-1和0.004 mg·(g·h)-1。
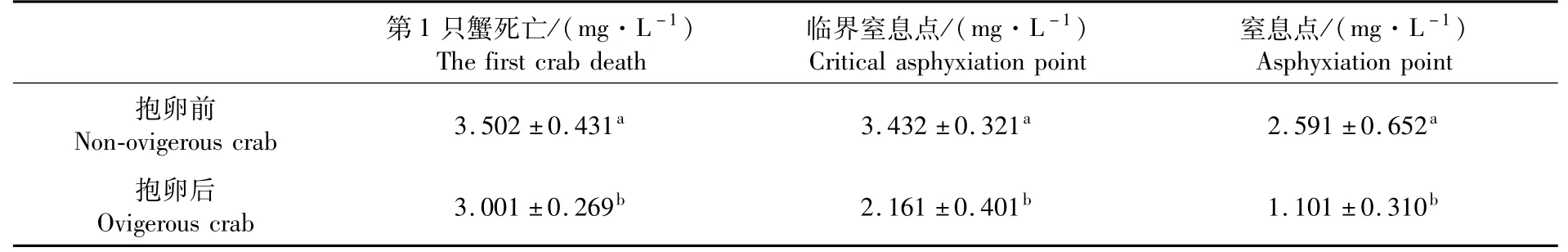
表1 中华绒螯蟹雌蟹抱卵前后的窒息点变化(n=18)Tab.1 Changes of asphyxiation point of female non ovigerous and ovigerous Eriocheir sinensis(n=18)
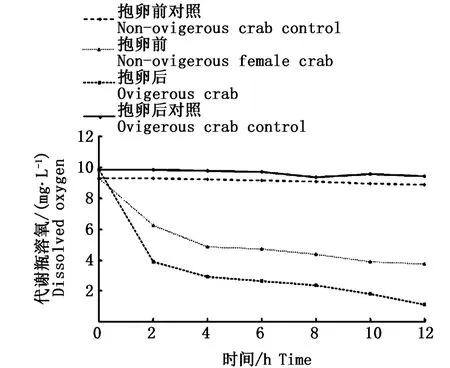
图1 中华绒螯蟹雌蟹抱卵前后代谢瓶溶氧的变化Fig.1 Changes of dissolved oxygen(DO)concentration in water with metabolism of female non ovigerous and ovigerous Eriocheir sinensis

图2 中华绒螯蟹雌蟹抱卵前后耗氧量的变化Fig.2 Changes of oxygen consum ption of female non ovigerous and ovigerous Eriocheir sinensis

图3 中华绒螯蟹雌蟹抱卵前后耗氧率的变化Fig.3 Changes of oxygen consumption rate of female non ovigerous and ovigerous Eriocheir sinensis
2.3 中华绒螯蟹雌蟹抱卵前后的排氨量和排氨率
在12 h内中华绒螯蟹雌蟹抱卵前后代谢瓶中氨氮含量变化呈上升的趋势(图4),随着代谢瓶中溶氧含量的降低,中华绒螯蟹雌蟹抱卵前后排氨量呈现出“下降-上升”的趋势(图5)。在实验2 h、4 h、6 h时测定,中华绒螯蟹雌蟹抱卵前后排氨量差异不显著(P>0.05),其中在实验2 h时测定,中华绒螯蟹雌蟹抱卵前后排氨量最高,抱卵后排氨量(1.379 mg·h-1)大于抱卵前(1.194 mg·h-1);在4 h时,抱卵前排氨量(0.433 mg·h-1)首 次 大 于 抱 卵 后(0.357 mg·h-1);在实验6 h时测定,抱卵前和抱卵后排氨量达到最低,其值分别为0.109 mg·h-1和0.096 mg·h-1,继6 h降到最低值后,抱卵前后分别在8 h时,排氨量再次升高,其值分别为0.464 mg·h-1和0.206 mg·h-1。
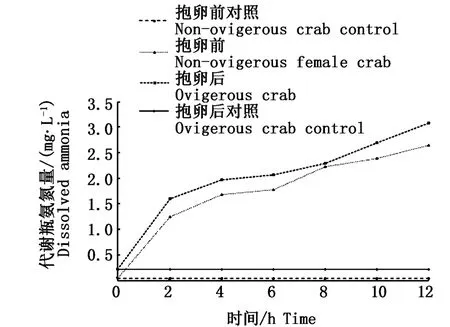
图4 中华绒螯蟹雌蟹抱卵前后代谢瓶氨氮量的变化Fig.4 Changes of dissolved ammonia concentration in water w ith metabolism of female non ovigerous and ovigerous Eriocheir sinensis

图5 中华绒螯蟹雌蟹抱卵前后排氨量的变化Fig.5 Changes of ammonia discharge of female non ovigerous and ovigerous Eriocheir sinensis
抱卵前后中华绒螯蟹排氨率随代谢瓶中溶氧含量的降低呈现“下降-上升”的趋势(图6)。在实验开始2 h、4 h、6 h、8 h时,抱卵前的排氨率均大于抱卵后,且相互间差异不显著(P>0.05);在实验2 h时测定,抱卵前和抱卵后的排氨率达到最大,其值分别为0.027 mg·(g·h)-1和0.020 mg·(g·h)-1;在实验6 h时,抱卵前和抱卵后的排氨率达到最低,其值分别为0.002 mg·(g·h)-1和0.001 mg·(g·h)-1;在实验10 h时,抱卵后的排氨率0.011mg·(g·h)-1显著大于抱卵前0.003 mg·(g·h)-1(P<0.05)。

图6 中华绒螯蟹雌蟹抱卵前后排氨率的变化Fig.6 Changes of ammonia excretion rate of female non ovigerous and ovigerous Eriocheir sinensis
2.4 中华绒螯蟹雌蟹抱卵前后的氧氮比和能耗率
随着代谢瓶中溶氧含量的降低(图1),在4 h之后,中华绒螯蟹雌蟹抱卵前后氧氮比和能耗率均呈下降趋势(表2)。配对样本T检验得出,对于氧氮比而言,在实验2 h、4 h、6 h时测定,抱卵前和抱卵后的氧氮比均无显著差异性(P>0.05);其中在2 h时测定,抱卵后的氧氮比(4.287±1.741)大于抱卵前(3.042±0.803);在实验4 h时测定,抱卵前的氧氮比均大于抱卵后。对于能耗率而言,在实验2 h时,抱卵后的能耗率(1.07±0.11)大于抱卵前(0.62±0.03),且相互间无显著性差异(P>0.05);在实验4 h时测定,抱卵前的能耗率大于抱卵后。
3 讨论
3.1 中华绒螯蟹抱卵前后的窒息点变化
水生生物自身的生理反应受所处环境中溶氧含量的影响,不同水生生物有不同的临界氧浓度,当其所处水域的溶氧瞬间下降或远小于临界氧浓度时,若其不能够躲避低溶氧环境,将对自身造成生理和生化上的影响,严重可致死亡。窒息点能够直接反映水生生物存活的最低溶氧值,并且是衡量水生生物对低氧耐受力的重要参数[30]。本研究结果发现,中华绒螯蟹抱卵前的窒息点(2.591±0.652)mg·L-1显著大于抱卵后(1.101±0.310)mg·L-1,推测原因之一是,在自然条件下中华绒螯蟹抱卵后由于腹部抱卵,行为活动迟缓,一般半埋在沙子和淤泥中,活动和摄食很少[31],通过降低代谢活动以逐渐适应低氧环境,对低氧的敏感性弱;原因之二是窒息点与体质量的关系存在两种类型,一种是窒息点随体质量的升高而降低,另一种是窒息点随体质量的升高而升高[32],本实验中抱卵前体质量(46.55±7.57)g小于抱卵后(69.40±15.92)g,报卵前后窒息点的差异可能是受其体质量的影响,这与李朝华等[24]研究三疣梭子蟹(Ⅹ~Ⅺ期)的结果一致。

表2 中华绒螯蟹雌蟹抱卵前后的氧氮比和能耗率Tab.2 Oxygen nitrogen ratio and energy consumption ratio of female non ovigerous and ovigerous Eriocheir sinensis
3.2 溶氧对中华绒螯蟹抱卵前后雌蟹代谢的影响
耗氧率和氨氮排泄率是反映水生动物标准代谢高低和变化规律的重要指标[22]。水体中溶氧(DO)含量充足时,水生生物自身的耗氧率和排氨率也会相应增高,反之,水体中DO含量较低时,机体的耗氧率和排氨率随DO含量的降低而降低[11]。本研究中,随着代谢瓶中溶氧的降低,抱卵前后的耗氧量与耗氧率、排氨量与排氨率均呈现下降趋势,说明低氧降低了中华绒螯蟹雌蟹抱卵前后的代谢,这与低氧条件下中华绒螯蟹仔蟹[28]、齐口裂腹鱼(Schizothoraxprenanti)[33]和中华鰟鮍(Rhodeussinensis)[34]等代谢机制一致。研究表明[35],水生动物对低氧的调节能力与个体大小相关,一般情况下个体大的对低氧的调节能力强,且对低氧的耐受力强。本研究中,实验进行2 h时,抱卵后的耗氧率、排氨量和耗氧量均高于抱卵前,随着代谢瓶中溶氧含量进一步降低,抱卵后的耗氧率和排氨率逐渐低于抱卵前,这可能由于在低氧条件下,蟹通过提高颚舟片拍打频率来适应低氧环境,这种提高呼吸频率的方式是需要耗能的,因此个体大的有更多的能量去调节呼吸频率,用于抵抗低氧环境,这与李丽萍等[36]研究的背角无齿蚌(Anodontawoodiana)的结果一致。本研究结果还发现,随着代谢瓶中溶氧含量的降低,2 h、4 h、6 h、8 h、10 h时,抱卵前和抱卵后的耗氧率和排氨率无显著差异,说明在低氧条件下,中华绒螯蟹雌蟹抱卵前后单位体质量的代谢率无显著差异。
机体分解体内的蛋白质、脂肪和碳水化合物等能源物质时所消耗的氧气和排泄氨之间的比率称为氧氮比(O∶N),是衡量机体能量代谢的一项重要指标,揭示了机体能量来源的组成及能量代谢的路径[37]。甲壳动物分解的含氮终产物主要以氨氮形式排放,因此氨氮排泄率可作为体内蛋白质分解速率的指标之一。从理论上讲,纯蛋白分解代谢,其氧氮比为3~16;若蛋白质和脂质同等代谢比例时,其氧氮比为50~60;若脂类和碳水化合物代谢时,其氧氮比逐渐增大,氧氮比越低则代表能量代谢底物中蛋白质比例越大。本研究中,抱卵前后氧氮比随溶氧含量的降低,其比值趋向小于16的方向,说明低氧促进长江口中华绒螯蟹雌蟹抱卵前后以蛋白质为代谢底物方向转变,这与三疣梭子蟹[38]及黄金鲈(Percaflavescens)[39]的主要代谢能源物质一致。在8 h、10 h和12 h时,抱卵后的氧氮比显著低于抱卵前,推测可能是因为中华绒螯蟹抱卵后在水中完成胚胎发育时,更倾向于利用蛋白质作为能源代谢物质[40]。
4 小结
本实验表明低溶氧降低了长江口中华绒螯蟹雌蟹抱卵前和抱卵后的代谢水平;低溶氧条件下,雌蟹抱卵前和抱卵后单位体质量的代谢率无显著变化;长江口中华绒螯蟹雌蟹抱卵前后的能源代谢底物中蛋白质含量随溶氧含量的降低而升高。本研究结果揭示了在溶氧含量降低的条件下,中华绒螯蟹雌蟹抱卵前后标准代谢特征以及对低氧所承受的阈值,有助于进一步阐明中华绒螯蟹雌蟹抱卵前后的代谢机理,丰富其繁殖生物学知识。

